外源性胰岛素抗体综合征3例并文献复习
2022-01-28谷伟军杨国庆巴建明吕朝晖窦京涛母义明
刘 静,臧 丽,谷伟军,杨国庆,陈 康,裴 育,杜 锦,巴建明,吕朝晖,窦京涛,母义明
1 解放军总医院第一医学中心 内分泌科,北京 100853;2 龙口市人民医院 内分泌科,山东烟台 265700
胰岛素是治疗糖尿病的有力武器,但外源性 胰岛素可诱发机体免疫反应,导致不良临床事件的发生。1956年,Berson 等[1]首次报道接受外源性动物胰岛素治疗的糖尿病患者血清中存在胰岛素自身抗体(insulin autoantibody,IAA),随后发现人胰岛素或胰岛素类似物亦可诱导IAA 产生。糖尿病患者中外源性胰岛素诱导的IAA 与过敏反应、血糖异常和代谢控制等临床事件相关,主要表现为严重胰岛素抵抗、高血糖、高血糖与低血糖交替,称为外源性胰岛素抗体综合征(exogenous insulin antibody syndrome,EIAS)[2]。本文报道了解放军总医院第一医学中心诊断的3例EIAS 患者的临床表现、实验室检查及治疗方案,旨在提高临床医生对EIAS 的认识。
病例资料
病例1:患者,男性,43 岁,因“血糖高13年,血糖控制差2年”于2019年10 月入院。患者2006年诊断为“2型糖尿病”,起始胰岛素治疗,既往血糖控制达标。2017年无诱因血糖进行性升高,应用门冬胰岛素联合地特胰岛素治疗,胰岛素总量高达76~ 200 U/d。入院前降糖方案为生物合成人胰岛素14+10+14 U 三餐前皮下注射、精蛋白生物合成人胰岛素18 U/早+16 U/睡前皮下注射、阿卡波糖100 mg 3 次/d、吡格列酮45 mg 1 次/d、利格列汀5 mg 1 次/d,自测空腹血糖15~18 mmol/L,餐后2 h 血糖>20 mmol/L。查体:体质量指数(body mass index,BMI) 为20.2 kg/m2,腰围为83 cm,臀围为89 cm,无黑棘皮样改变。入院查糖化血红蛋白(glycosylated hemoglobin,HbA1c) 12.0%,尿酮体阳性,肝肾功能、血脂等均未见异常(表1)。正常餐试验示空腹及餐后血糖明显升高,空腹胰岛素偏高,餐后2 h 胰岛素较空腹降低,C 肽与胰岛素变化不一致(表2)。诊断为糖尿病酮症、2型糖尿病。因皮下注射大剂量胰岛素仍有严重高血糖伴糖尿病酮症,入院后给予生物合成人胰岛素注射液持续静脉泵入[235~425 U/d,3.6~ 6.6 U/(kg·d)],监测血糖波动在5.8~26.1 mmol/L。使用大剂量外源性胰岛素治疗血糖仍不能控制,考虑存在EIAS 可能(高滴度IAA与胰岛素结合致胰岛素作用障碍),遂查IAA 为49.32 U/mL(正常值0~ 0.40 U/mL),其他自身抗体检查均阴性,支持EIAS 诊断。给予甲泼尼龙500 mg/d冲击治疗3 d,期间胰岛素用量无明显减少(200~224 U/d),监测血糖无改善(14.6~ 22.98 mmol/L)。考虑激素冲击效果不佳,更换为血浆置换治疗5 次、人免疫球蛋白20 g/d 治疗3 d。治疗后静脉胰岛素用量减少至75 U/d,血糖波动在5.3~11.3 mmol/L。出院后给予德谷胰岛素25 U 睡前皮下注射、生物合成人胰岛素20+20+20 U 三餐前皮下注射,另予泼尼松、羟氯喹、硫唑嘌呤治疗。3个月后停上述药物,胰岛素总量54 U/d,血糖控制在5.7~ 10.4 mmol/L,1年后复查IAA 为4.36 U/mL。
病例2:患者,男性,60 岁,因“血糖高15年,间断低血糖3年”于2016年11 月入院。患者2001年诊断为“2型糖尿病”,予消渴丸、阿卡波糖治疗。2008年起始门冬胰岛素30 注射液治疗,血糖控制尚可。2013年出现间断性低血糖,多午餐前出现,最低血糖2.6 mmol/L。入院前降糖方案为门冬胰岛素30 注射液10 U/早+12 U/晚 餐前皮下注射,维格列汀50 mg 1 次/d,阿卡波糖50 mg 1 次/d(午)。查体:BMI 为26.7 kg/m2,腰围为84 cm,臀围为91 cm,无黑棘皮样改变。入院查HbA1c 6.3%,肝肾功能、血脂等均未见异常(表1)。正常餐试验示空腹血糖正常,餐后血糖偏高,空腹及餐后胰岛素明显升高,存在胰岛素、C 肽分离现象(表2)。诊断为2型糖尿病。因存在严重高胰岛素血症伴低血糖,考虑EIAS 可能。入院后进一步查IAA>50 U/mL,其他自身抗体检查均阴性,诊断为EIAS,故停用胰岛素,予二甲双胍0.5 g 3 次/d、阿卡波糖100 mg 3 次/d 治疗。后因胃肠道反应将二甲双胍改为沙格列汀5 mg 1 次/d,血糖达标,低血糖消失。1年后空腹、餐后2 h 胰岛素分别降为8.79 mU/L 和21.99 mU/L,IAA 下降为0.98 U/mL。
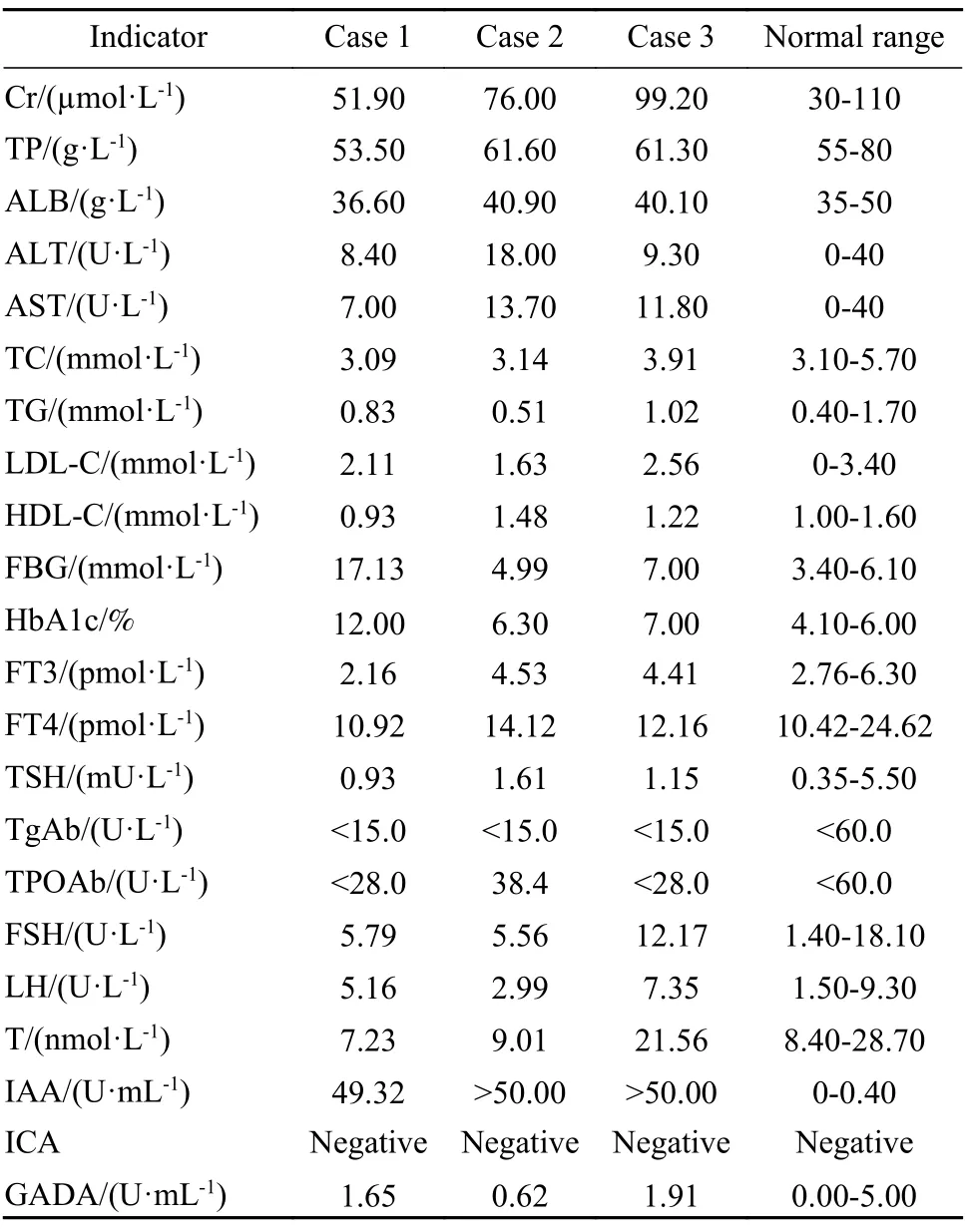
表1 3例EIAS 患者的生化和血清学指标Tab.1 Biochemical and serological indicators of the 3 EIAS patients
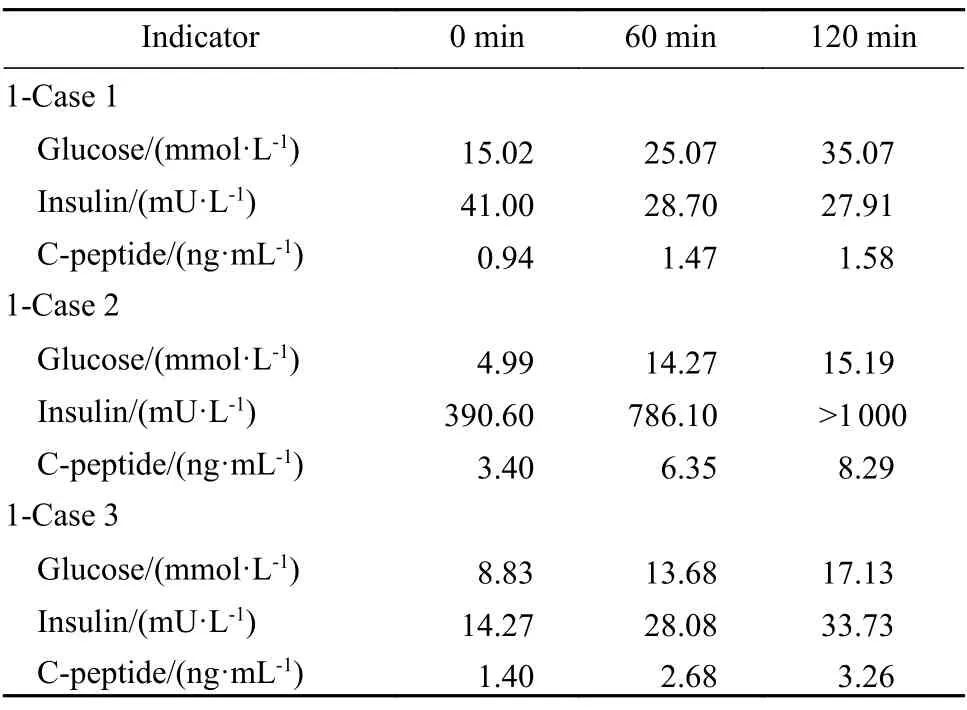
表2 3例EIAS 患者的正常餐、胰岛素和C 肽释放试验Tab.2 Normal meal,insulin and C-peptide release test in the 3 EIAS patients
病例3:患者,男性,60 岁,主因“血糖升高8年,血糖波动大6年”于2020年12 月入院。患者2012年诊断为“2型糖尿病”,予阿卡波糖、格列美脲治疗,血糖控制可。2014年起始胰岛素治疗,先后应用门冬胰岛素30、甘精胰岛素+门冬胰岛素或口服药,血糖波动大,伴夜间及餐前低血糖,最低血糖3.0 mmol/L。入院前降糖方案为甘精胰岛素10~ 12 U 睡前皮下注射,恩格列净10 mg 1 次/d,利格列汀5 mg 1 次/d,二甲双胍缓释片1.0 g/早+0.5 g/晚。查体:BMI 为21.4 kg/m2,腰围为83 cm,臀围为94 cm,未见黑棘皮样改变。入院查HbA1c 7.0%,肝肾功能、血脂等均未见异常(表1)。正常餐试验示空腹及餐后血糖偏高,空腹胰岛素正常,餐后2 h 胰岛素较空腹升高1.4 倍,C 肽与胰岛素同步(表2)。诊断为2型糖尿病。入院后予门冬胰岛素30 以12 U/早+4~ 8 U/晚餐前皮下注射,西格列汀二甲双胍900 mg 2 次/d 治疗。患者仍有频繁低血糖发生,考虑EIAS 的可能,遂查IAA>50.00 U/mL,自身抗体检查阴性,诊断为EIAS。遂停胰岛素,更换为西格列汀二甲双胍900 mg 2 次/d、阿卡波糖100 mg 3 次/d、恩格列净5 mg 1 次/d 治疗,血糖达标,低血糖消失。3个月后复查IAA 为30.36 U/mL,血糖平稳。
讨 论
EIAS 是糖尿病患者使用外源性胰岛素或胰岛素类似物后产生IAA 而导致的一组临床综合征,临床主要表现为严重胰岛素抵抗、血糖大幅波动、高血糖或低血糖等,其生化特点是IAA 阳性,血清免疫原性胰岛素水平显著升高或偏低,与C 肽水平不匹配[2-3]。该病须与经典胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS)、B型胰岛素抵抗综合征(type B insulin resistance syndrome,TBIRS) 鉴别:1)IAS 是由血中非外源性胰岛素诱导的高滴度IAA 和高浓度免疫活性胰岛素导致的自发性低血糖症,无外源性胰岛素制剂应用史,常伴有自身免疫性疾病或血液系统疾病,常有含巯基药物应用史[4-5]。同时,二者产生的胰岛素抗体性质有所不同,EIAS 患者产生的多是针对外源性胰岛素的抗体,具有高亲和力、低结合容量特点,导致严重胰岛素抵抗、高血糖或低血糖;IAS 患者产生的是针对内源性胰岛素的抗体,具有低亲和力、高结合容量特点,导致反复发作性严重低血糖症[6]。2)TBIRS 是由于循环中存在针对胰岛素受体(insulin receptor,INSR)抗体所引起的一种非常罕见的自身免疫病,抗体与INSR结合后阻断INSR 的生物学效应,同时抗体-受体复合物内化,导致细胞表面INSR 数量减少,从而发生严重胰岛素抵抗,但也可以发生抗体与受体结合后激活受体酪氨酸磷酸化而引起低血糖。文献报道TBIRS 的一个共同特征是合并自身免疫性疾病,系统性红斑狼疮最常见[7]。TBIRS 患者常表现为难以控制的高血糖、高胰岛素血症、黑棘皮病或顽固性低血糖等,胰岛素受体抗体(insulin receptor antibody,INSRAb) 阳性对TBIRS 具有确诊价值,治疗方案为免疫抑制剂联合治疗。本文中病例1 糖尿病史13年,早期血糖控制达标,应用胰岛素治疗后出现严重胰岛素抵抗和难以控制的高血糖,不合并自身免疫性疾病,IAA 阳性,支持EIAS 的诊断。病例2、病例3 注射胰岛素后出现血糖波动伴低血糖,无自身免疫病及巯基药物应用史,IAA 均阳性,经停用胰岛素改为口服药物后血糖明显改善,未再发生低血糖,亦支持EIAS 的诊断。
EIAS 的发生与机体高滴度IAA 的产生有关。研究表明,在使用人胰岛素的糖尿病患者中抗体产生率达80%,但滴度有所不同,对患者的影响亦有不同。
郭蓉等[8]对283例2型糖尿病患者的研究发现,IAA 阳性组的血糖波动程度及低血糖发生率均大于IAA 阴性组。欧阳晓俊等[9]对645例2型糖尿病患者胰岛素抗体产生状况分析显示,IAA阳性率为20.9%,IAA 阳性患者较阴性患者年龄大、病程长、胰岛素水平高,IAA 阳性患者胰岛素使用率明显高于IAA 阴性患者。IAA 的产生受多种因素影响,主要与胰岛素的氨基酸序列、胰岛素剂型、给药途径、遗传因素等有关。动物胰岛素和人胰岛素的氨基酸序列不同,会增加其固有的免疫原性。重组人胰岛素的氨基酸序列与人胰岛素的氨基酸序列一致,但仍可引起IAA 的产生,这可能是外界注射的人胰岛素仍具有免疫原性,或胰岛素注射至皮下产生的胰岛素聚合体所致[10]。目前在临床上应用的速效胰岛素类似物有门冬胰岛素、赖脯胰岛素和谷赖胰岛素。研究表明,皮下注射这些速效人胰岛素类似物产生的IAA 与体内产生的IAA 并无差异[11]。一项122例外源性胰岛素所致糖尿病患者EIAS 的临床特点分析研究显示,EIAS 主要发生于使用预混合胰岛素或预混胰岛素类似物的2型糖尿病患者中,预混合胰岛素及预混胰岛素类似物为72例,占比为62.61%,居于前3 位的是门冬胰岛素30(32例,44.44%)、诺和灵30R(15例,20.83%) 和优泌林70/30(14例,19.44%)。在胰岛素类似物引起的EIAS 患者中,最常见的是门冬胰岛素和甘精胰岛素,其次是地特胰岛素和赖脯胰岛素[12]。与每日两次皮下注射患者相比,连续皮下胰岛素输注和强化治疗的患者IAA 水平升高,提示胰岛素给药方式的差异会影响EIAS 的发生[13]。研究表明,胰岛素泵治疗的患者血浆IAA 水平显著增加,可能与胰岛素泵的储存器、表面活性剂和聚乙二醇的存在有关。IAA 的形成同时受遗传因素的影响。Li 等[12]报道的122例EIAS 患者中有9例接受组织相容性白细胞抗原(HLA) 基因型检测,其中7例与HLA-DR4 相关,4例与HLA-DQ3 相关。
严重胰岛素抵抗是EIAS 的主要症状之一,临床表现为高血糖及糖尿病急性并发症,如酮症酸中毒、高血糖高渗昏迷等。其发生机制可能是高滴度IAA 与胰岛素结合后减少了与受体结合的胰岛素量,导致胰岛素无法发挥作用,表现出胰岛素抵抗。血糖高低交替是EIAS 患者的另一主要症状。目前认为,EIAS 患者血糖高低交替与高亲和力、低结合容量胰岛素抗体存在相关[14-15]。一方面,IAA 与外源性胰岛素结合,诱导免疫性胰岛素抵抗,胰岛素抗体可能降低胰岛素作用,从而引发高血糖症(“棉塞样效应”);另一方面,胰岛素抗体还可以通过充当载体来增强和延长胰岛素的药效作用,当结合的胰岛素在夜间pH 值变化等因素作用下与IAA 解离时,游离胰岛素增加,从而导致低血糖症(“储库样作用”)[2]。本文中病例1、病例3 的胰岛素水平无明显升高,胰岛素C 肽分离现象不明显,与既往EIAS 病例报道不一致。周方励和田浩明[16]报道,血中高滴度IAA 可干扰电化学发光免疫分析法检测胰岛素的结果,IAA 的亲和力高于试剂抗体时,在竞争结合分析中,增加了标记抗原与抗体的结合,检测值偏低;当IAA 的亲和力低于试剂抗体时,则检测值偏高。分析胰岛素不高的原因可能是体内IAA 的亲和力高于试剂抗体。
EIAS 的治疗与IAS 类似,除改变生活方式外,还包括停用胰岛素、更换胰岛素种类、更换降糖药物,严重者可选择糖皮质激素、免疫抑制剂、血浆置换等[17]。改变生活方式主要指少食多餐,减少碳水化合物摄入。降糖药物可选择二甲双胍、α-葡萄糖苷酶抑制剂、GLP-1 受体激动剂及磺脲类药物。文献报道,对于合并EIAS 的糖尿病患者停用胰岛素/调整口服降糖药/替换胰岛素制剂/糖皮质激素治疗可在几天至3个月内消除低血糖,IAA 在6个月内转为阴性,中位随访6个月,无低血糖事件发生[12]。也有研究指出IAA 可在胰岛素停药1年后消失,说明IAA 并非一种终身抗体,免疫性胰岛素抵抗及低血糖是可以改善的,预后良好[15]。本文中病例1 经糖皮质激素、血浆置换、人免疫球蛋白等治疗后胰岛素用量明显减少,血糖明显改善;病例2 经更换口服降糖药后1年胰岛素水平降至正常范围;病例3 经更换口服降糖药后血糖达标。3例患者3个月~ 1年IAA 降低或转为阴性。
综上所述,对于接受任何胰岛素治疗的糖尿病患者,如出现严重胰岛素抵抗、血糖波动大、反复低血糖,单纯调整胰岛素种类或更改胰岛素剂量效果不佳时要考虑EIAS 的可能。最重要的诊断试验是高滴度的IAA。抗体的特性因人而异,临床表现也存在差异。改变治疗方式有助于IAA转阴,改善低血糖和胰岛素抵抗。
