硫酸酯化裂褶多糖的制备及其抗凝血活性
2022-01-28郑必胜伍磊周林裴运林
郑必胜 伍磊 周林 裴运林
(1.华南理工大学 食品科学与工程学院,广东 广州 510640;2.广东药科大学 生命科学与生物制药学院,广东 广州 511436;3.广东丸美生物科技股份有限公司,广东 广州 510530)
多糖因其具有抗氧化、抗肿瘤、降血糖、免疫调节等多项生物活性而一直受研究者的青睐[1]。然而多糖的化学组成、结构和构象基本上决定了多糖的生物活性[2]。多糖的分子修饰可以通过引入新的基团来改善多糖原有的分子结构,并赋予其新的功能特性[3- 5]。硫酸酯化修饰是通过化学方法使得多糖分子羟基上的氢被硫酸基团取代,能够增强多糖的水溶性,而且硫酸基团的引入能使多糖具有独特的抗凝血活性[6- 7]。
裂褶多糖(Schizophyllanpolysacchaeides)是一种从裂褶菌(Schizophyllan)子实体、菌丝或发酵液中提取出来的中性多糖,其分子结构为3个重复的β- (1,3)-D-吡喃葡萄糖残基连接一个β- (1,6)-D-吡喃葡萄糖残基[8- 9]。研究表明,裂褶多糖具有良好的抗肿瘤[10]、免疫调节活性[11]以及保湿性[12],而且裂褶多糖具有分子质量高、黏度高、溶解度低的特点。之前关于裂褶多糖硫酸酯的研究主要集中在其抗氧化活性上[13- 14],缺乏对硫酸酯化裂褶多糖制备工艺及其抗凝血活性的研究。
本研究以裂褶多糖(SPG)为原料,采用三氧化硫-吡啶法对SPG进行硫酸酯化,通过响应面实验对制备工艺进行优化,制备高取代度的硫酸酯化裂褶多糖(S-SPG)。通过紫外光谱、红外光谱、扫描电镜对S-SPG进行结构表征,并研究其抗凝血活性,旨在为研发具有抗凝活性和治疗血栓作用的S-SPG提供理论依据。
1 材料与方法
1.1 材料与试剂
裂褶多糖由裂褶菌发酵而来,广州丸美生物科技有限公司提供。
本研究使用的主要试剂有三氧化硫-吡啶复合物、肝素钠(205 U/mg),购自上海麦克林生化科技有限公司;二甲基亚砜(DMSO)、吡啶,购自上海阿拉丁科技股份有限公司;N,N-二甲基甲酰胺(DMF),购自安耐吉化学有限公司;APTT(活化部分凝血活酶时间)、TT(凝血酶时间)、PT(凝血酶原时间)试剂,购自日本Sysmex公司;其他试剂均为国产分析纯。
1.2 仪器与设备
本研究使用的主要仪器有:ZNCL-DL-GX4型智能磁力搅拌器,河南爱博特科技发展有限公司生产;DU730型核酸蛋白分析仪,美国Beckman Coulter公司生产;VERTEX 33型傅里叶红外光谱仪,德国Bruker公司生产;CA620型全自动凝血分析仪,日本Sysmex公司生产。
1.3 实验方法
1.3.1 单因素实验
以硫酸酯化裂褶多糖的取代度为评价指标进行单因素实验,研究不同反应溶剂、三氧化硫-吡啶与裂褶多糖的质量比、反应温度、反应时间对硫酸酯化裂褶多糖取代度的影响。
1.3.1.1 反应溶剂对取代度的影响
裂褶多糖硫酸酯化的方法参考文献[15],稍作修改。取100 mg干燥裂褶多糖于三角瓶中,分别加入15 mL吡啶、15 mL DMSO(二甲基亚砜)、15 mL DMF,干燥环境下浸润12 h。按照三氧化硫-吡啶与多糖的质量比为3加入三氧化硫-吡啶,在70 ℃水浴中反应3 h。反应结束后,加入60 mL预冷蒸馏水,用NaOH调节pH值至7.5,经醇沉、透析、冷冻干燥得硫酸酯化裂褶多糖,记为S-SPG。
1.3.1.2 三氧化硫-吡啶与裂褶多糖的质量比对取代度的影响
固定反应溶剂为DMF,反应时间为3 h,反应温度为70 ℃,探究三氧化硫-吡啶与多糖的质量比为2、2.5、3、3.5、4、4.5对S-SPG取代度的影响,其余步骤参考1.3.1.1节。
1.3.1.3 反应温度对取代度的影响
固定反应溶剂为DMF,三氧化硫-吡啶与多糖的质量比为3,反应时间为3 h,探究反应温度为50、60、70、80、90 ℃对S-SPG取代度的影响,其余步骤参考1.3.1.1节。
1.3.1.4 反应时间对取代度的影响
固定反应溶剂为DMF,三氧化硫-吡啶与多糖的质量比为3,反应温度为70 ℃,探究反应时间为1、2、3、4、5 h对S-SPG取代度的影响,其余步骤参考1.3.1.1节。
1.3.2 响应面实验设计
在单因素实验结果的基础上,采用Design-Expert 8.0.6中的Box-Behnken模型设计三因素三水平响应面实验,以取代度为响应值进行分析。3个因素分别为三氧化硫-吡啶复合物与裂褶的质量比、反应温度、反应时间,分别对应A、B、C。结合单因素实验结果,对各因素的设计水平表如表1所示。
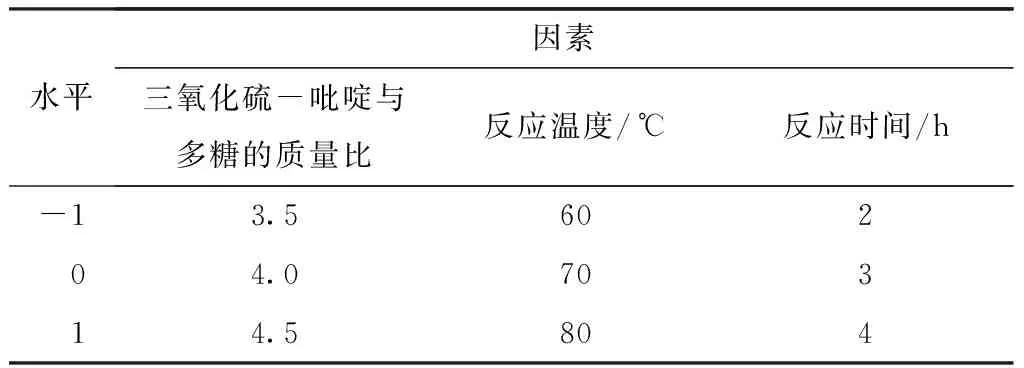
表1 响应面实验因素及其水平表Table 1 Factors and levels of response surface experiment
1.3.3 取代度测定
1.3.3.1 标准曲线的绘制
硫酸化裂褶多糖的取代度采用硫酸钡比浊法测定。
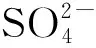
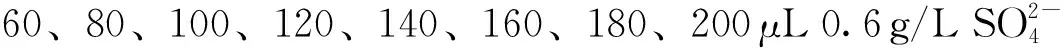
y=0.787 1x-0.068 6
(1)
其相关系数的平方R2=0.996 9。
1.3.3.2 样品取代度的测定
精确称取10 mg硫酸酯化裂褶多糖,采用10 mL 1 mol/L的HCl溶解,于105 ℃下水解8 h,用 1 mol/L 的HCl补足液体,0.45 μm过滤得1 g/L多糖储备液。取200 μL S-SPG多糖溶液,按上述方法测定吸光值,得出多糖的硫酸基含量。根据式(2)计算取代度:
DS=1.62S/(32-1.02S)
(2)
式中,DS为S-SPG的取代度,S为S-SPG的含硫量。
1.3.4 S-SPG的制备
根据单因素和响应面的实验结果,制备3种不同取代度的硫酸酯化裂褶多糖,根据取代度的大小命名为S-SPG1、S-SPG2、S-SPG3。
1.3.5 SPG、S-SPG的组分分析
总糖含量采用硫酸-苯酚法测定;硫酸基含量及取代度按1.3.3节的步骤测定;蛋白含量采用考马斯亮蓝法测定。
1.3.6 SPG、S-SPG的红外光谱测定
取2 mg干燥样品,与KBr混合均匀,并充分研磨成粉末,压片,在4 000~500 cm-1范围内扫描。
1.3.7 SPG、S-SPG的扫描电镜
取裂褶多糖、硫酸酯化裂褶多糖粘附于导电胶上,真空喷金,在高压10 kV的条件下,分别在100、1 000的放大倍数下观察多糖表面形貌并拍摄照片。
1.3.8 SPG、S-SPG2的13C NMR
取50 mg裂褶多糖、硫酸酯化裂褶多糖,重水反复冻溶2-3次,重水作为溶剂,采用5 mm的样品管,检测温度为25 ℃,累加8 266次。
1.3.9 SPG、S-SPG的抗凝血活性测定
血浆制备:取成年家兔,心脏取血,按8%柠檬酸钠与兔血的体积比1:9混合均匀,3 000 r/min离心15 min,收集上层血浆,-20 ℃保存,用前通过37 ℃水浴快速解冻,并离心除去下层沉淀。
待测样品用0.9% NaCl溶解、稀释。阳性对照为0.025 g/L的肝素钠,空白对照为0.9% NaCl溶液。
试验中APTT试剂、0.025 mol/L CaCl2、TT试剂、PT试剂均需在37 ℃下孵育。
1.3.9.1 活化部分凝血酶时间
取450 μL血浆于玻璃试管中,加入50 μL不同浓度的样品,混合均匀,将玻璃试管放入血凝仪。仪器自动吸取50 μL混合血浆和50 μL APTT试剂,孵育3 min,加入50 μL 0.025 mol/L CaCl2溶液,混匀后仪器自动记录血浆凝固时间,即为APTT时间。
1.3.9.2 凝血酶时间
血浆制样参照1.3.9.1节,仪器自动吸取100 μL混合血浆,孵育2 min,加入100 μL TT试剂,混匀后仪器自动记录血浆凝固时间,即为TT时间。
1.3.9.3 凝血酶原时间
血浆制样参照1.3.9.1节,仪器自动吸取50 μL混合血浆,孵育2 min,加入100 μL TT试剂,混匀后仪器自动记录血浆凝固时间,即为PT时间。
2 结果与分析
2.1 单因素实验结果
如图1(a)所示,在吡啶、DMF和DMSO 3种反应溶剂中,当DMF作为反应溶剂时,S-SPG的取代度最高,为1.32,故选择DMF作为裂褶多糖硫酸酯化过程的反应试剂。
如图1(b)所示,随着三氧化硫-吡啶与多糖质量比的增大,S-SPG的取代度呈现先上升后下降的趋势,在质量比为4时,S-SPG的取代度最高,为1.85。三氧化硫-吡啶质量的增加有利于多糖分子中羟基上的氢被硫酸基团充分取代,但三氧化硫-吡啶的量增多,容易在溶剂中结团,造成取代度降低。
如图1(c)所示,当温度低于70 ℃时,S-SPG的取代度与温度呈正相关,当温度超过70 ℃时,取代度与温度呈负相关,70 ℃时取代度最高,为1.32。升温有利于三氧化硫-吡啶分子在反应溶剂中的扩散,促进酯化剂与多糖分子结合,加快反应速率,有利于取代度的提高。但高温会导致多糖降解,从而造成取代度降低。
如图1(d)所示,当反应时间在1~3 h范围内时,S-SPG的取代度与时间呈正相关,反应时间大于3 h时,取代度与时间呈负相关。反应时间的延长有利于多糖与酯化剂的充分吸附和反应,但长时间的高温容易造成酯化剂的分解和多糖的降解,使取代度降低。
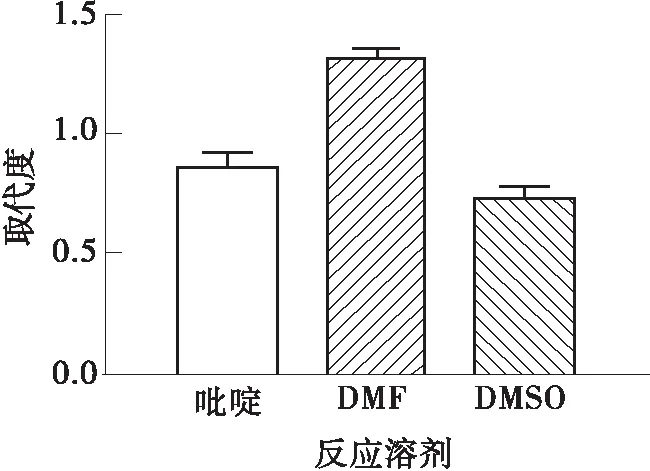
(a)反应溶剂对取代度的影响
2.2 响应面优化结果
2.2.1 响应面优化结果
在单因素实验结果的基础上,以取代度(Y)为响应值,采用Box-Behnken设计关于三氧化硫-吡啶复合物与裂褶多糖的质量比(A)、反应温度(B)以及反应时间(C)的三因素实验,结果如表2所示。数据经二次回归分析,结果如表3所示。所得的数学模型为
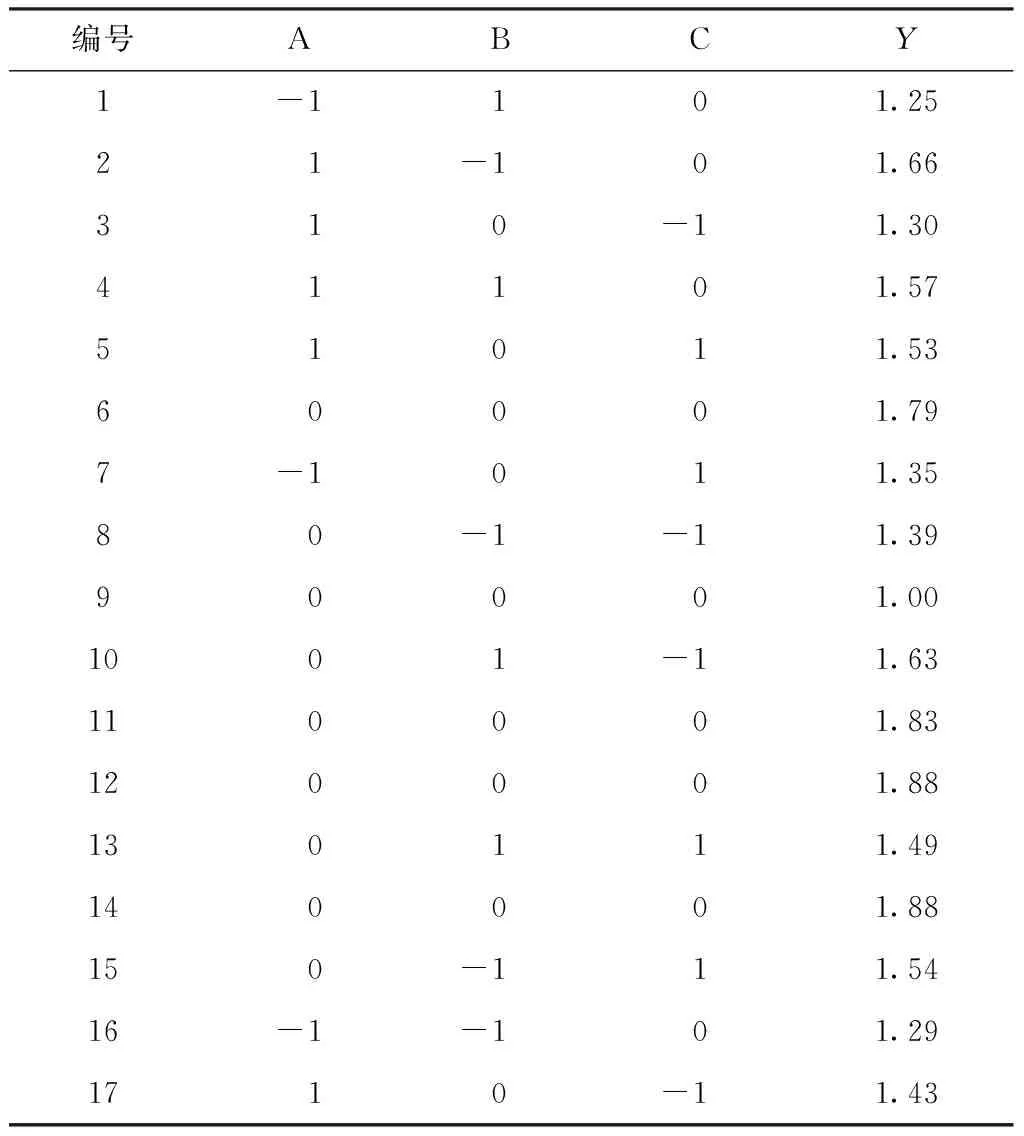
表2 Box-Behnken 实验设计及结果Table 2 Design and result of Box-Behnken response surface experiment
Y=8.726A+0.244 95B+1.578C-2.5×10-3AB+
0.025AC-7.25×10-3BC-1.047A2-
1.517 5×10-3B2-0.191 75C2-27.092 5。
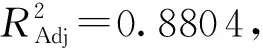
表3 回归模型方差分析1)
2.2.2 交互作用分析
根据回归方程得出的两两因素的响应面和等高线图如图2所示。响应面的曲面越陡峭,表明该因素对S-SPG取代度的影响越大;等高线图呈椭圆形,表明两个因素之间存在交互作用,否则交互作用可以忽略不计。从图2可以看出,反应温度和反应时间之间存在交互作用,其他两组因素间不存在交互作用。
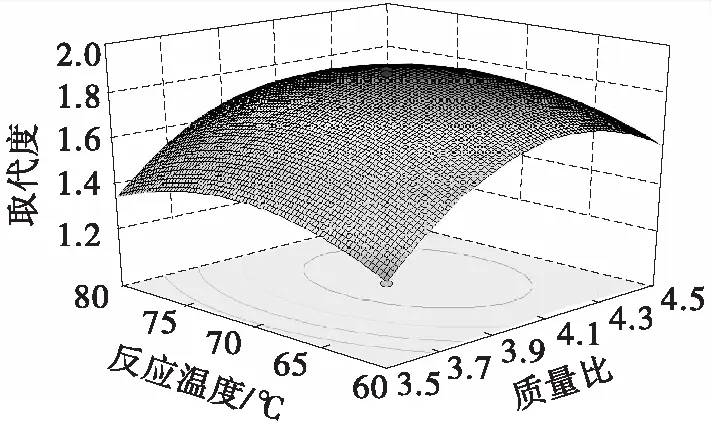
(a)三氧化硫-吡啶与裂褶多糖的质量比和反应温度的响应面图
2.2.3 实验结果论证
通过Design-Expert 8.0.6软件分析得到的最优条件为:三氧化硫-吡啶复合物与裂褶多糖的质量比为4.12,反应温度为70.01 ℃,反应时间为3.06 h,此时取代度最高,为1.87。考虑到实际操作,调整反应条件为三氧化硫-吡啶复合物与裂褶多糖的质量比为4,反应温度为70 ℃,反应时间为3 h。在修正的最优条件下进行3次平行试验,反应产物的取代度为1.85±0.03,与理论值较吻合。
2.3 SPG、S-SPG的组分分析
在单因素和响应面实验结果的基础上,采用三氧化硫-吡啶法制备了3种不同取代度的硫酸酯化裂褶多糖,分别命名为S-SPG1、S-SPG2、S-SPG3。S-SPG1、S-SPG2、S-SPG3和SPG理化性质的测定结果如表4所示。SPG的总糖含量为79.68%,含有微量的蛋白。在经过硫酸酯化后,S-SPG的总糖含量随着硫酸基含量的升高而降低,S-SPG1的总糖含量最高,为80.86%,硫酸基含量最低,为28.90%。S-SPG的硫酸基含量最高,为50.69%,总糖含量最低,为40.62%。所有的S-SPG组分均未检测出蛋白。
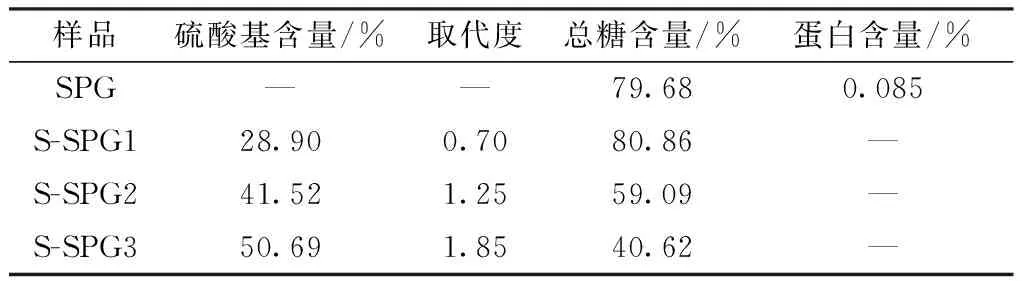
表4 SPG、S-SPG硫酸基含量、取代度、总糖和蛋白含量测定2)Table 4 Determination of sulfate group content,degree of substitution,total sugar content,protein content for SPG and S-SPG
2.4 红外光谱分析

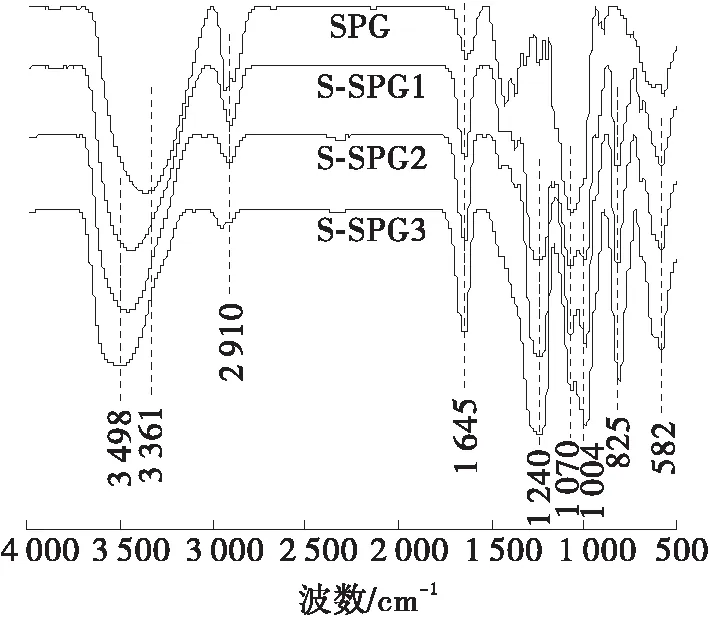
图3 SPG和S-SPG的红外光谱谱图
2.5 扫描电镜分析
多糖经化学修饰后,原有的空间结构会遭到破坏,扫描电镜可用来分析多糖在化学修饰前后表面形态的变化。裂褶多糖及硫酸酯化裂褶多糖的表面形态如图4所示。裂褶多糖呈沟壑状,其表面呈多孔网状;经过硫酸化后,裂褶多糖的表面形貌发生了变化。S-SPG1呈片状,表面光滑且存在不规则的小孔;S-SPG2呈片状,表面不光滑,存在较多不规则的突起;S-SPG3则呈表面粗糙片状。随着取代度的增大,在500 μm范围内的S-SPG1、S-SPG2、S-SPG3表面片状结构逐渐减小,在50 μm范围内S-SPG1、S-SPG2、S-SPG3表面突起逐渐增多。S-SPG的表面形态与SPG间的差别表明了硫酸酯化修饰改变了裂褶多糖的表面结构。这与之前Wang等[19]和Jing等[20]的研究结果一致,即经过硫酸化修饰,生姜多糖和人工蛹虫草表面形貌发生了变化。

(a)500 μm范围内,SPG
2.6 SPG、S-SPG2的13C NMR分析
根据多糖的化学位移规律和相关文献[21],在图5(a)中,102.95、73.14、83.85、66.94、76.68、60.66处的信号峰对应裂褶多糖β-(1→3)主链上的C1、C2、C3、C4、C5、C6;而103.27、74.09、67.73处则为β-(1→6)支链上的C1、C2、C4的信号峰,68.12处的小峰为主链上被支链取代的C6。研究表明,多糖羟基上的氢被硫酸基团取代后,被取代的碳因与吸电子基团(磺酰氧基)相连而向低场移动[22- 23]。与SPG相比,S-SPG2(见图5(b))在60.00附近信号峰的消失表明C6位已经发生了完全取代,69.13处的信号峰为C6被硫酸基团取代所产生的。若C2上羟基中的氢被取代,C1的信号峰会存在分裂[23]。S-SPG2 的C1在100.75处显示信号分裂,在78.85处的信号峰可以归属为C2发生取代产生的共振偏移峰,表明S-SPG2中的C2发生了少量取代[24]。
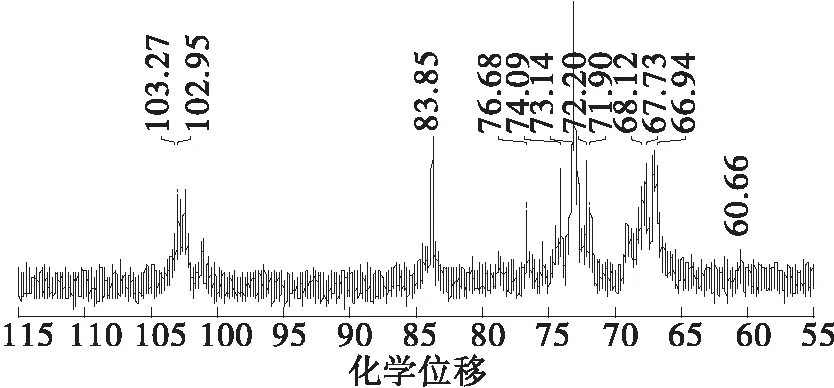
(a)SPG
2.7 抗凝血活性分析
以0.025 g/L肝素钠为阳性对照、0.9% NaCl为空白对照,通过APTT、TT、PT 3项凝血指标来评价硫酸酯化对裂褶多糖抗凝血活性的影响。从 图6 可以看出,空白对照组的APTT、TT、PT分别为(26.40±0.40)s、(12.85±0.05)s、(12.05±0.05)s,0.025 g/L肝素钠的APTT((185.20±4.40)s)为空白对照的7.02倍,TT大于90 s,PT为(11.05±0.65)s。从图6(a)中可以看出,SPG(0.5~4 g/L)对APTT和PT均没有延长作用,而对TT有微弱的作用,但与质量浓度无关。从图6(b)-6(d)可以看出,S-SPG均以浓度依赖的形式对APTT、TT有明显的延长作用。在质量浓度为0.2 g/L时,S-SPG1、S-SPG2、S-SPG3的APTT分别为(76.40±1.70)s、(98.70±2.40)s和(184.35±1.55)s,TT分别为(43.85±3.95)s、(77.10±0.10)s、>90 s。裂褶多糖经硫酸化后具有较强的抗凝血活性,但比肝素钠的凝血活性弱,在APTT和TT试验中需要更高的浓度才能达到肝素钠的凝血效果。
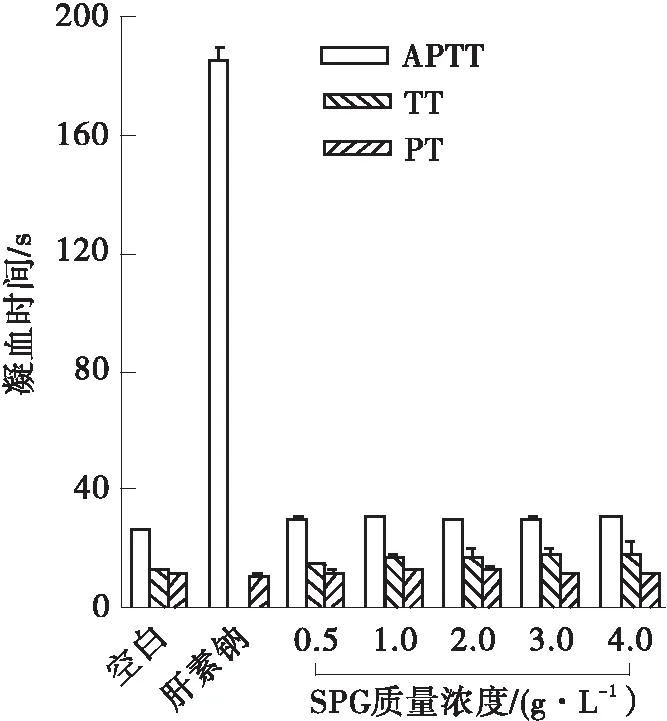
(a)SPG对APTT、TT、PT的影响
裂褶多糖经硫酸酯化后具有延长APTT、TT的活性,缺乏对PT的延长活性,表明S-SPG主要是通过内源性凝血途径来影响血浆的凝固过程,而非外源性凝血途径[25- 26],这与其他硫酸化多糖的凝血途径相似[27- 28]。Chaouch等[7]的抗凝血试验表明硫酸酯化可显著增强仙人掌果胶多糖的抗凝活性,且其通过延长APTT和TT来体现其抗凝活性。研究表明,硫酸酯化多糖的抗凝血活性与其取代度之间存在正相关关系,取代度高的多糖的抗凝血活性更好。在本实验中,相较于S-SPG1(DS=0.70)和S-SPG2(DS=1.25),S-SPG3(DS=1.85)在APTT和TT试验中展现出更好的抗凝血活性。在APTT、TT试验中,取代度的增大能够提高抗凝血活性,表明硫酸基含量是影响抗凝血活性的重要指标。这可能是由于高取代度的硫酸改性多糖具有高负电荷密度,能够与血浆中带正电荷的氨基酸残基结合,从而提高抗凝血活性[28]。
3 结论
本实验通过三氧化硫-吡啶法制备硫酸酯化裂褶多糖。响应面法优化的最佳工艺条件为:三氧化硫-吡啶复合物与裂褶多糖的质量比为4,反应温度为70 ℃,反应时间为3 h。最佳工艺条件下制备的硫酸酯化裂褶多糖的取代度为1.85。FT-IR分析表明,S-SPG出现了与硫酸基团相关的特征吸收峰,表明硫酸酯化是成功的;扫描电镜的结果表明裂褶多糖经硫酸酯化后,其表面形貌发生了变化;13C NMR的结果表明,S-SPG2的C6位发生了完全取代,C2位发生了部分取代;经典凝血试验的结果表明硫酸酯化能使裂褶多糖获得较强的抗凝血活性,且取代度是影响抗凝血活性的重要因素;此外,S-SPG是通过抑制内源性凝血过程来延长凝血时间的。因此,硫酸酯化裂褶多糖是一种很有前景的抗凝剂。该研究初步探究了硫酸酯化裂褶多糖的抗凝活性与取代度之间的关系,但硫酸酯化裂褶多糖抗凝活性的详细机理还值得进一步研究。
