鱼源无乳链球菌N-乙酰氨基葡萄糖苷酶NalA的鉴定及生物学功能分析
2022-01-27董雨豪徐艳楠聂蒙曹青姬姝婷刘广锦刘永杰
董雨豪,徐艳楠,聂蒙,曹青,姬姝婷,刘广锦,刘永杰
(南京农业大学动物医学院,江苏 南京 210095)
无乳链球菌(Streptococcusagalactiae),又称B群链球菌(Group BStreptococcus, GBS),可引起奶牛乳腺炎、脑膜炎及新生儿败血症,也可导致鱼类链球菌病,是一种感染宿主范围较广的病原菌[1]。自2009年以来,我国南方多个省市的罗非鱼养殖场大规模暴发无乳链球菌病,由于感染鱼死亡率极高,造成了严重的经济损失,甚至给罗非鱼的养殖生产造成了毁灭性打击。病鱼常见症状主要有:精神萎靡、眼球突出、腹部膨大、躯体平衡丧失并狂游[2]。该菌的致病性与多种毒力因子密切相关,如β-溶血素、CAMP因子、荚膜多糖和C5a肽酶等[3]。虽然对无乳链球菌毒力因子已进行了大量研究,但其确切的致病机制尚不清楚。
肽聚糖是革兰阳性菌细胞壁的重要组成部分,在维持细胞完整性、防止细胞在低渗溶液中胀裂等方面起重要作用[4]。当细胞分裂时,肽聚糖会发生动态重构,其过程需要肽聚糖水解酶的参与。肽聚糖水解酶主要功能是切割肽聚糖层,将新合成的肽聚糖插入其中,以维持肽聚糖的循环利用[5]。肽聚糖水解酶根据其作用位点差异,可分为三大类:切割多糖骨架的糖苷酶、切割侧链肽的酰胺酶以及切割侧链多肽内部的肽链内切酶[6]。肽聚糖水解酶几乎参与了细胞的整个生长过程,包括细胞生长、分离、自溶、细胞壁翻转等。另外,肽聚糖水解酶在细菌运动性、蛋白分泌以及致病性方面也发挥重要作用[4]。在细胞壁重构过程中,肽聚糖水解酶还可以通过修剪细胞壁,消除宿主天然免疫受体所能识别的肽聚糖片段,进而抑制宿主免疫应答。例如,金黄色葡萄球菌(Staphylococcusaureus)肽聚糖水解酶Atl通过修剪细胞壁表面裸露的肽聚糖末端,导致细菌不能被宿主的肽聚糖识别蛋白(PGRPs)识别,从而使细菌成功入侵宿主[7]。肽聚糖水解酶在无乳链球菌中的研究相对较少,目前仅有一种肽聚糖水解酶PcsB被鉴定[8]。
本研究在无乳链球菌GD201008-001基因组中预测到一个可能的N-乙酰氨基葡萄糖苷酶基因(A964_0097,命名为nalA),采用同源重组技术构建基因缺失株及互补株,并研究该基因敲除后细菌形态变化、自溶能力以及对斑马鱼致病力的影响。
1 材料与方法
1.1 菌株、质粒与试剂
鱼源无乳链球菌GD201008-001分离自广州肇庆罗非鱼养殖场中发病罗非鱼。大肠杆菌DH5α购于南京诺维赞生物技术有限公司;温敏型自杀质粒pSET4s (壮观霉素抗性,大小为4 506 bp)和穿梭质粒pSET2(壮观霉素抗性,大小为5 016 bp)由本实验室保存;无乳链球菌培养条件为Todd-Hewitt broth (THB)液体培养基、温度37 ℃。大肠杆菌DH5α培养条件为Luria-Bertani(LB)液体培养基、温度37 ℃。
PrimeSTAR Max DNA聚合酶、2×PCR PreMix、反转录及荧光定量试剂盒均购自南京诺维赞生物技术有限公司;限制性内切酶、DNA Marker、DNA纯化回收试剂盒购自TaKaRa公司;细菌质粒提取试剂盒、细菌RNA/DNA提取试剂盒均购自OMEGA公司;壮观霉素购自鼎国生物技术有限公司。Triton X-100、Tris-HCl、三卡因甲基磺酸盐等其他试剂均为国产或进口分析纯试剂。试验相关引物(表1)均为自行设计并由苏州金唯智生物技术有限公司合成。

表1 引物序列
1.2 蛋白生物信息学分析
检索无乳链球菌GD201008-001基因组(NC_018646),发现A964_0097被注释为N-乙酰氨基葡萄糖苷酶基因,命名为nalA。采用PRABI(https://npsa-prabi.ibcp.fr/) 软件和SMART(http://smart.emblheidelberg. de/)软件对该基因进行二级结构预测,采用I-TASSER(https://zhanggroup.org//I-TASSER/)软件进行蛋白三维结构建模。
1.3 基因缺失株构建
以GD201008-001菌株基因组为模板,对nalA基因上下游同源臂进行PCR扩增,引物分别为nalA-A/B和nalA-C/D。产物再用nalA-A/D引物进行同源臂融合。融合PCR产物连接至pSET4s中,构建的nalA基因缺失重组质粒转化至大肠杆菌DH5α中。将10 μL浓度为200 ng/μL的重组质粒电转至无乳链球菌GD201008-001感受态中,电转仪参数设置为:200 Ω、2.3 kV/cm、25 μF。电转液置于28 ℃培养4 h,加入壮观霉素,终浓度为100 μg/mL, 28 ℃培养过夜。
取适量菌液涂布至THB平板(含100 μg/mL壮观霉素),37 ℃培养过夜。挑取单菌落接种至THB液体培养基(含100 μg/mL壮观霉素)中,37 ℃培养过夜,然后按1∶100体积比转接至THB液体培养基中,每8 h传代一次。连续传代5次后,取等量稀释菌液分别涂布于抗性和非抗性平板,37 ℃过夜培养。当抗性平板上菌落数量明显少于非抗性平板上的菌落时,说明双交换已发生,可挑取非抗性平板上的菌落,分别划线于抗性和非抗性平板,37 ℃过夜培养。选取在仅在非抗性平板上生长的菌落进行菌落PCR验证。缺失株用nalA-1/2引物对缺失基因上下游ORF进行PCR扩增,扩增产物送公司进行测序,以确定nalA基因的缺失是否导致上下游ORF的移码。
1.4 基因互补株构建
以GD201008-001基因组为模板,利用引物CnalA-F/R进行PCR扩增获得nalA片段,产物连接至pSET2载体,电转化至ΔnalA缺失株感受态中。后续步骤同基因敲除。
1.5 细菌形态观察
采用革兰染色法将无乳链球菌野生株、ΔnalA和CΔnalA进行染色,在100倍油镜下观察菌体形态、成链长度和染色特性,并拍照记录。
1.6 细菌自溶试验
参照Yamada[9]方法进行细菌自溶试验。将野生株、ΔnalA及CΔnalA培养至OD600=0.6,5 000 r/min离心5 min,弃上清,菌体重悬于50 mmol/L含0.05% Triton X-100的Tris-HCl 溶液(pH=7.0)中,调至OD600=0.6。37 ℃轻微振荡孵育,每隔4 h使用分光光度计测定吸光度OD600值。按照如下公示进行细菌自溶能力计算:

1.7 生长曲线测定
野生株、ΔnalA及CΔnalA生长至对数期,调至OD600=0.5,按1∶100转接至50 mL THB培养基中,37 ℃培养24 h。每隔1 h使用分光光度计测定吸光度OD600值,绘制生长曲线。
1.8 半数致死量(LD50)测定
动物实验按照动物福利标准进行,并经南京农业大学实验动物伦理委员会批准(SYXK(Su)2017-0007)。各菌株接种于THB培养基,37 ℃培养至对数期。5 000 r/min离心5 min,PBS洗3次。调整浓度至5×104、2.5×104、5×103、2.5×103CFU/mL。每组15尾斑马鱼。斑马鱼先用100 μg/mL三卡因甲基磺酸盐(MS-222)进行浸泡麻醉,然后用胰岛素注射器每尾腹腔注射20 μL菌液,空白对照注射等量PBS。观察1周记录结果,按Bliss法[10]计算LD50。
1.9 数据统计与分析
采用Graphpad prism 5软件进行分析处理,使用t检验进行差异显著性分析。每个试验重复3次,结果以“平均值±标准差”表示。*表示差异显著,P<0.05; **表示差异极显著,P<0.01。
2 结果
2.1 NalA蛋白的二级和三级结构预测
用PRABI软件对NalA蛋白的二级结构预测,结果显示52~186位氨基酸残基为G73氨基葡糖苷酶结构域 (图1A)。通过I-TASSER进行同源建模后得到NalA蛋白的三维结构,结果显示 C 端催化结构域由1个β发卡结构和7个α螺旋构成,其中催化活性位点Glu115位于β发卡结构中(图1B)。通过蛋白结构分析推测该蛋白为糖苷水解酶G73家族中的一种肽聚糖水解酶。基于BLAST比对结果,利用MEGA 7.0软件构建基于NalA氨基酸序列的进化树。结果显示,无乳链球菌GD201008-001的NalA与S.agalactiaeFSL S3-026的肽聚糖水解酶(登录号:WP_001231505.1)同源关系较近,且氨基酸序列相似性为99.48%(图2)。

A. 二级结构预测;B. 二维结构图1 NalA蛋白结构分析
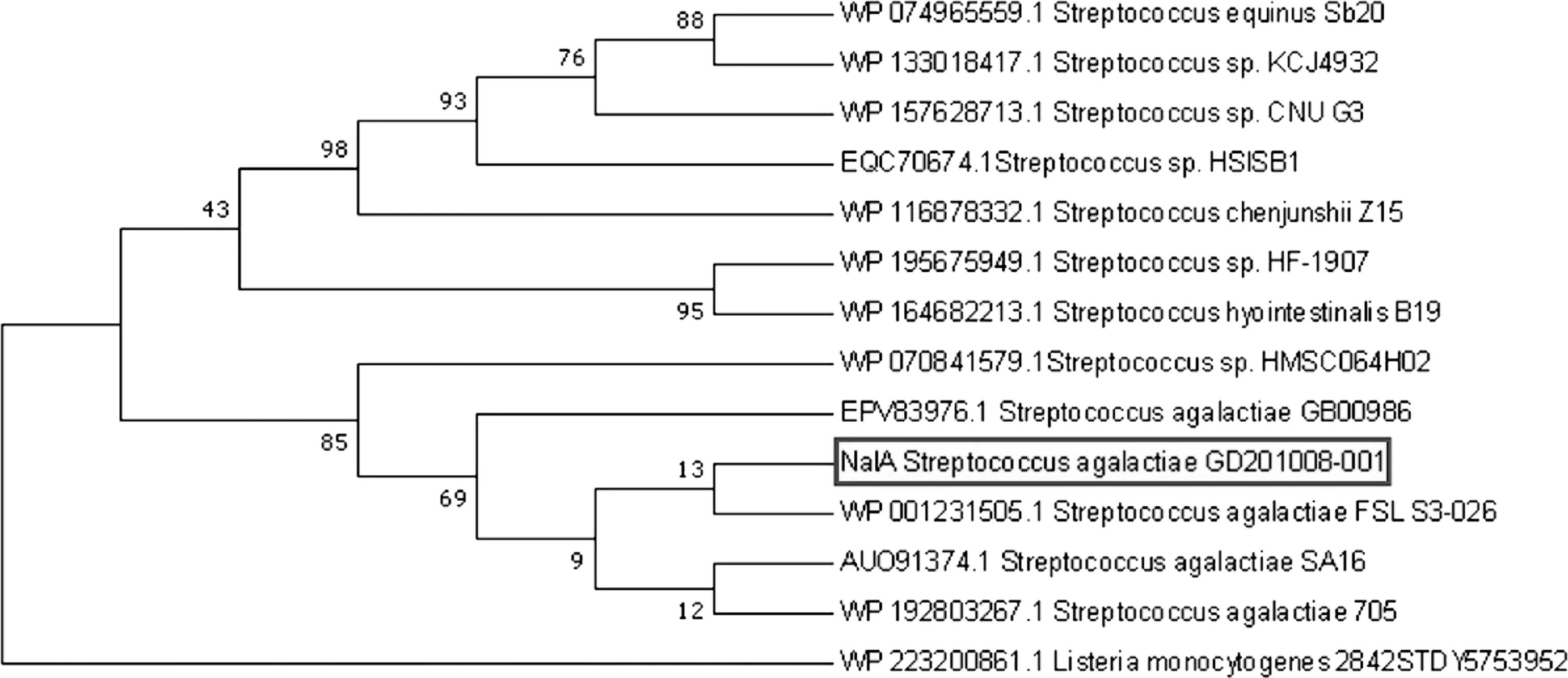
图中方框内所示为本研究蛋白NalA图2 NalA氨基酸序列进化树分析
2.2 nalA基因缺失株及互补株的PCR鉴定
用引物nalA-A/D对野生株和ΔnalA进行PCR验证,结果显示,野生株可检测到长度为2 285 bp的产物,即目的基因片段及上下游片段长度。缺失株扩增片段为1 317 bp,即目的基因上下游片段长度。同时,使用目的基因内部引物nalA-F/R进行验证,结果显示野生株可检测到目的基因扩增产物,而缺失株未检测到目的基因扩增产物,以上结果表明nalA基因缺失株构建成功(图3A)。另外,用nalA-1/2引物对缺失基因上下游ORF进行PCR扩增,扩增产物送公司进行测序,结果显示nalA基因的缺失未导致上下游ORF的移码。用nalA基因内部引物nalA-E/F进行PCR验证,结果显示在互补株中可检测到目的基因,说明nalA基因成功回补(图3B)。

A.缺失株PCR鉴定;M为DNA分子量标准 (DL 5000);1为野生株,引物为nalA-F/R;2为野生株,引物为nalA-A/D;3为缺失株,引物为nalA-F/R;4为缺失株,引物为nalA-A/DB.互补株PCR鉴定;M为DNA分子量标准 (DL 2000);1为野生株,引物为CnalA-F/R;2为互补株,引物为CnalA-F/R图3 nalA基因缺失株及互补株PCR鉴定
2.3 实时荧光定量PCR验证nalA基因转录水平
采用qRT-PCR对野生株、ΔnalA和CΔnalA进行目的基因转录情况验证。结果显示,ΔnalA无目的基因转录(P<0.01),而野生株和CΔnalA均能检测到目的基因的转录,且nalA基因的缺失不影响上下游基因的转录(图4)。
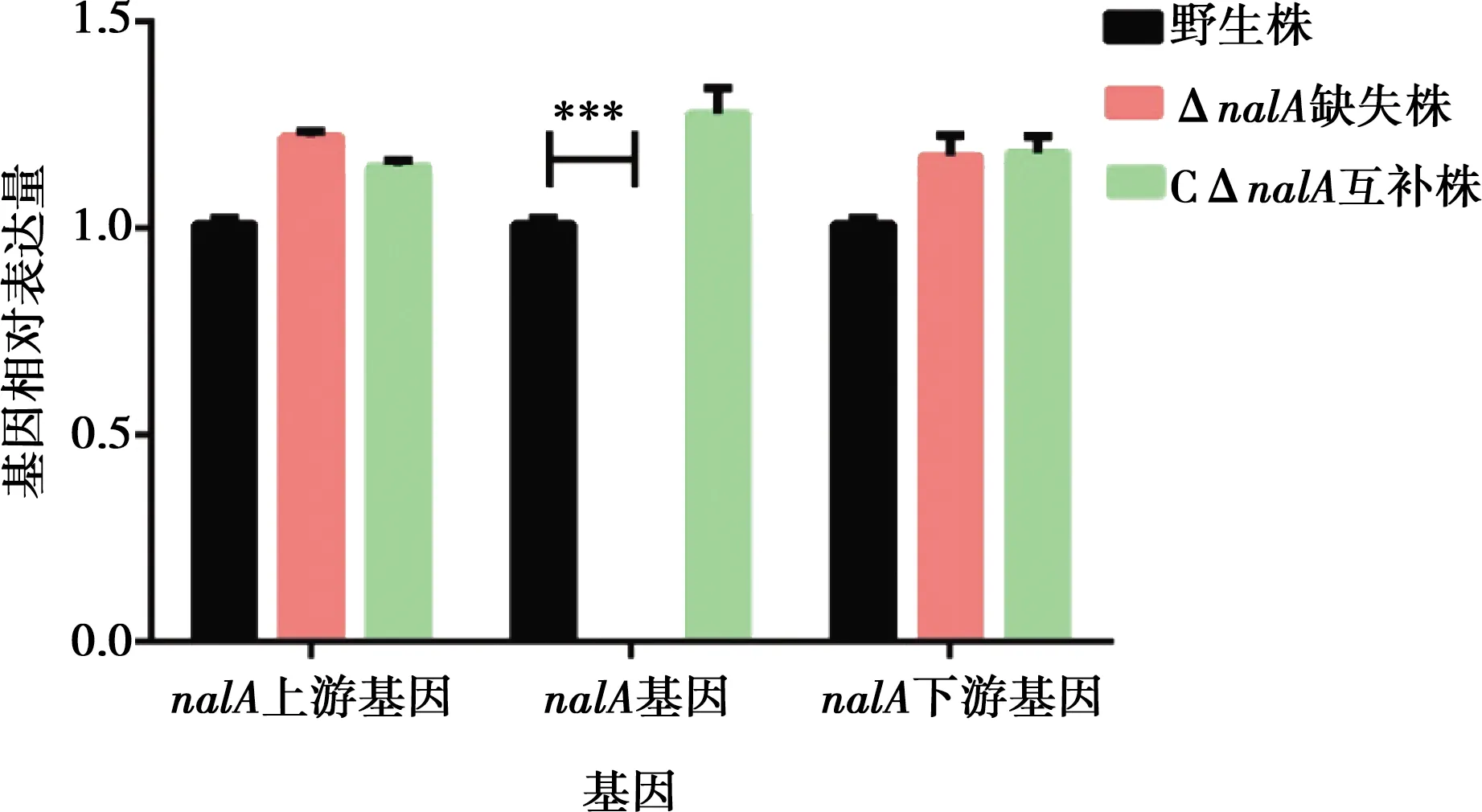
***表示差异极显著(P<0.01)图4 nalA基因缺失株及互补株qRT-PCR鉴定
2.4 菌株的生长曲线测定
以培养时间为横坐标,OD600为纵坐标,绘制野生株、ΔnalA缺失株与CΔnalA互补株的生长曲线。如图5所示,与野生株相比,ΔnalA缺失株的生长速率在对数生长期有明显下降,但达到平台期所用时间一致,CΔnalA互补株的生长能力与野生株基本相同。

图5 野生株、ΔnalA及CΔnalA生长曲线
2.5 菌株的自溶测定
通过测定菌液OD值评估各菌株的自溶能力,结果显示,前4 h,ΔnalA的自溶程度与野生株基本相同,4 h后ΔnalA的自溶程度开始放缓,基本没有继续发生自溶,而野生株的自溶程度直到16 h后才明显放缓(图6),24 h时,ΔnalA的自溶能力降低69.36%。以上试验结果表明,nalA基因的缺失可显著降低细菌自溶的发生(P<0.01)。

**表示差异极显著,P<0.01图6 野生株、ΔnalA及CΔnalA自溶能力
2.6 细菌形态观察
野生株、ΔnalA及CΔnalA革兰染色后显微镜下观察:3个菌株形态均为球状,排列成链状;与野生株(图7A)相比,ΔnalA缺失株(图7B)的细菌链增长约10倍,而CΔnalA互补株(图7C)的细菌链长恢复到接近野生株水平。

A. 野生株;B. ΔnalA缺失株; C. CΔnalA互补株图7 野生株、ΔnalA缺失株和CΔnalA互补株的形态学比较
2.7 对斑马鱼的LD50
如表2所示,野生株对斑马鱼的LD50为1.31×102CFU,ΔnalA对斑马鱼的LD50为5.87×102CFU,与野生株相比升高约4倍。回补nalA后,LD50恢复至野生株水平。结果表明nalA的缺失减弱了无乳链球菌对斑马鱼的致病力。

表2 斑马鱼致病性试验
3 讨论
本研究首先对无乳链球菌可能的N-乙酰氨基葡萄糖苷酶NalA进行二级和三级结构预测,结果显示NalA的催化结构域由1个β发卡结构和7个α螺旋构成,且催化活性位点位于β发卡结构中,此结构与肽聚糖水解酶LytB[11]和自溶素Auto[12]的催化结构非常相似,表明这3种糖苷水解酶可能具有相同的底物结合方式和催化机制。为进一步明确其功能,利用同源重组技术成功构建该基因缺失株ΔnalA及互补株CΔnalA,并对其生物学特性进行初步分析,证实ΔnalA的生长速率在对数生长期有明显下降。有研究报道,金黄色葡萄球菌的胞壁质水解酶LytN缺陷可延缓细菌的生长[13];粪肠球菌(Enterococcusfaecalis)的胞壁质水解酶可降解环境中的高甘露糖型糖蛋白,释放单糖促进细菌生长[14],推测本研究鉴定的NalA可通过降解生长环境中的某些物质,为无乳链球菌对数生长期的迅速增殖提供营养。
当处于胁迫环境时,细菌会发生自溶现象。自溶现象是菌体在胁迫环境下维持生存的一种自我保护行为。N-乙酰氨基葡萄糖苷酶属于肽聚糖水解酶的一种, 与细菌自溶存在密切联系[15]。本研究中ΔnalA的自溶能力显著降低,说明该基因参与无乳链球菌的自溶过程。但nalA基因的缺失并未导致菌体自溶的停止, 表明无乳链球菌的自溶受到多种酶的调节, 而NalA可能只是其中关键的自溶酶。自溶酶不仅影响菌体的自溶, 而且决定着菌体的形态。革兰染色镜检发现ΔnalA菌体形态与野生株无明显差异,均为球形,但其排列成链的长度显著长于野生株,说明NalA是无乳链球菌细胞分散所必需的肽聚糖水解酶, 可能主要通过切割子代细胞与母代细胞细胞壁的连接实现二者的分离。类似的现象在嗜热链球菌(Streptococcusthermophilus)[16]和乳酸链球菌(Lactococcuslactis)[17]也有报道。在戈登链球菌(Streptococcusgordonii)中发现,肽聚糖水解酶lytB基因的缺失同样可导致细菌链的增长[18]。本研究发现nalA的缺失导致无乳链球菌对斑马鱼的致病力显著降低,推测NalA可能通过破坏细胞壁内肽聚糖的化学键,导致细胞表面特性(细胞壁结构、电荷、表面修饰)的改变,进而影响细菌表面毒力因子的展示。在产单核细胞李氏杆菌(Listeriamonocytogenes)中,胞壁质水解酶ispC基因的缺失可降低毒力因子ActA和InlC的表面展示,从而降低细菌对小鼠的致病力[19]。另外,有研究表明细菌链的增长可以降低细菌的抗吞噬能力从而降低细菌毒力。例如,在肺炎链球菌(Streptococcuspneumoniae)中,长链状的肽聚糖水解酶缺失株ΔlytA更容易被补体系统识别,从而导致其更容易被中性粒细胞捕获[20]。
综上,本研究鉴定了一种新的无乳链球菌N-乙酰氨基葡萄糖苷酶NalA,并对其生物学特性进行研究,为进一步探索该蛋白结构和功能奠定了基础。
