丹参DnaJ基因的鉴定及胁迫响应分析
2022-01-27方鑫杨峥王晨旭孙雨欣张斌麻鹏达
方鑫,杨峥,王晨旭,孙雨欣,张斌,麻鹏达
(西北农林科技大学生命科学学院/创新实验学院,陕西 咸阳 712100)
丹参(Salviamiltiorrhiza)是一种常见中药材,其有效成分分为2类:一是脂溶性萜类,如丹参酮、隐丹参酮等;二是水溶性酚酸类,如丹酚酸、丹参素等。作为一种药用植物,丹参具有抗炎、解热镇痛、抗肿瘤等功能,又因其具有活血化瘀等特性而在心血管疾病的治疗中有广泛应用[1]。丹参生命周期短,基因组规模小,因此成为研究各种环境胁迫与表型响应的模型植物[2]。一些研究表明,丹参生长状态以及活性成分的含量与环境条件有关,不同的气候条件对丹参生长有较大影响,恶劣气候已成为影响丹参生长的主要非生物胁迫因素[3]。因此,研究丹参对高温等逆境的响应机制具有重要意义。
热休克蛋白(HSP)是机体响应逆境胁迫后产生的一种特殊蛋白质,其结构保守,主要作为分子伴侣行使生物学功能[4]。根据相对分子质量大小,热休克蛋白被分为小分子热休克蛋白(sHSP)和HSP70等多个类别,而DnaJ蛋白则归类于小分子热休克蛋白(HSP40)。DnaJ蛋白在进化过程中一直保留着分子伴侣功能,逆境胁迫时其作为分子伴侣参与维持蛋白质复合体的稳定[5]。植物DnaJ蛋白含有4种经典结构域,包括高度保守的N端结构域(J-domain)、锌指结构域(zinc-finger domain)、富含甘氨酸的结构域(G-domain)和保守的C端结构域(C-terminal)[6]。
丹参的主要药用成分是通过次生代谢合成途径进行生物学合成的[7]。在对拟南芥等多种植物研究中发现,DnaJ蛋白在植物抗逆和次生代谢途径调控过程中起着重要的作用[8]。有研究者通过酵母双杂交系统筛选到部分的丹参DnaJ蛋白,但未进行类似的功能研究[9]。为了探讨丹参DnaJ蛋白对各种环境胁迫的响应作用,我们通过与拟南芥DnaJ进行比较,鉴定丹参DnaJ基因,揭示丹参DnaJ的功能和进化关系,为深入研究丹参中逆境响应和次生代谢途径的调控提供参考。
1 材料与方法
1.1 丹参DnaJ基因鉴定及蛋白序列分析
基于已有报道的拟南芥DnaJ的研究结果,采用隐马尔可夫模型筛选丹参基因数据库(http://www.ndctcm.org/shujukujieshao/2015-04-23/27.html),得到丹参DnaJ基因序列信息[10-11]。利用BLAST 2.7.1建立本地BLAST数据库,采用tBLASTn算法对丹参全基因组进行查询,搜索DnaJ家族同源基因[12]。通过在线工具ScanProsite(http://prosite.expasy.org/)对预测的SmDnaJ蛋白序列进行J结构域的分析鉴定,利用DNAMAN软件的多序列比对工具分析J结构域和HPD基序的序列特征,利用ExPASy在线软件(http://web.expasy.org/compute_pi/)的PI/MW工具计算DnaJ蛋白的相对分子质量和理论等电点(pI)。
1.2 丹参DnaJ基因家族系统发育分析
获取丹参和拟南芥的DnaJ蛋白序列,利用ClustalW 2.1软件进行多重序列比对(缺口开启罚分设为15.00,缺口延伸罚分设为6.66),然后用Neighbor-joining法生成进化树,P-distance、Bootstrap等参数设置为默认值,抽样次数为1 000次。通过Evolview在线工具(https://www.evolgenius.info/)对系统发育树进行美化。
1.3 丹参DnaJ基因结构及启动子分析
SmDnaJ的外显子-内含子结构通过在线软件Gene Structure Display Server 2.0(http://gsds.cbi.pku.edu.cn/)进行分析,利用NCBI数据库中的CD-Search工具分析SmDnaJ蛋白序列的保守结构域,通过Evolview在线工具将系统发育树和保守结构域结合分析。利用TBtools软件和PlantCare在线软件等分析SmDnaJ基因上游1 500 bp的启动子序列,重点分析逆境胁迫及激素响应的顺式作用元件,如干旱、光、低温、水杨酸(SA)、生长素(IAA)、茉莉酸甲酯(MeJA)和脱落酸(ABA)等。
1.4 丹参DnaJ基因表达分析
通过Illumina HiSeq2000、Illumina HiSeq2500和Illumina Genome Analyzer对3个处理(SA、MeJA、酵母提取物)和3个器官(根、叶、花)的样品进行转录组测序,这些数据储存在NCBI的Sequence Read Archive(SRA)数据库(登录号:SRX2992229、SRX2992230、SRX2992231、SRX2992232、SRX2992233、SRR1043998、SRR1045051、SRR1020591和SRX1423774)。原始数据通过Visual Bioinformatics工具进行处理,使用BMKCloud在线工具(www.biocloud.net)计算RPKM(reads per kilobase of exon model per million mapped reads)值,然后通过SPSS 18.0软件的二元相关分析功能和RPKM值计算每个转录本的Pairwise Pearson相关系数。如果P值大于0.5且具有显著相关性,则认为确实相关。最后用软件Multi Experiment Viewer(MEV4.9.0)绘制热图[13]。
2 结果与分析
2.1 丹参DnaJ基因的鉴定及蛋白序列分析
在丹参基因组中共鉴定出71个序列,经过初步分析,删除其中4条不能编码完整J结构域的序列,其余67条序列能够编码至少1个J结构域,因此被确定为丹参DnaJ基因,依次命名为SmDnaJ1—SmDnaJ67。同拟南芥DnaJ基因数量相比较,可以发现丹参中DnaJ基因的数量与之相近,表明DnaJ基因的数量与基因组大小没有直接关系,DnaJ基因的数量是相对保守的。表1列出了67个丹参DnaJ基因的详细信息,SmDnaJ预测的相对分子质量为13.7×103(SmDnaJ28)至146.0×103(SmDnaJ53),预测的蛋白长度为115个氨基酸(SmDnaJ57)至1 322个氨基酸(SmDnaJ53),等电点为4.25(SmDnaJ12)至10.15(SmDnaJ28)。

表1 丹参DnaJ基因的详细信息Table 1 The list of DnaJ sequences identified in Salvia miltiorrhiza
2.2 丹参DnaJ基因家族系统发育分析
汇总72条AtDnaJ基因和67条SmDnaJ基因序列,通过MEGAX软件构建进化树,分析它们之间的亲缘关系。由于SmDnaJ几乎都只有1个J结构域,因此不采用基于基因结构分类的计算方法。DnaJ的系统发育树(无根树)显示了丹参DnaJ基因与拟南芥的进化关系(图1),根据进化树的分支聚类情况将SmDnaJ和AtDnaJ分成10组,记为A— J,这些组中依次有3、7、10、2、3、11、3、7、10和11个丹参DnaJ基因。
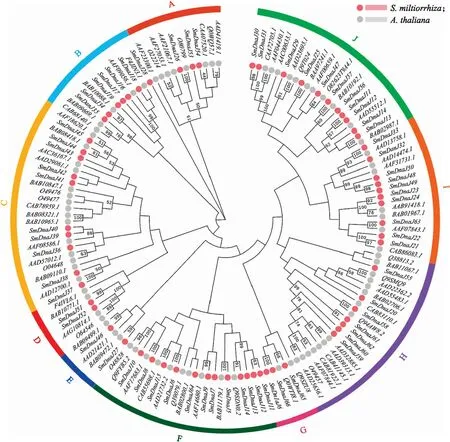
图1 丹参和拟南芥DnaJ基因的系统发育树及其分类Fig.1 Phylogenetic tree and classification of DnaJ in Salvia miltiorrhiza and Arabidopsis thalianaA—J:基因分组Gene groups.
2.3 丹参DnaJ基因结构及启动子分析
SmDnaJ蛋白由J结构域、锌指结构域、G结构域和CTD结构域在内的4种结构域组成,而定义DnaJ蛋白的关键在于4种结构域中最保守的结构域(J结构域),它能够调控HSP70(相对分子质量为70×103的热休克蛋白)的活性[14]。基于这些保守结构域,可以将J蛋白家族分为3种类型:第Ⅰ型亚组涵盖具有完整4种结构域的蛋白质;第Ⅱ型亚组包含具有J结构域、CTD结构域和富含甘氨酸(不含锌指结构域)的蛋白质;第Ⅲ型亚组由仅具有J结构域的蛋白质组成[15]。从图2-A可知,67个SmDnaJ都具有1个J结构域,且大多数蛋白仅有1个J结构域,应将其分类为J蛋白家族的Ⅲ型亚组。划分进H亚组的部分SmDnaJ具有多个保守结构域:SmDnaJ55和SmDnaJ20包含J结构域、CTD结构域和CRR结构域(具有4个C-X-X-C-X-G-X-G重复模块的锌指结构域);SmDnaJ58和SmDnaJ59包含J结构域和CTD结构域。外显子-内含子结构可以反映同源基因的进化关系,外显子-内含子结构与SmDnaJ基因分组之间具有一定的规律性:A组和J组等含有多个内含子,而C组绝大多数成员没有内含子(图2-B)。

图2 丹参DnaJ蛋白的保守结构域(A)及其基因结构(B)Fig.2 The conserved domain(A)and gene structures(B)of the DnaJ in S.miltiorrhiza
从丹参基因组中摘录67个SmDnaJ基因上游1 500 bp的启动子序列,其中包含的顺式作用元件通过PlantCARE等软件进行预测。如图3所示,除SmDnaJ25外,在所有SmDnaJ基因上游1 500 bp长度的启动子区域内至少含有1个应激相关的顺式调控元件,主要与水杨酸(SA)、茉莉酸甲酯(MeJA)和脱落酸(ABA)等激素响应以及光、温度和干旱等环境响应有关。其中SmDnaJ17含有多达21个顺式作用元件,分别为5个光响应元件、1个低温响应元件、1个水杨酸响应相关元件、10个茉莉酸响应相关元件和4个脱落酸响应相关元件。
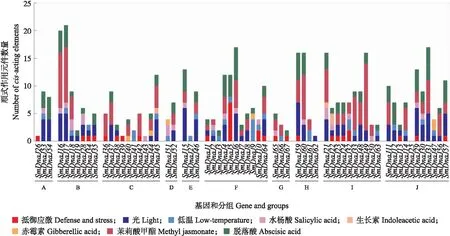
图3 丹参SmDnaJ基因的顺式作用元件Fig.3 cis-elements analysis of SmDnaJ genes in S.miltiorrhiza 柱状图颜色对应顺式作用元件类型,柱状图长度对应顺式作用元件数量。按照系统发育树分组的Group A —Group J进行排序。The color of the bar chart corresponds to the type of cis-acting elements and the length of the bar chart corresponds to the number of cis-acting elements. The sequence was sorted according to Group A-Group J of phylogenetic tree grouping.
2.4 DnaJ蛋白在丹参酚酸和酮代谢途径中表达分析
为了分析预测到的DnaJ蛋白在丹参酚酸和丹参酮代谢合成途径的功能和表达情况,建立了相关基因的表达图谱。丹参酚酸、酪氨酸和苯丙氨酸代谢途径有许多关键酶基因(SmC4H1、SmCYP98A14、SmPAL1、SmRAS1、SmTAT1、SmHPPR1)和相关转录因子(SmMYC2a、SmbHLH51、SmbHLH37、SmERF111、SmMYC2b、SmTTG1、SmAREB1、SmbHLH148、SmMYB36、SmMYB39、SmMYB111、SmPAP1、SmERF115)。基于丹参转录组数据,对DnaJ蛋白与以上关键酶基因和调控关键酶基因表达的转录因子进行共表达分析。共表达分析结果(图4)显示,在丹参酚酸途径中主要分为4个簇:第1个簇包含转录因子SmMYC2a和SmbHLH51,关键酶基因SmC4H1、SmCYP98A14和SmPAL1,DnaJ基因(SmDnaJ14、52、29、18、33、32、19、13、51、58);第2个簇包含转录因子SmMYC2b、DnaJ基因(SmDnaJ34、17、4、27、58、7、6、15、20、46、57、35、48、49、64);第3个簇包含转录因子SmTTG1和SmAREB1、DnaJ基因(SmDnaJ43、9、3、11、12、23、24、10、1、37、65);第4个簇包含转录因子SmbHLH148、SmMYB36、SmMYB39、SmMYB111和SmPAP1,关键酶基因SmRAS1、SmTAT1和SmHPPR1,DnaJ基因(SmDnaJ60、41、42、21、26、54、16、40、45、31、59、61、38、55、22、63、36、2、53、47、50、44、56、62、66、67)。其中10个DnaJ基因(SmDnaJ34、35、48、49、64、43、38、2、66、67)在检测组织(根、叶、花)中几乎没有表达,4个基因(SmDnaJ19、13、30、58)在检测组织中均表达,其他丹参DnaJ基因存在组织特异性表达的情况,如叶片中特异性表达的SmDnaJ5,花和叶片中特异性表达的SmDnaJ15和SmDnaJ7(图4-A)。SmDnaJ19和SmDnaJ13的基因表达水平则在茉莉酸甲酯处理后明显上调。
丹参酮等萜类化合物是通过胞体甲羟戊酸(MVA)途径和质体2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径生物合成的[16-17],涉及关键酶基因SmGGPPS1、SmCPS1、SmKSL1、SmDXR、SmCYP76AK1、SmCYP76AH1、SmCYP76AH3、SmIPI1、SmHMGR2、SmCPS2、SmHMGR1和相关转录因子SmMYB9b、SmERF115、SmbHLH148、SmMYB36、SmMYC2b、SmERF6、SmWRKY1、SmAREB1、SmbHLH10、SmMYC2a。对丹参DnaJ基因与上述丹参酮生物合成关键酶基因和相关转录因子进行共表达分析。从图4-B可知,在丹参酮代谢途径中主要分为3个簇:第1个簇包括DnaJ基因(SmDnaJ36、2、53、44、56、47、50、62、60、41、42、21、32、39、26、54、16、40、45、31、59、61、38、55、22、68、35、48、49、64),关键酶基因SmGGPPS1、SmCPS1、SmKSL1、SmDXR、SmCYP76AK1、SmCYP76AH1、SmCYP76AH3、SmIPI1、SmHMGR2和SmCPS2,转录因子SmMYB9b、SmbHLH148、SmMYB36和SmMYC2b;第2个簇包括DnaJ基因(SmDnaJ14、52、19、30、13、51、58、43、9、3、11、12、23、24、10、1、37、25、68、65),转录因子SmERF6、SmWRKY1和SmAREB1;第3个簇包含DnaJ基因(SmDnaJ17、4、27、5、8、6、15、20、46、7、57、29、18、33、34、66、67),转录因子SmERF6、SmWRKY1、SmAREB1、SmbHLH10和SmMYC2a,关键酶基因SmHMGR1。其中有9个DnaJ基因(SmDnaJ2、35、48、49、64、43、34、66、67)在检测组织中几乎没有表达,其他58个DnaJ基因可以在至少1个组织中表达,包括16个在所有检测组织中均有表达的DnaJ基因(SmDnaJ41、26、16、14、52、19、30、13、58、9、37、4、20、29、18、33)和其他特异性表达的基因。SmDnaJ30和SmDnaJ58基因有相对较高的表达水平。采用茉莉酸甲酯以及酵母提取物处理后,分别有SmDnaJ19、30、58、9、1、37、29和SmDnaJ14、19、30、13、58、9、3、10、1、37、4基因高表达。

图4 不同组织中与不同因素诱导下SmDnaJ基因共表达热图Fig.4 Heat map of the expression profiles of SmDnaJ genes in different tissues and in response to various treatments A. SmDnaJ基因与酚酸、酪氨酸和苯丙氨酸代谢途径相关基因的共表达热图;B. SmDnaJ基因与萜类代谢途径相关基因的共表达热图。A. The co-expression heat map of SmDnaJ gene and genes related to phenolic acid,tyrosine and phenylalanine metabolic pathway;B. The co-expression heat map of SmDnaJ gene and genes related to terpene metabolic pathway.MeJA:茉莉酸甲酯Methyl jasmonate;YE:酵母提取物Yeast extract;SA:水杨酸Salicylic acid.
3 讨论
HSP70、DnaJ蛋白家族的成员在缓解生物或非生物胁迫中均起重要作用,相关研究中发现拟南芥具有 89个 DnaJ蛋白家族的成员[8]。在本研究中,我们对丹参DnaJ基因家族进行系统进化树构建、外显子-内含子结构分析、保守结构域鉴定、启动子顺式元件识别和基因共表达分析等工作,对丹参DnaJ基因有了进一步了解。
J蛋白家族通常分为3种类型,只有1个J结构域的DnaJ属于Ⅲ型,而丹参中的DnaJ具有相似的结构,大部分只包含1个J结构域。在本研究中,DnaJ蛋白基于进化关系而进一步被细分成不同的亚组,将SmDnaJ和AtDnaJ共分为10组(A、B、C、D、E、F、G、H、I和J)。其中C组内含子的数量最保守,也是最少的1个亚组。从外显子-内含子结构和保守结构域分布的情况可以看出,其规律性可以很好地与先前分类的亚组相匹配。已有研究证明,DnaJ基因能够通过某些顺式调控元件响应多种生物和非生物胁迫,从而在植物信号通路中起着重要作用。拟南芥花中表达的J3蛋白介导开花信号的整合识别[18];拟南芥叶片中表达的DnaJ蛋白起着调控叶片生长的重要作用[19];DnaJ/Hsp40家族蛋白BIL2通过油菜素甾体信号途径来促进植物生长和提高逆境抵抗力[20]。
启动子序列中的顺式调控元件可以调节基因的转录水平,如GEAT、LTR、SARE、GARE、AuxRE、CGTCA基序和ABRE等调控元件,能够响应光、低温、SA、IAA、GA、MeJA和ABA等生物或非生物因素的诱导[21-28]。用PlantCARE分析了SmDnaJ启动子序列中的顺式作用元件,能够更好地理解SmDnaJ基因在环境胁迫下如何行使生物学功能[29]。植物激素是某种次生代谢产物,在化学信号传递和响应生物或非生物胁迫的过程中起着重要作用[30]。不同植物在施加茉莉酸甲酯后,都能诱导大量防御相关基因的表达[31];植物不同的器官合成脱落酸来启动防御机制,导致大量防御相关基因表达,从而帮助植物抵御逆境胁迫,度过不利于生长的时期[32]。大多数SmDnaJ基因都有1个以上响应MeJA和ABA的顺式作用元件,这表明SmDnaJ可能是与次生代谢相关的重要基因之一,在响应多种逆境胁迫时有重要作用。为了深入分析SmDnaJ的功能,我们还研究了SmDnaJ基因在不同组织中的表达情况。少数SmDnaJ基因在根、叶、花中几乎没有表达,而大多数SmDnaJ基因在1个或多个组织中均有表达,其中部分SmDnaJ基因在特定组织中特异性表达,这意味着DnaJ蛋白可能参与生长发育过程,同时也表明SmDnaJ基因可能与植物激素信号通路密切相关,如茉莉酸甲酯和水杨酸途径。
预测含有SA响应元件的DnaJ基因共有21个,分布在所有亚组,其中SmDnaJ6、15、17、18、32表达下调,SmDnaJ10、28、50、65表达上调,只有少数成员如SmDnaJ52、60变化差异较小;不含SA元件的DnaJ基因中只有少部分出现表达变化,大多数基因的表达水平相较于对照组没有变化,可能是由其他基因表达变化间接导致的。预测不含有MeJA响应元件的DnaJ基因共有17个,其中仅有几个基因表达有明显差异;其余50个含有MeJA响应元件的DnaJ基因,如SmDnaJ3、24、37、44、53表达上调,SmDnaJ5、6、7、31、56表达下调,而SmDnaJ2、9、38表达变化不明显。大多数SmDnaJ基因在激素诱导下的表达水平与启动子顺式作用元件的预测结果相符合,表明SmDnaJ基因在激素诱导的次生代谢途径中可能发挥作用,而具有激素响应元件而表达水平不受相应激素诱导的DnaJ基因具有何种作用,与关键酶基因之间有何关系需要进一步探究。
阐明SmDnaJ蛋白的进化关系,分析SmDnaJ成员的功能差异,将有助于进一步阐明SmDnaJ蛋白结构与功能之间的关系。DnaJ蛋白的序列特征和功能同时存在保守性和多样性,这些结果有助于进一步验证SmDnaJ蛋白对逆境响应和代谢调控的具体机制。
