茶树TPP基因家族的鉴定及其对低温胁迫的响应
2022-01-27吕程佳李芳王梦荷段兆翔尚小文马媛春朱旭君房婉萍
吕程佳,李芳,王梦荷,段兆翔,尚小文,马媛春,朱旭君,房婉萍
(南京农业大学园艺学院,江苏 南京 210095)
茶树(Camelliasinensis)是一种重要的经济作物,其鲜叶是制作商品茶的主要原材料。茶树鲜叶中含有多种次级代谢产物,如茶氨酸、咖啡碱、儿茶素和萜烯类化合物等,使得茶汤拥有独特的滋味和香气[1-3]。茶树作为一种喜阴喜湿的多年生作物,种植于热带和亚热带地区,在较为寒冷的地区则难以种植[4],茶树受低温胁迫后会影响茶叶产量,降低茶叶生产的经济效益。近年来,随着生活水平的提高,人们对茶喜爱度进一步增加,需要进一步扩大茶树种植区域。在技术层面上,我国学者提出南种北引的解决方案。但在该方案实施过程中,遇到的最严峻问题就是南方茶树品种抗寒性较差,无法在北方成功越冬。因此,如何提高茶树的抗寒性成为研究的热点之一。
茶树在遭受低温胁迫时,通过诱导抗寒相关基因表达,促进渗透调节物质积累,改变激素水平等来提高自身的适应能力[5-8]。其中,渗透调节物质主要通过调节细胞的渗透势、保护细胞膜的稳定性和加速活性氧的清除速率等,提高茶树应对低温胁迫的能力[8]。研究表明,茶树在遭受低温胁迫时,体内大量积累脯氨酸、甜菜碱和海藻糖等渗透调节物质[9]。目前,关于脯氨酸和甜菜碱在茶树体内积累的分子机制[10-11]报道较多,而关于海藻糖的报道较少。
海藻糖是一种由2个α-葡萄糖分子组成的非还原性双糖,广泛分布于酵母、细菌、真菌、动物、昆虫和植物中[12-13]。在植物体内,海藻糖的生物合成主要分为2个步骤:第1步,以尿苷二磷酸葡萄糖(UDPG)和葡萄糖-6-磷酸(G6P)为底物,在海藻糖-6-磷酸合成酶(TPS)的催化作用下生成磷酸化的中间产物海藻糖-6-磷酸(T6P)[14];第2步,T6P在海藻糖-6-磷酸磷酸酶(TPP)的催化作用下,脱磷酸生成海藻糖[15]。丁菲等[16]成功克隆1个茶树CsTPS基因(GenBank登录号JQ742017),该基因编码932个氨基酸。茶树CsTPS基因所编码的氨基酸序列与拟南芥、烟草和番茄等植物的TPS同源性较高,且其转录水平在低温下会被诱导。目前茶树中关于合成海藻糖的直接上游基因CsTPP尚未见报道。本试验通过对茶树TPP基因家族的全基因组鉴定和分析,研究其在不同组织器官的表达量及对低温和干旱胁迫的响应,为进一步探索非生物胁迫诱导茶树海藻糖积累的分子机制奠定基础。
1 材料与方法
1.1 试验材料
供试材料为高抗逆性茶树品种‘苏茶早’1 年生扦插苗。扦插苗种植在装有营养土(黑土与蛭石为体积比为1∶1)的穴盘中;每个穴盘中有 120 株茶树苗。本试验于2020 年9 月20 日从穴盘中挑选90 株生长良好、长势一致的1年生扦插苗,移植于塑料盆(长、宽均为7 cm,高度为7.8 cm)内,每盆1 株,置于ZRX-800C-LED植物生长气候箱(宁波科晟实验仪器有限公司)预培养。预培养条件:25 ℃光照培养 14 h,然后切换为20 ℃黑暗培养10 h,每24 h为1个循环(以下表示为25 ℃/20 ℃),相对湿度为80%,光照度为150 000 lx。
1.2 茶树TPP基因家族成员的鉴定
从最新发布的茶树基因组数据库(http://www.plantkingdomgdb.com/tea_tree)[16]搜索注释为海藻糖-6-磷酸磷酸酶(TPP)的序列并下载。在拟南芥数据库(https://www.arabidopsis.org/)下载拟南芥AtTPPA—AtTPPJ的序列,在联合基因组研究所的数据库(https://phytozome.jgi.doe.gov/pz/portal.html)下载水稻OsTPP1—OsTPP12的序列。通过比较CsTPP与AtTPP和OsTPP所编码蛋白的保守结构域,筛选具有Trehalose-PPase(PF02358)保守结构域的序列作为候选基因,用于后续分析。
1.3 茶树TPP基因系统进化树构建
对上述鉴定到的CsTPP、AtTPP和OsTPP基因所编码的氨基酸序列在MEGA 4.0软件中进行Clustal W比对。采用MEGA 4.0软件构建系统发育进化树。使用的具体方法如下:邻域连接法(Neighbor-joining),基于JTT矩阵方法(JTT matrix-based)、泊松校正(Poisson correction)、成对删除(Pair-wise deletion)和1 000次重复的百分比引导值。
1.4 茶树TPP基因所编码蛋白的保守结构域分析
利用EBL-EBI(http://www.ebi.ac.uk/interpro/search/sequence-search)分析蛋白氨基酸序列的保守区,并用IBS 1.0软件绘制蛋白保守结构域图;使用 MEME工具(http://memesuite.org/tools/meme)对茶树TPP蛋白的保守基序进行分析,最大基序数量参数为9个,最小基序数量参数为6个,最大宽度设置为50,其余为默认。
1.5 茶树TPP基因启动子顺式元件分析
根据鉴定出的目标基因序列,提取CsTPP基因转录起始密码子上游2 000 bp的基因组序列,利用PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)对启动子中所含的顺式作用元件进行预测分析。
1.6 茶树TPP基因的组织特异性表达分析
于2020 年10 月20 日取18 株1年生扦插苗的第3叶、嫩茎、花和根等不同组织,迅速放于液氮中,恒温后保存于-80 ℃冰箱备用。
取上述备用的各组织材料,按照EASYspin Plus多糖多酚复杂植物RNA快速提取试剂盒的说明书,提取茶树总RNA,利用非变性琼脂糖凝胶电泳检测其是否降解。使用PrimeScriptTMRT reagent kit with gDNA eraser试剂盒进行RNA反转录。将反转录生成的cDNA稀释10 倍后作为模板,CsGAPDH为内参基因,进行荧光定量PCR(qPCR),用于检测基因的表达量。
qPCR检测按照TB GreenPremixExTaqTM(Tli RNaseH Plus)试剂盒说明书进行。qPCR 扩增体系(20 μL):TB GreenPremixExTaqⅡ(Tli RNaseH Plus)(2×)10 μL,上、下游引物各 0.5 μL,cDNA溶液 1 μL,灭菌水8 μL。扩增程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环,每个样品3个重复。基因相对表达量分析采用2-ΔΔCT法[17-18]。利用SPSS 19.0软件进行单因素方差分析和配对t测验。各TPP基因的PCR引物序列见表1。由于茶树基因组序列尚未明确,未能够成功获得CsTPP1的荧光定量引物,该基因的序列有待进一步验证。

表1 CsTPP基因的荧光定量PCR引物序列Table 1 RT-qPCR primer sequences for CsTPP genes
1.7 茶树TPP基因的低温胁迫响应分析
于2020年10月20日将36株1年生扦插苗转移至光照/黑暗温度为18 ℃/15 ℃(表示为18 ℃/15 ℃,下同)的RDN-300C顶置LED人工气候箱(宁波扬辉仪器有限公司)低温处理2 d,再转移至10 ℃/8 ℃处理2 d。在4 d时取第3叶作为4 d轻度低温处理组样品,同时取培养于25 ℃/20 ℃的第3叶作为对照组样品。将在18 ℃/15 ℃处理2 d、10 ℃/8 ℃处理2 d后的18 株扦插苗,继续转移至4 ℃/2 ℃培养2 d,再转移至2 ℃/0 ℃培养2 d。8 d时取第3叶作为8 d中度低温处理组样品,同时采取培养于25 ℃/20 ℃的第3叶作为8 d对照组样品。每6株为1个重复,每个处理3个重复。上述样品采摘后,迅速放于液氮中,恒温后保存于-80 ℃冰箱备用。RNA提取和荧光定量PCR方法同1.6节。
2 结果与分析
2.1 茶树TPP基因家族的鉴定与系统进化树分析
利用已报道的拟南芥和水稻TPP基因的核苷酸和氨基酸序列信息,从茶树基因组数据库中鉴定并获得12个CsTPP基因:CsTPP1—CsTPP12(表1)。茶树CsTPP基因的序列长度为351~1 557 bp,编码116~518个氨基酸,蛋白相对分子质量为(13.43~57.79)×103,等电点为5.90~10.00。蛋白亚细胞定位预测分析结果显示,12个CsTPP中有2个CsTPP定位在细胞质中,有5个CsTPP定位于叶绿体,有3个CsTPP定位于质膜,CsTPP3定位于液泡,CsTPP6定位于细胞外(表2)。由此可见,12个CsTPP蛋白在茶树中可能在不同的细胞器中发挥不同的生物学功能。
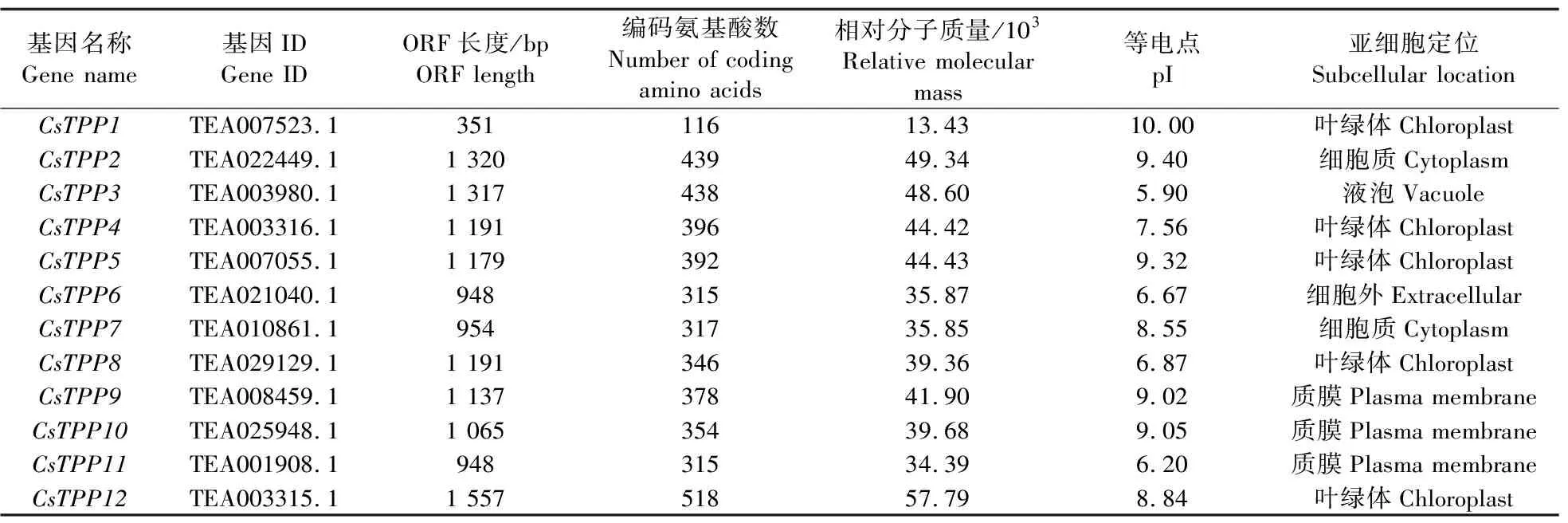
表2 茶树CsTPP基因的序列特征Table 2 Sequence characteristics of CsTPP gene
蛋白的系统进化分析显示,茶树TPP家族共分为3个组(图1-A)。第1组有5个成员,分别为CsTPP1、CsTPP2、CsTPP3、CsTPP4和CsTPP5,其中CsTPP2、CsTPP3与拟南芥TPPA具有较高的同源性,CsTPP4、CsTPP5与拟南芥TPPG/F具有较高的同源性。第2组有3个成员,分别为CsTPP6、CsTPP7、CsTPP8,均与水稻TPP3/8/9具有较高同源性。第3组有4个成员,分别是CsTPP9、CsTPP10、CsTPP11和CsTPP12,CsTPP9、CsTPP10与拟南芥TPPB/C具有较高同源性,CsTPP11、CsTPP12与拟南芥TPPI/J/H/E具有较高同源性。保守结构域分析显示,茶树TPP家族的12个基因都具有Trehalose-PPase结构域,且均分布于序列N端(图1-B)。根据文献报道,含有Trehalose-PPase结构域的基因常常具有合成海藻糖的功能,因此鉴定的12个TPP基因均属于茶树TPP基因家族。

图1 茶树与拟南芥、水稻TPP蛋白的系统进化(A)及茶树TPP基因所编码蛋白的保守结构域分析(B)Fig.1 Systematic evolution of TPP in tea plant,Arabidopsis thaliana and Oryza sativa(A), and conserved domain analysis of the protein encoded by TPP in tea plant(B) 不同颜色表示茶树TPP分为3个组:CsTPP1—CsTPP5是第1组,CsTPP6—CsTPP8是第2组,CsTPP9—CsTPP12是第3组。Os:水稻;At:拟南芥。Different colors indicate that the CsTPP is divided into 3 groups:CsTPP1-CsTPP5 is the first group,CsTPP6-CsTPP8 is the second group,and CsTPP9-CsTPP12 is the third group. Os:Oryza sativa;At:Arabidopsis thaliana.
2.2 茶树TPP基因家族结构分布
根据茶树基因组TPP家族成员序列信息,利用Tbtools绘制CsTPP的基因结构图谱(图2)。CsTPP基因家族成员的基因组序列长度为1~22 kb,其中CsTPP3的基因组序列最长,约22 kb。大部分CsTPP都具有 5′或(和)3′UTR,只有CsTPP10、CsTPP11和CsTPP1没有UTR。所有家族成员均含有外显子和内含子,且外显子数量较多,大都在10个以上。
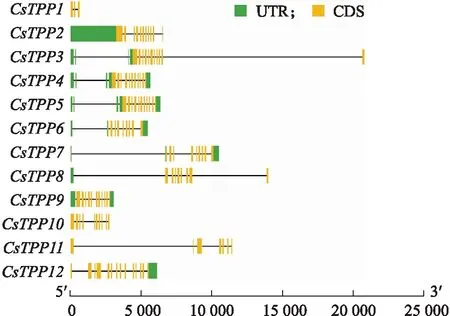
图2 CsTPP基因结构分布Fig.2 Distribution of CsTPP gene structureUTR:非翻译区Untranslated regions;CDS:编码区Coding sequences.
2.3 CsTPP基因所编码蛋白的序列比对
根据茶树基因组所提供的TPP家族成员蛋白序列信息,利用DANMAN 7.0绘制CsTPP的氨基酸序列比对图(图3)。茶树TPP蛋白序列的多重序列比对和保守基序分析(图4)结果显示有9个基序,其中基序2、基序4和基序5在12个基因中均有覆盖,具有高度保守性,并且研究发现水稻、拟南芥和玉米等植物TPP基因也存在这些保守的序列[19],因此推测这3个基序对TPP蛋白行使功能具有重要作用。图4和图1-B结果显示,CsTPP1和CsTPP11不具有完整Trehalose-PPase结构域和CsTPP 的保守基序。然而,进化树分析显示其与水稻和拟南芥的TPP家族聚在一起。这可能与茶树基因组数据尚不完整有关。CsTPP1和CsTPP11的基因序列不完整,有待通过RACE方法进一步确认。

图3 CsTPP氨基酸序列的多重比对Fig.3 Multiple alignment of amino acid sequences of CsTPP 图中不同颜色区域显示不同的一致性水平:深蓝色为 100%;红色为≥75%;浅蓝色为≥50%。Different color areas in the picture show different consistency levels:dark blue is 100%;red is≥75%;light blue is≥50%.

图4 CsTPP家族保守基序分析Fig.4 Conservative motif analysis of CsTPP family
2.4 CsTPP基因启动子顺式元件分析
为了进一步分析茶树TPP基因可能参与的生物学过程,对茶树12个TPP基因上游2 kb区域(启动子区)的顺式作用元件进行分析。结果(图5)表明,12个CsTPP基因的启动子区均含有多个胁迫响应和激素响应相关顺式元件。主要的胁迫响应相关元件包括:MBS、MBSI、LTR、ARE,主要的激素响应相关元件包括:P-box、TATC-box、TCA-element、TGA-element、CGTCA-motif、ABRE和AuxRR-core。
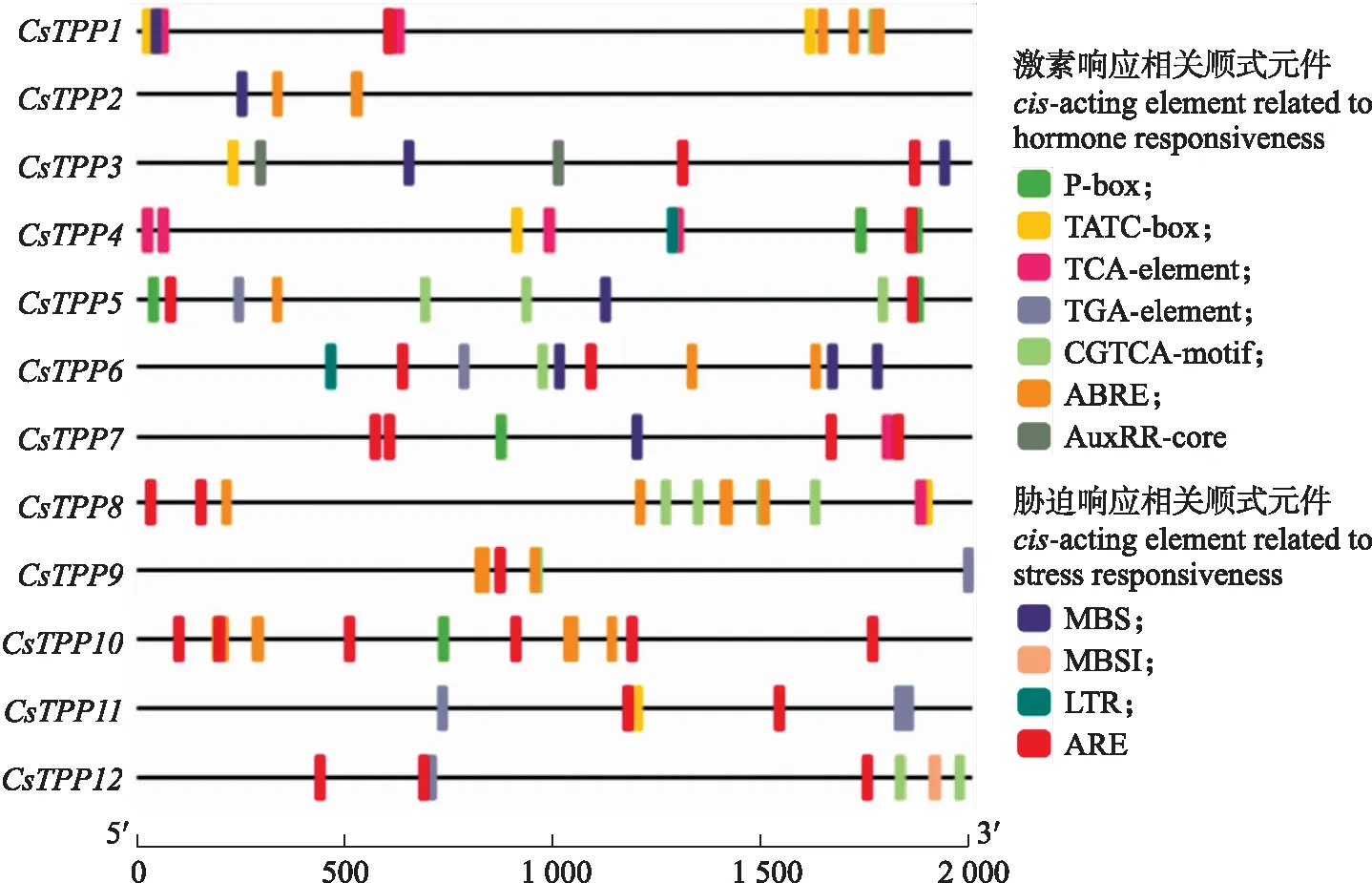
图5 CsTPP基因启动子区顺式元件分析Fig.5 Analysis of cis-elements in CsTPP promoter region P-box:赤霉素响应元件;TATC-box:参与赤霉素响应的顺式作用元件;TCA-element:参与水杨酸响应的顺式作用元件;TGA-element:生长素响应元件;CGTCA-motif:参与MeJA响应的顺式调控元件;ABRE:参与脱落酸响应的顺式调控元件;AuxRR-core:参与生长素响应的顺式调控元件;MBS:参与干旱诱导的MYB结合位点;MBSI:参与黄酮类生物合成基因调控的MYB结合位点;LTR:参与低温响应的顺式作用元件;ARE:厌氧诱导所必需的顺式作用调控元件。P-box:Gibberellin-responsive element;TATC-box:cis-acting element involved in gibberellin-responsiveness;TCA-element:cis-acting element involved in salicylic acid responsiveness;TGA-element:Auxin-responsive element;CGTCA-motif:cis-acting regulatory element involved in the MeJA-responsiveness;ABRE:cis-acting element involved in the abscisic acid responsiveness;AuxRR-core:cis-acting regulatory element involved in auxin responsiveness;MBS:MYB binding site involved in drought-inducibility;MBSI:MYB binding site involved in flavonoid biosynthetic genes regulation;LTR:cis-acting element involved in low-temperature responsiveness;ARE:cis-acting regulatory element essential for the anaerobic induction.
2.5 CsTPP基因的组织特异性表达模式
由图6可见:除CsTPP4、CsTPP11和CsTPP12外,其余CsTPP在不同组织中的表达存在较大差异。其中CsTPP8在叶中特异性高表达;CsTPP5和CsTPP9在茎中特异性高表达;CsTPP3和CsTPP5在花中特异性高表达;CsTPP2、CsTPP6和CsTPP7在根中特异性高表达。表明不同CsTPP基因家族成员在茶树各组织具有不同的调控作用,且个别基因的高表达也表明其在CsTPP基因家族调控茶树生长发育过程中的重要性。

图6 CsTPP基因在不同组织中的表达分析Fig.6 Expression analysis of CsTPP gene in different tissues不同字母表示差异显著(P<0.05)。Different letters indicate significant difference at 0.05 level.
2.6 CsTPP基因低温胁迫下的表达模式
如图7所示:大部分茶树TPP基因都响应低温胁迫,且被诱导表达。其中CsTPP5、CsTPP6、CsTPP7和CsTPP11在4 d轻度低温处理和8 d中度低温处理下的表达量均发生上调,而CsTPP2、CsTPP4、CsTPP8、CsTPP9和CsTPP12只在4 d轻度低温处理下的表达量发生上调,CsTPP3和CsTPP10只在8 d中度低温处理下的表达量发生上调。表明TPP基因家族在茶树应对低温胁迫的过程中起作用,且不同成员在低温胁迫的不同时期起作用。

图7 CsTPP基因在低温胁迫下的表达分析Fig.7 Expression analysis of CsTPP gene under low temperature stress*P<0.05.
3 讨论
在高温、低温、干旱等非生物胁迫下,海藻糖可在细胞内迅速积累,通过增加蛋白质、核酸等生物大分子结构的稳定性,进而提高植物抵御不良环境的能力[20]。T6P是海藻糖的代谢前体物质,主要存在于细胞质,通过抑制蔗糖非酵解相关激酶1(SnRK1)的催化活性,进而调控植物生长代谢[21]。海藻糖-6-磷酸合成酶(TPS)是催化T6P的生物合成酶,而海藻糖-6-磷酸磷酸酶(TPP)是催化T6P生物分解的蛋白酶,两者是海藻糖合成途径中的关键酶。TPP基因广泛存在于高等植物中,拟南芥TPP家族包括10个成员[22-23],水稻TPP家族包括13个成员[19],玉米TPP家族包括26个成员[24]。本研究在茶树基因组中共鉴定到12个TPP基因。TPP基因家族在不同物种中数量差异较大,说明该家族可能在植物进化过程中发生基因复制现象。
基因应答响应的特点与启动子的顺式作用元件相关。丁泽红等[25]研究表明,木薯MeTPP1具有干旱诱导元件MBS和ABA响应元件ABRE,脱落酸处于植物响应干旱、低温等非生物逆境的信号传导中枢,可调控基因的表达:在PEG-6000胁迫条件下,MeTPP1的表达量在老叶和第1片完全展开叶中均呈现先下降后上升的变化趋势;在低温胁迫下,在未展开叶、第1片完全展开叶和根中,MeTPP1的表达量均呈持续上升的趋势。杨雪等[19]研究表明OsTPP3存在的厌氧响应元件ARE和GC-motif赋予了OsTPP3基因在种子缺氧萌发时高表达;干旱处理条件下,在生长7 d的水稻幼苗根和嫩芽中,OsTPP3基因的表达量较对照组提高5倍。丁菲等[16]研究表明在低温胁迫下,CsTPS基因会诱导表达。本研究中,CsTPP2、CsTPP3、CsTPP5、CsTPP6和CsTPP8具有干旱诱导元件MBS和厌氧响应元件ARE,CsTPP4和CsTPP6具有低温诱导元件LTR,CsTPP1、CsTPP2、CsTPP5、CsTPP6、CsTPP8、CsTPP9、CsTPP10和CsTPP11具有ABA响应元件ABRE,猜测这些CsTPP基因可能参与茶树低温、干旱等非生物逆境响应过程。
低温条件下,茶树根系、老叶和嫩叶中CsTPS的表达量表现出不同程度上调,在老叶和嫩叶中的上调程度明显大于根系,表明CsTPS基因可能具有提高茶树抗寒性的功能[26]。另外,在低温胁迫6 h后,茶树根系、老叶和嫩叶中CsTPS的表达量开始增加,说明CsTPS基因可能作为一种次级冷诱导蛋白,受上游一级冷诱导蛋白的调控后才开始转录翻译[16]。本研究表明,CsTPP10在8 d的低温处理下诱导表达,CsTPP6在4 d的低温处理下诱导表达,猜测这2个基因可能与CsTPS基因共同作为次级冷诱导蛋白,在茶树抗寒过程中起重要作用。CsTPP和CsTPS这2个家族的基因具有紧密联系,可能共同协调参与茶树响应低温过程。
高温胁迫下拟南芥TPS和TPP基因表达量和海藻糖含量有关[27-28]。转基因水稻OsTPS1和OsTPP1的过量表达能提高内源性海藻糖含量,并提高水稻在低温胁迫下的存活率[29]。对CsTPP基因低温胁迫下的表达研究结果发现,茶树受到低温胁迫4 d后,茶树叶片中CsTPP6的表达量有显著上调,猜测CsTPP6可能通过提高表达量和增加茶树叶片中海藻糖的积累量来参与茶树响应低温胁迫的过程。
拟南芥TPP家族的10个成员具有不同的时空表达模式和逆境响应模式,AtTPPB在茎尖分生组织和幼叶的基部高表达,具有影响植物枝条大小的功能,功能缺失会增加叶面积[22],CsTPP9与AtTPPB具有较高同源性,在茎中高表达,因此猜测其表达会影响茶树枝条的发育。本研究仅对茶树TPP基因家族进行鉴定和表达分析,但其在茶树生长发育和逆境胁迫下反应的具体调控机制还需进一步研究。
