吲哚放线杆菌AIFJ1607株全基因组测序及耐药特性分析
2022-01-25车勇良陈秋勇陈如敬吴学敏王隆柏刘玉涛周伦江
车勇良,陈秋勇,陈如敬,吴学敏,王隆柏,刘玉涛,周伦江
(福建省农业科学院 畜牧兽医研究所 福建省畜禽疫病防治工程技术研究中心,福建 福州 350013)
吲哚放线杆菌(Actinobacillusindolicus,A.indolicus)是附着于猪上呼吸道的一种常在菌[1],该菌与小放线杆菌(Actinobacillusminor)、猪放线杆菌(Actinobacillusporcinus)共属于其他NAD依赖性巴氏杆菌科成员[2-4]。NAD依赖性巴氏杆菌科成员包括副猪嗜血杆菌、胸膜肺炎放线杆菌和其他NAD依赖性巴氏杆菌科成员[4]。据报道,吲哚放线杆菌与猪的卡他性肺炎和纤维蛋白渗出性肺炎有一定关系,能引起猪场的经济损失[1]。遗传进化树显示,NAD依赖性巴氏杆菌科各成员间的亲缘关系远近不一,吲哚放线杆菌和副猪嗜血杆菌的亲缘关系最近[4-7]。
目前,仍然有大量的抗生素被用来治疗猪的呼吸道疾病,因此,多重耐药菌和泛耐药菌在全世界范围内还在迅速攀升。氟苯尼考作为一种常用的治疗猪呼吸道疾病的药物,已经导致了大量耐药细菌的产生。floR基因是一种氟苯尼考耐药基因,广泛存在于各种细菌基因组或质粒中,其中也包括副猪嗜血杆菌和胸膜肺炎放线杆菌的基因组或质粒[8-12],但在吲哚放线杆菌的质粒中还是首次被发现。
迄今,尚未有吲哚放线杆菌的全基因组序列测定的文献报道。因此,本研究从发病猪的肺脏中分离到1株多重耐药细菌,通过16S rRNA的PCR鉴定细菌种类、全基因组序列测定、并对其进行生物信息学分析,以研究该菌株的部分生物学特性并探究其耐药机制。
1 材料与方法
1.1 材料
1.1.1菌株来源 菌株AIFJ1607分离自福建省某猪场患呼吸道疾病并死亡的保育猪肺脏,分离时间:2016年7月。
1.1.2试剂和仪器 Taq DNA聚合酶、dNTPs和DNA Marker均购自TaKaRa公司;核酸抽提试剂盒和质粒纯化试剂盒购自北京全式金公司;细菌培养基TSA和TSB购自BD Difco公司;辅酶NAD购自Roche公司;无菌脱纤马血、各种药敏纸片和药敏试剂购自温州康泰生物科技公司;PCR仪从Eppendorf公司购买。
1.2 细菌分离鉴定无菌采集死亡猪的肺脏,用手术刀片分离肺脏的外膜并划开肺脏组织,接着用无菌接种环插入肺脏组织内部,拿出后划线接种于TSA培养板(含0.005%的NAD和5%的无菌脱纤马血),倒置于37℃温箱中培养24~48 h后,观察菌落形态并挑取可疑菌落进行革兰染色镜检。并将可疑单菌落继续接种于TSA培养基进行纯化培养,直至菌落形态大小均一、色泽一致为止。
挑取单个菌落接种于TSB液体培养基(含0.005%NAD和5%犊牛血清),置于振荡器37℃200 r/min振摇18~24 h,应用细菌DNA提取试剂盒提取该细菌DNA,-20℃保存备用。
合成细菌16S rRNA的通用引物27 F和1 492 R[13-16],加样剂量为PCR Mix 12.5 μL,无菌水9.5 μL,上游引物(20 mg/L)0.5 μL,下游引物(20 mg/L)0.5 μL,模板DNA 2.0 μL,共25 μL。PCR反应程序为95℃ 5 min;94℃ 40 s,52℃ 40 s,72℃ 1 min,共35个循环;72℃ 10 min,4℃保存。送PCR产物进行测序,测序结果经NCBI的BLAST比较,分析同源性比对结果。
1.3 细菌生化分析生化试验按照生化鉴定管说明书进行操作,对细菌的吲哚活性[2]、脲酶和过氧化氢酶活性[5]、NAD依赖性[17]、溶血特性、cAMP试验等进行分析。
1.4 药敏试验及最小抑菌浓度(MIC值)测定应用K-B纸片药敏实验法[18],即用接种针挑取分离的细菌涂布于TSA(含0.005%的NAD和5%的无菌脱纤马血)培养板中,选择药敏纸片粘贴于培养基上,放置于37℃培养箱培养24 h,观察并测定抑菌圈直径。质控菌株为大肠埃希菌25922株。同时,根据美国临床实验室标准化协会(CLSI)[19]的标准,应用微量肉汤稀释法测定20种抗生素的MIC值。
1.5 细菌质粒的提取及序列测定用接种针挑取分离的细菌涂布于TSB(含0.005%的NAD和5%的无菌脱纤马血)液体培养基中,37℃摇床振摇12~16 h,细菌达到对数生长期(D600=0.6),离心收集细菌沉淀,应用质粒提取试剂盒按照说明书提取细菌质粒。质粒应用耐药基因floR的特异性引物进行PCR检测[20],并且把质粒送广州基迪奥基因测序公司进行全基因组序列测定。
1.6 细菌全基因序列测定及分析用接种针挑取分离的细菌涂布于TSB(含0.005%的NAD和5%的无菌脱纤马血)液体培养基中,37℃摇床振摇12~16 h,细菌达到对数生长期(D600=0.6),离心收集细菌沉淀,用细菌基因组DNA提取试剂盒提取高质量的DNA并构建DNA文库,应用Pacific Biosciences公司研发的单分子实时测序系统的第三代测序仪PacBio RSⅡ进行全基因组序列测定。根据要求,应用多种软件对所测序列进行基因组组装和进行生物信息学分析。耐药基因通过抗性基因数据库CARD搜索获得。
2 结果
2.1 细菌的分离与鉴定猪肺脏接种TSA血平板在37℃倒置培养过夜后,血平板上出现圆形、半透明、湿润、边缘整齐的微小菌落(图1)。革兰染色后显示为微小球状、短球杆状或丝状的革兰阴性细菌(图2)。生化试验显示该细菌生长需要NAD或X因子的参与,过氧化氢酶和吲哚为阳性,尿素酶和cAMP试验为阴性,是一种不溶血的细菌。16S rRNA序列的同源性结果显示该细菌与吲哚放线杆菌46KC2株的序列同源性达到99%。因此,把该细菌命名为吲哚放线杆菌AIFJ1607株(ActinobacillusindolicusAIFJ1607)(图3)。

图1 吲哚放线杆菌菌落
图2 吲哚放线杆菌革兰染色

图3 5种不同细菌间的16S rRNA遗传进化树分析
2.2 细菌药敏试验与MIC测定K-B药敏纸片和MIC试验结果显示该菌对以下这些抗生素均耐药,分别为庆大霉素、妥布霉素、大观霉素、链霉素、新霉素、卡那霉素、青霉素、头孢、氯霉素、氟苯尼考、磺胺、四环素、博莱霉素、甲硝唑和恩诺沙星等;该细菌对泰妙菌素、亚胺培南、替米考星、林可霉素和利福平等抗生素敏感(表1)。

表1 用K-B纸片法和MIC法所进行的药物敏感性试验
2.3 细菌全基因组序列分析细菌全基因组DNA序列经测定、拼接和组装后,Subread数据统计显示number of reads为99 623,Reads of N50为9 054。细菌基因组序列全长为2 251 645 bp,GC含量为40.12%,有2 162个编码序列,58个tRNA序列,19个rRNA序列,1个CRISPR序列和36个重复序列(表2)。

表2 吲哚放线杆菌AIFJ1607株的基因组序列基本信息
根据COG注释,87.6%(1 894/2 162)的编码序列可分为22项COG,主要分为3类(图4):信息存储与加工,细胞过程和信号代谢。其中,231条编码序列被注释为氨基酸转运和代谢,272条编码序列被注释为仅一般功能预测,8条编码序列被注释为细胞运动,3条编码序列被注释为细胞外结构和1条编码序列被注释为RNA加工和修饰。圈图展示了细菌基因组序列中COG类别的分布特征(图4,5)。

图4 吲哚放线杆菌AIFJ1607株基因组序列的COG功能
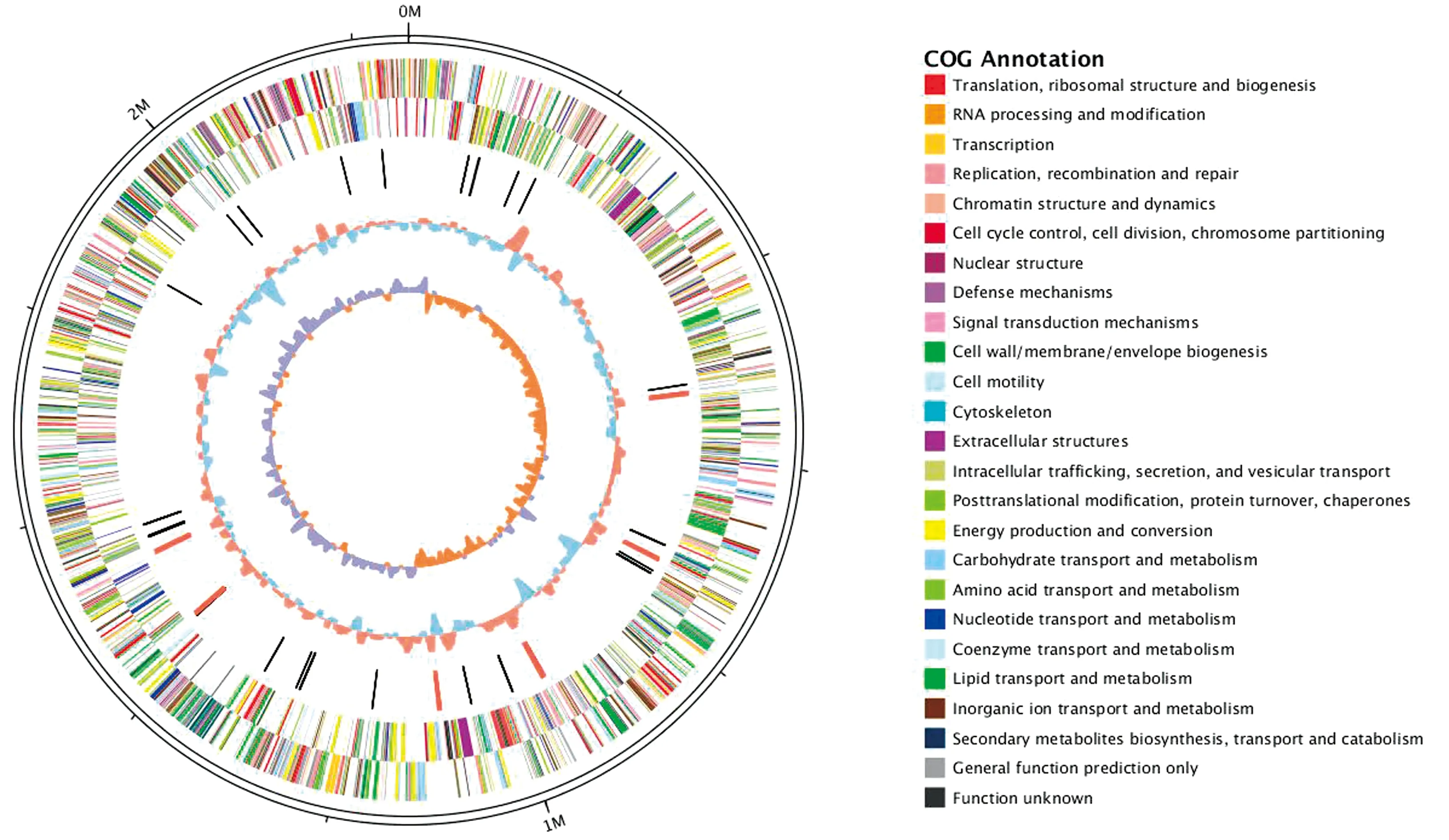
图5 吲哚放线杆菌AIFJ1607株基因组序列的COG功能圈图
2.4 细菌耐药基因及插入序列分析与抗性基因数据库CARD中的耐药基因进行比对发现了1个耐药基因岛,包括13种耐药基因,分别为aph33ib、aac(3)-Ⅱa、aph6id、aph3ia、ant3ia、ble、NimC/NimA、arsR、tetB、norA、blaROB-1、sul2和cat3,其分别对应以下抗生素:链霉素(aph33ib、aph6id和ant3ia)、庆大霉素(aac(3)-Ⅱa和aph3ia)、萘替米星(aac(3)-Ⅱa)、地贝卡星(aac(3)-Ⅱa)、妥布霉素(aac(3)-Ⅱa)、西索米星(aac(3)-Ⅱa)、新霉素(aph3ia)、卡那霉素(aph3ia)、核糖霉素(aph3ia)、巴龙霉素(aph3ia)、里杜霉素(aph3ia)、壮观霉素(ant3ia)、青霉素(blaROB-1)、头孢菌素(blaROB-1)、博莱霉素(ble)、甲硝唑(NimC/NimA)、砷抑制剂(arsR)、四环素(tetB)、喹诺酮类抗生素(norA)、磺胺类抗生素(sul2)、氯霉素类抗生素(cat3)(表3、图6)。
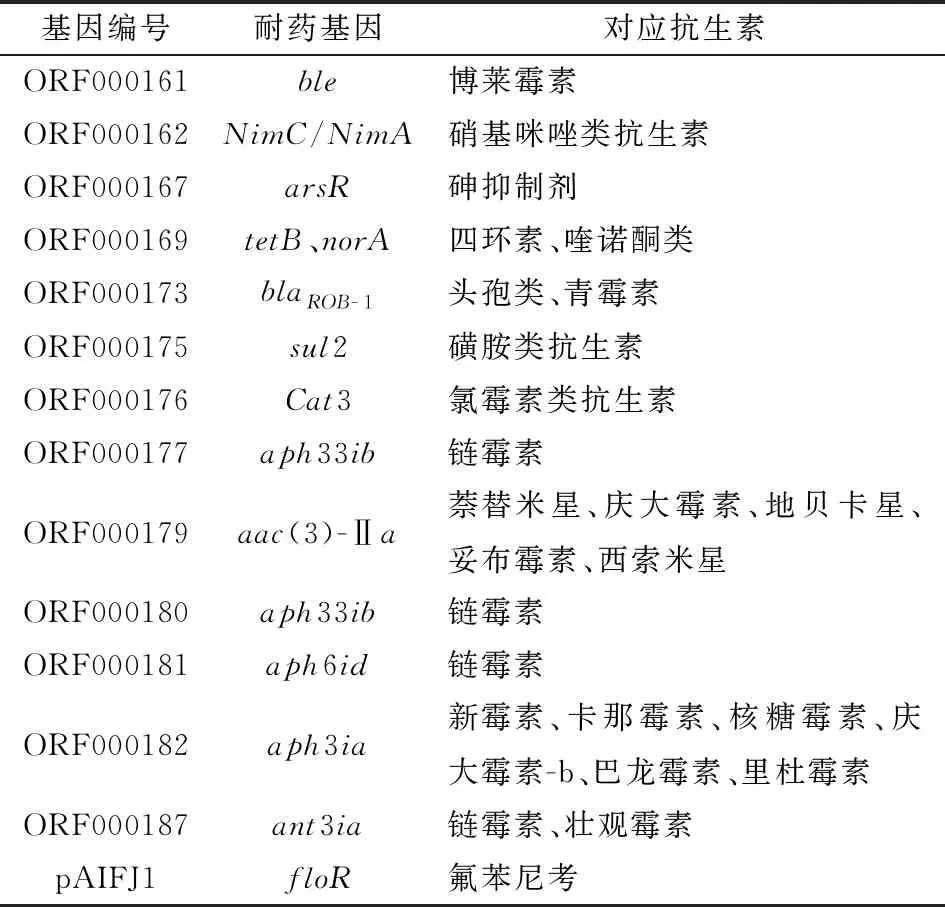
表3 吲哚放线杆菌AIFJ1607株的抗生素耐药基因、 相对应的基因编号及抗生素
同时,通过与GenBank中的插入序列(IS)进行同源性分析,发现在该耐药基因岛中有多种插入序列,分别为IS6、IS10、IS30、ISApl1和ISAbal4(图6)。

图6 吲哚放线杆菌AIFJ1607株的耐药基因岛
2.5 细菌质粒全基因序列分析通过提取该细菌质粒,获得了2种质粒,分别命名为pAIFJ1和pAIFJ2,全基因组序列分析结果显示质粒pAIFJ1的基因组全长为5 087 bp,包括floR、lysR和repB基因(图7);质粒pAIFJ2的基因组全长为2 626 bp,包括repB基因和2个假定蛋白基因。PCR结果表明可从质粒pAIFJ1中扩增出floR基因的目的片段(图8)。同源性分析结果显示质粒pAIFJ1与副猪嗜血杆菌中分离得到的质粒pHPSGC具有很高的同源性(图9)。
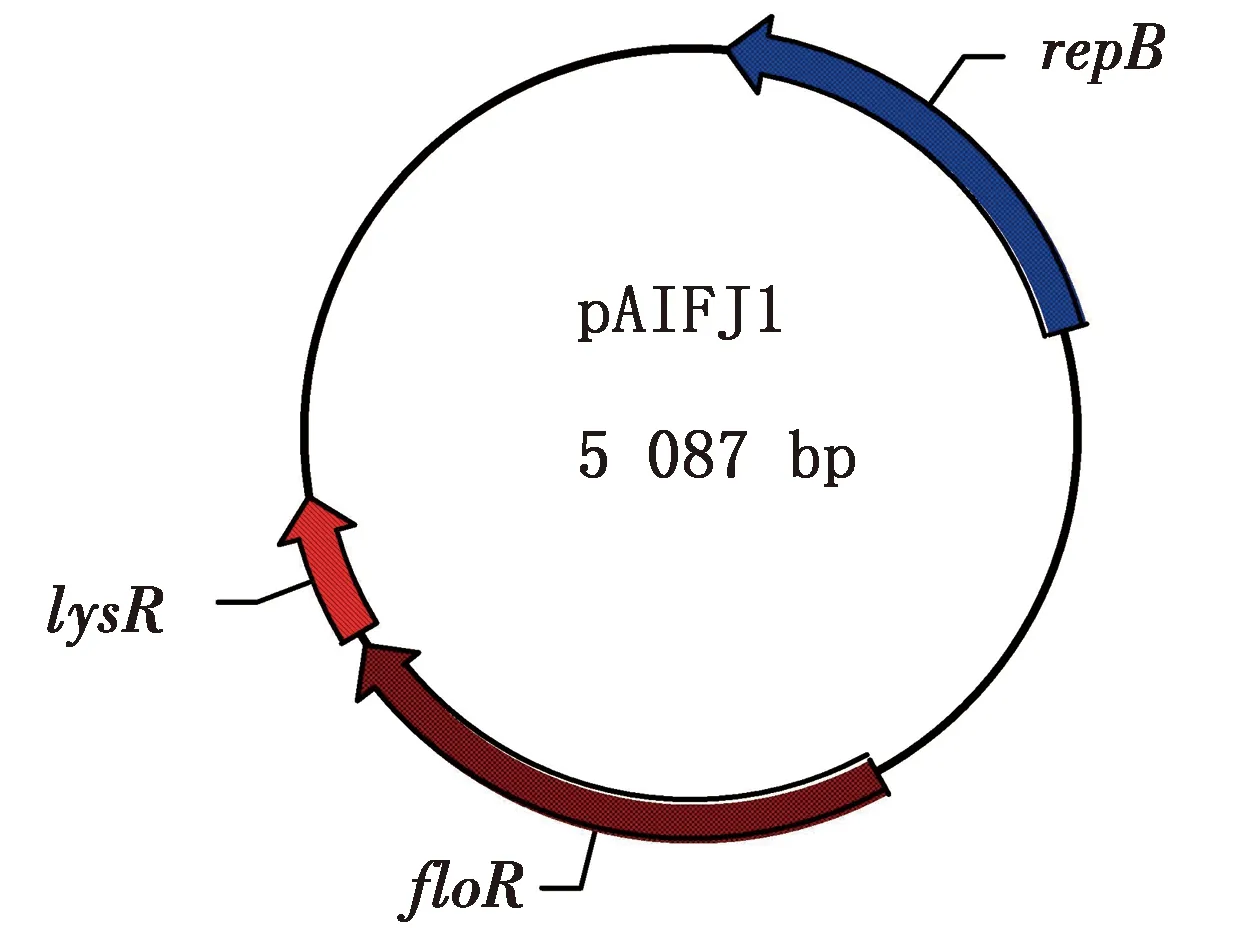
图7 质粒pAIFJ1圈图

M.DL2000 DNA Marker;1~2.floR基因
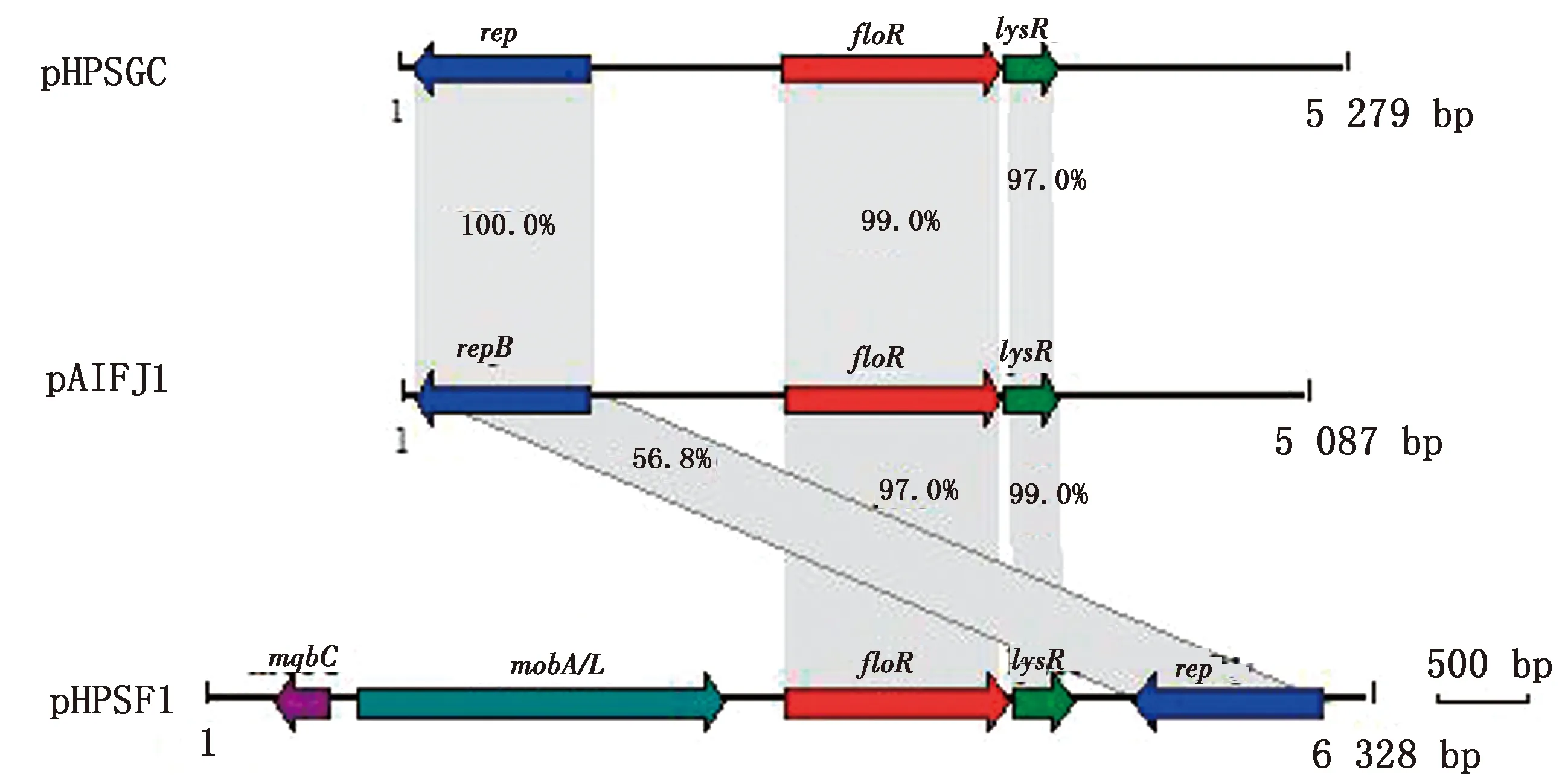
图9 3种质粒pHPSGC、pAIFJ1和pHPSF1的同源性比较图
2.6 基因序列的登录号吲哚放线杆菌16S rRNA的基因序列登录号为MF179617.1,吲哚放线杆菌全基因组序列登录号为CP038145.1,质粒pAIFJ1的全基因组序列登录号为MF678833.1。
3 讨论
该分离菌株AIFJ1607与GenBank中登录的吲哚放线杆菌16S rRNA基因序列的同源性高达99%,生化鉴定的结果显示该细菌生长需要NAD或X因子的参与,过氧化氢酶和吲哚为阳性,尿素酶和cAMP试验为阴性,是一种不溶血的细菌,这些结果与吲哚放线杆菌的16S rRNA、生化鉴定结果一致[2-4]。因此,该分离菌株AIFJ1607被鉴定为吲哚放线杆菌。
通过细菌基因组耐药基因分析发现1个耐药基因岛,包含有氨基糖苷类抗生素耐药基因5种、博来霉素耐药基因1种、四环素类耐药基因1种、喹诺酮类抗生素耐药基因1种、头孢类抗生素耐药基因1种、磺胺类抗生素耐药基因1种、氯霉素类抗生素耐药基因1种、硝基咪唑类抗生素耐药基因1种和砷抑制剂基因1种等9种耐药基因。这些与该菌株的药敏试验和MIC试验的结果一致。这进一步表明吲哚放线杆菌AIFJ1607株是1种多重耐药菌株。值得注意的是,硝基咪唑类耐药基因NimC/NimA是首次发现在巴氏杆菌科细菌的基因组中的,以前的研究表明NimC/NimA基因被发现存在于沙门氏菌[21]、大肠杆菌[22]和抗辐射菌[23]中。砷抑制剂基因arsR是一种砷耐药的调节基因[24],也被发现在吲哚放线杆菌AIFJ1607株中。
插入序列(IS)是最简单的转座元件,由两端的反向重复序列和中间的转座酶编码序列组成。插入序列广泛存在于细菌的基因组和质粒中并存在不同数量的拷贝,以相同或不同的转座机制在基因组内或基因组之间进行水平移动,也可作为其他移动因子如噬菌体和质粒的一部分进行转移。而在吲哚放线杆菌AIFJ1607株的耐药基因岛内就存在多种插入序列,包括IS6、IS10、IS30、ISApl1和ISAbal4。据报道,插入序列ISApl1也被发现存在于胸膜肺炎放线杆菌[25-26]和大肠杆菌[27-29]的基因组中。出乎意料地是吲哚放线杆菌AIFJ1607株的耐药基因岛中存在3种插入序列ISApl1,分别为S1、S2和S3。其中插入序列S1中第486位的胞嘧啶变异为胸腺嘧啶,但所对应的氨基酸未发生改变。插入序列S2中有20个核苷酸发生了变异,所对应的氨基酸分别由第7位的甘氨酸变为丝氨酸、第65位的天冬酰胺变为组氨酸、第89位的赖氨酸变为谷氨酰胺、第91位的谷氨酸变为天冬酰胺、第279位的异亮氨酸变为缬氨酸。插入序列S3缺失了98个核苷酸。插入序列ISApl1包含2个阅读框,分别为ORF1和ORF2,ORF1由307个氨基酸残基组成,这与插入序列IS30相似,同时含有保守的DDE区域[30]。ORF2是一种假定的转录转座,可以抑制转座酶mRNA的翻译[30]。当然,吲哚放线杆菌AIFJ1607株的耐药基因岛不仅包含有多种插入序列,也同时含有移动元件mobA。
来自吲哚放线杆菌AIFJ1607株的质粒pAIFJ1含有3个编码蛋白基因,分别为floR、lysR和repB基因。与来自副猪嗜血杆菌的质粒pHPSGC(登录号:KX966395)和质粒pHPSF1(登录号:KR262062)进行同源性比对,发现质粒pAIFJ1和质粒pHPSGC具有很高的同源性。另外,吲哚放线杆菌和副猪嗜血杆菌同属巴氏杆菌科的成员,生长都需要NAD的参与[5]。因此,这表明质粒pAIFJ1有可能在副猪嗜血杆菌和吲哚放线杆菌之间进行水平转移,有待进一步研究。
