双酶显色-紫外-可见分光光度法测定牛奶中组胺与腐胺的含量
2022-01-19姚晓曈刘振民喻东威
姚晓曈 ,徐 斐 ,叶 泰 ,袁 敏* ,刘振民 ,喻东威
(1.上海理工大学 医疗器械与食品学院 上海食品快速检测工程技术研究中心,上海 200093;2.光明乳业股份有限公司乳业研究院,上海 200436;3.内蒙古蒙牛乳业集团股份有限公司,呼和浩特 011500)
生物胺是一类具有生物活性并且相对分子质量小的含氮有机碱,由氨基酸在脱羧酶或氨基转移酶的催化作用下形成[1-2]。根据生物胺的组成,可将其分为单胺(如酪胺)、二胺(如组胺、腐胺等)和多胺(如精胺)。其中,组胺和腐胺常存在于发酵食品和水产品中[3-4]。摄入高浓度的组胺会引起眼结膜充血、头昏、恶心、胸闷等中毒症状,甚至会致人死亡;腐胺对眼睛、皮肤、消化道、呼吸道等有强烈的刺激作用[5]。由于生物胺的多样性和其对人体作用的复杂性,国际上还没有较为全面的生物胺膳食摄入评估数据。由于组胺的毒性强、分布广,目前多数国家对食品中组胺含量进行了规定,如欧盟要求水产品中的组胺质量分数不得超过100 mg·kg-1。但是,国际上尚未对乳制品中的生物胺提出限量要求。根据报道,乳制品中组胺质量分数为0.6~2.1 g·kg-1,腐胺质量分数为2.5 g·kg-1[6],因此有必要对乳制品中组胺和腐胺的含量进行监测。
目前,测定生物胺的方法主要有高效液相色谱法[7]、气相色谱法[8]、毛细管电泳法[9]、离子色谱法[10]等。这些方法精密度高、重复性好,但是存在以下问题:①需用到大型仪器、多种有机试剂,且操作复杂,专业要求高;②前处理时间较长,不利于现场检测;③成本较高,难以大范围使用。利用二胺氧化酶(DMO)对二胺类生物胺的催化反应测定其含量已有文献报道。文献[11]利用DMO 与磁珠结合的电化学方法测定组胺、尸胺的含量;文献[12]以DMO 为生物识别元件,以微流控芯片和化学发光分析仪为传感元件,以鲁米诺-铁氰化物为化学发光体系,采用生物酶传感器法测定腐胺、组胺的含量。
DMO 可与二胺类生物胺发生催化反应,生成的过氧化氢能够与辣根过氧化物酶(HRP)反应产生羟自由基使显色剂四甲基联苯胺(TMB)变为ox TMB(TMB的氧化态),溶液由无色变为蓝色,加入盐酸终止反应,溶液由蓝色变为黄色。利用上述DMO 和HRP的级联催化原理,本工作建立了基于DMO-HRP双酶显色的紫外-可见分光光度法快速测定牛奶中组胺和腐胺含量的方法。
1 试验部分
1.1 仪器与试剂
TU-1901型紫外-可见分光光度计;QL-866 型旋涡混合器;WT100-3型恒温水浴锅。
磷酸盐缓冲溶液(pH 7.4):0.2 mol·L-1,称取二水合磷酸二氢钠31.202 g,用水溶解并定容至1 L,获得A 液;称取磷酸氢二钠28.392 g,用水溶解并定容至1 L,获得B液。将A 液与B液按照体积比19∶81混合均匀,得到浓度为0.2 mol·L-1的磷酸盐缓冲溶液(pH 7.4)。
组胺标准储备溶液:10 mmol·L-1,称取组胺11.115 mg,用磷酸盐缓冲溶液(pH 7.4)溶解并定容至10 mL,配制成浓度为10 mmol·L-1的组胺标准储备溶液。使用时,用磷酸盐缓冲溶液(pH 7.4)稀释至所需浓度。
腐胺标准储备溶液:10 mmol·L-1,称取腐胺8.815 mg,用磷酸盐缓冲溶液(pH 7.4)溶解并定容至10 mL,配制成浓度为10 mmol·L-1的腐胺标准储备溶液。使用时,用磷酸盐缓冲溶液(pH 7.4)稀释至所需浓度。
DMO标准溶液:1.0 g·L-1,称取DMO 0.005 g,用磷酸盐缓冲溶液(pH 7.4)溶解并定容至5 mL,配制成质量浓度为1.0 g·L-1的DMO 标准溶液。同法制备1.0 g·L-1HRP标准溶液。
TMB标准溶液:0.5 g·L-1,称取TMB 1 mg,用0.2 mL二甲基亚砜(DMSO)溶解,再加入1.8 mL水混匀,配制成质量浓度为0.5 g·L-1的TMB标准溶液。
所用试剂均为分析纯;试验用水为超纯水。牛奶购自某超市。
1.2 仪器工作条件
扫描范围400~600 nm;检测波长450 nm。
1.3 试验方法
移取10 mL牛奶,加入10 mL 2%(质量分数)硝酸铅标准溶液,搅拌均匀,得到硝酸铅质量分数为1%的阳性牛奶样品;再加入20 mL 0.1%(质量分数)三氯乙酸标准溶液,混合均匀,以转速7 500 r·s-1离心5 min,取上清液,用2 mol·L-1氢氧化钠溶液调节溶液pH 至7.2,得到待测样品溶液。
移取1.0 g·L-1DMO 标准溶液100μL,加入100μL待测样品溶液,于50℃水浴中反应15 min。反应结束后,取出,依次加入1.0 g·L-1HRP标准溶液50μL,0.5 g·L-1TMB 标准溶液200μL 和2 mol·L-1盐酸溶液50μL,观察溶液颜色变化,按照仪器工作条件测定体系的吸光度。
2 结果与讨论
2.1 紫外-可见吸收光谱图
按照试验方法对0.2 mol·L-1磷酸盐缓冲溶液(pH 7.4)、50 μmol·L-1组胺标准溶液和50μmol·L-1腐胺标准溶液分别进行测定,结果见图1。
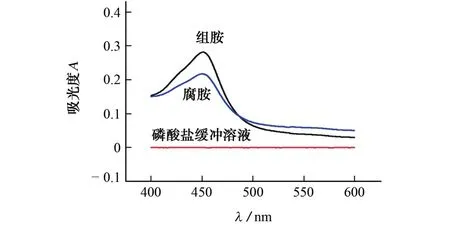
图1 紫外-可见吸收光谱图Fig.1 UV-Vis absorption spectrum
结果表明:仅磷酸盐缓冲溶液(pH 7.4)存在的情况下,体系在可见光区未出现吸收峰;当加入50μmol·L-1组胺或腐胺标准溶液后,体系在450 nm 处出现一个明显的吸收峰,并且在试验过程中,体系颜色发生了由无色到蓝色再到黄色的变化。据此,可建立基于DMO-HRP 双酶显色的紫外-可见分光光度法测定组胺和腐胺含量的方法。
2.2 反应温度的优化
由于组胺和腐胺具有相同的反应原理,因此本工作以组胺为研究对象进行条件优化。试验考察了反应温度分别为25,30,40,50,60,70,80,90℃时对体系吸光度的影响,结果见图2。
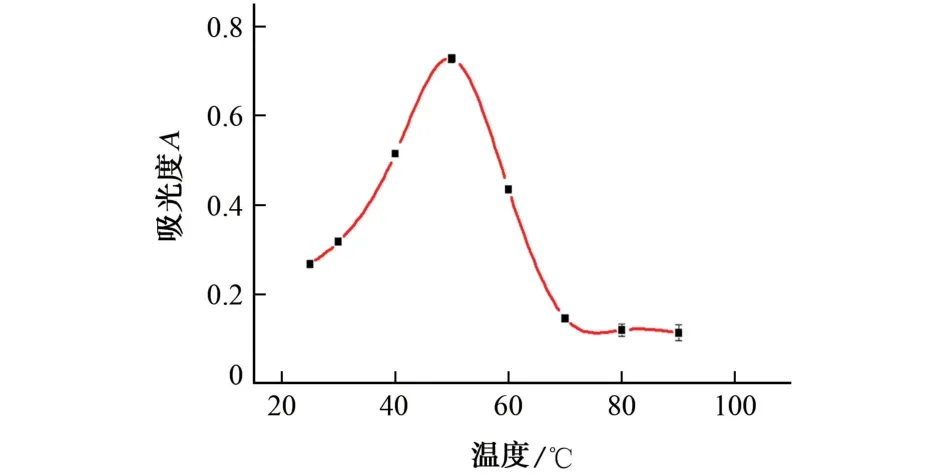
图2 反应温度对体系吸光度的影响Fig.2 Effect of reaction temperature on absorbance of system
结果显示:随着反应温度的升高,体系的吸光度呈先增大后减小的趋势;当反应温度为50 ℃时,体系的吸光度较大。这是由于反应前期,随着温度的升高,DMO 的活性逐渐增强;当反应温度过高时,DMO 的活性降低,催化反应被抑制,导致体系的吸光度减小。因此,试验选择的反应温度为50 ℃。
2.3 反应时间的优化
试验考察了反应时间分别为5,10,15,20,25,35,45,55 min时对体系吸光度的影响,结果见图3。
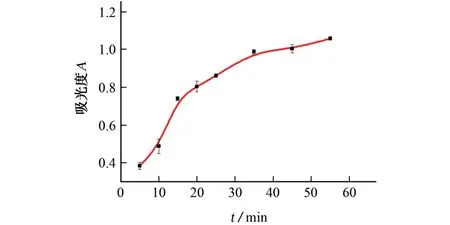
图3 反应时间对体系吸光度的影响Fig.3 Effect of reaction time on absorbance of system
结果显示:随着反应时间的延长,体系的吸光度逐渐增大;当反应时间为5~15 min时,体系的吸光度增大速率较快,这是由于DMO 与组胺在5~15 min内反应较为迅速;继续延长反应时间,体系的吸光度逐渐达到平稳。为了满足快速分析的需要,试验选择的反应时间为15 min。
2.4 TMB质量浓度的优化
试验考察了TMB 质量浓度分别为0.2,0.5,0.8,1.0,1.5,2.0 g·L-1时对体系吸光度的影响,结果见图4。
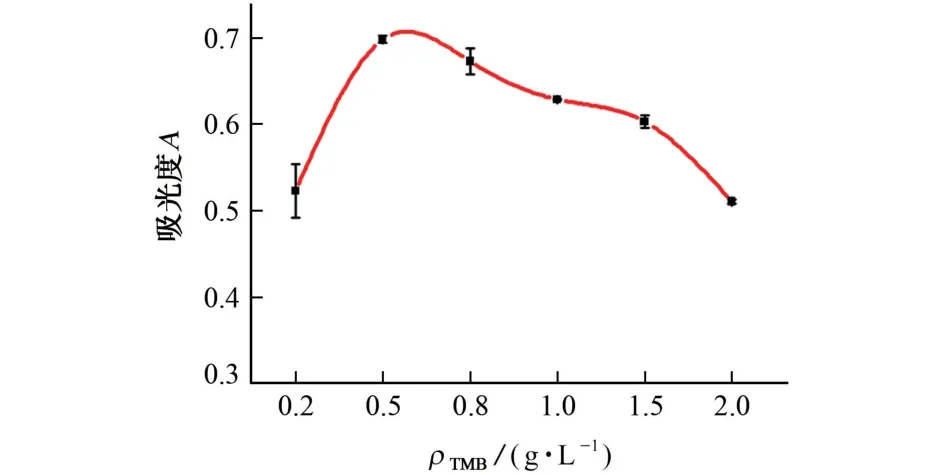
图4 TMB质量浓度对体系吸光度的影响Fig.4 Effect of mass concentration of TMB on absorbance of system
结果显示,随着TMB质量浓度的增加,体系的吸光度呈先增大后减小的趋势。造成这种现象的原因可能是TMB标准溶液中含有一定量的DMSO,DMSO 会导致DMO 失活,随着TMB 质量浓度的增加,DMSO 的浓度也随之上升,进而导致体系的吸光度减小。因此,试验选择的TMB 质量浓度为0.5 g·L-1。
2.5 选择性试验
由于牛奶中含有丰富的氨基酸,并且氨基酸的分子结构与生物胺非常相似,组氨酸和精氨酸通过脱羧作用和转氨基作用可形成组胺和腐胺,因此DMO 对组胺和腐胺的选择性十分重要。分别以200μmol·L-1的精氨酸、赖氨酸、组氨酸、色氨酸、酪氨酸溶液为研究对象,考察了上述氨基酸在DMO 作用下,体系在450 nm 处吸光度的变化,结果见图5。
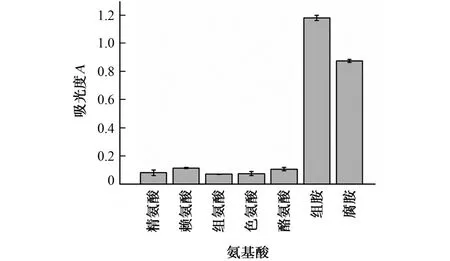
图5 DMO 与不同氨基酸反应后的体系吸光度Fig.5 Absorbance of system after reaction between DMO and different amino acids
结果显示,精氨酸、赖氨酸、组氨酸、色氨酸、酪氨酸与DMO 反应后,体系的吸光度很小,而组胺或腐胺与DMO 反应后,体系的吸光度明显增大,说明DMO 对组胺和腐胺具有较高的选择性。
2.6 标准曲线和检出限
移取适量的10 mmol·L-1组胺或腐胺标准溶液,用磷酸盐缓冲溶液(pH 7.4)逐级稀释,配制成组胺浓度为0,2.5,10,20,30,40,50,70,90,100,120,150,200,250,300,400μmol·L-1,腐胺浓度为0,5,10,20,30,40,50,70,90,100,120,140,150,170,200,250,300,350,400μmol·L-1的标准溶液系列,按照试验方法对上述标准溶液系列进行测定。以组胺或腐胺的浓度为横坐标,其对应的吸光度为纵坐标绘制标准曲线,线性参数见表1。
以3倍信噪比(S/N)计算检出限(3S/N),结果见表1。

表1 线性参数和检出限Tab.1 Linearity parameters and detection limits
2.7 精密度和回收试验
按照试验方法对空白牛奶样品进行低、中、高等3个浓度水平的加标回收试验,计算回收率和测定值的相对标准偏差(RSD),结果见表2。
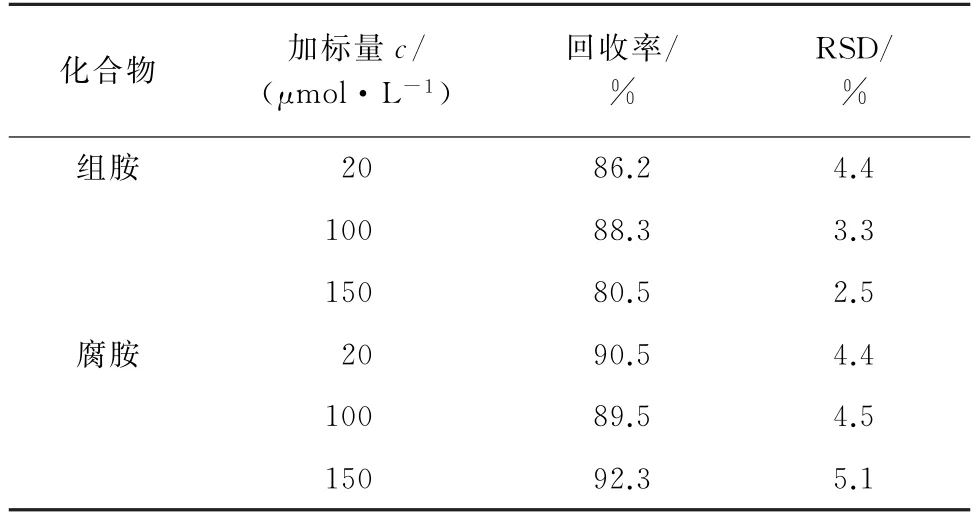
表2 精密度和回收试验结果(n=5)Tab.2 Results of tests for precision and recovery(n=5)
由表2可知:组胺的回收率为80.5%~88.3%,测定值的RSD 为2.5%~4.4%;腐胺的回收率为89.5%~92.3%,测定值的RSD 为4.4%~5.1%。
2.8 方法比对
将本法与文献报道的其他方法进行比对,结果见表3。
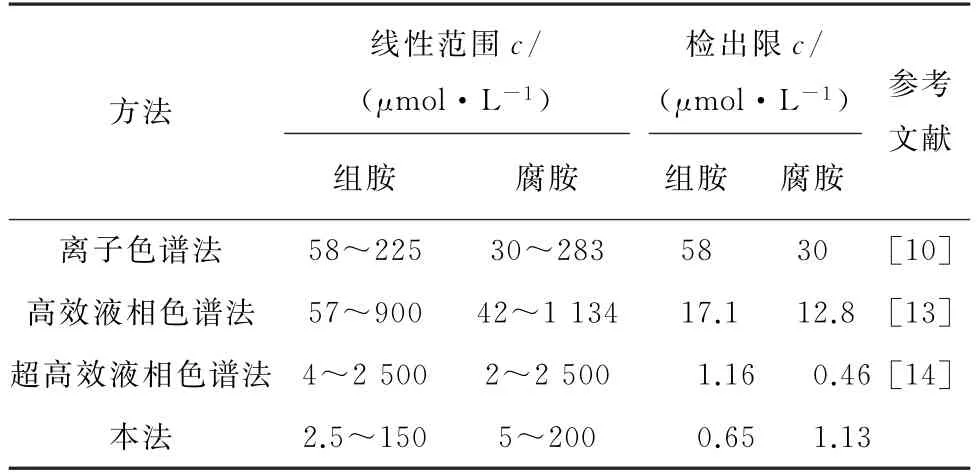
表3 不同方法比对结果Tab.3 Comparison of results by different methods
结果显示,与其他方法比对,本法灵敏度高,组胺和腐胺的检出限较低,且不需要使用大型仪器。
本工作建立了基于DMO-HRP 双酶显色的紫外-可见分光光度法测定牛奶中组胺和腐胺含量的方法,该方法无需对生物胺样品进行衍生,分析快速、操作简单,结果准确度好,精密度高,为乳制品等发酵产品中组胺和腐胺的测定提供了参考。
