通过硅氧烷凝胶吸附剂的羧化改性高效去除铁(Ⅲ)
2022-01-19*冯晨
*冯 晨
(中国工程物理研究院激光聚变研究中心 四川 621000)
随着现代工业的不断发展,水污染问题愈发严重。铁离子作为最常见的重金属离子之一引起人们广泛关注。通常,岩石和土壤会产生少量的铁离子溶解于地下水中,但是在某些电镀生产工艺、有色金属加工酸洗过程和矿山排水中产生大量同时含铁和其他重金属的废水。
铁离子主要的影响有以下几个方面:首先,生活中,铁离子使饮用水有颜色、气味且十分浑浊,并会弄脏衣物及洗涤设备。此外,三价铁在人体内是不能正常代谢的,摄入过多三价铁会导致高铁血红蛋白血症。还可能出现慢性中毒症状[1]。最后,在工业生产中,含铁废水容易阻塞管道和加速腐蚀,并且工业废水的直接排放会导致水体中的溶解氧迅速降低,呈赤橙色且浑浊,对环境造成严重污染[2]。
如何有效处理工业废水中铁离子,来保护环境和人类的健康已经发展成为一个全球性的问题,人们急需寻找到一种简单高效且经济的治理方法。从工业废水中去除铁离子的现有方法包括化学沉淀法、离子交换法、膜分离法、电化学法、吸附法等[3]。吸附法具有成本低、高效经济、不造成二次污染等优点,因此受到广泛关注。
近来,研究人员制备了许多吸附剂除去污水中的铁离子。活性炭是一种经济、孔隙率高、比表面积大的优异吸附剂,用其吸附废水中重金属离子在国内外已有大量研究。然而,高昂的再生成本限制了其应用。另外,许多吸附材料,例如氧化石墨烯,天然石英和膨润土,纳米纤维膜,氧化锰纳米复合材料,固定化藻类海藻已用于去除Fe3+离子。尽管如此,它们的吸附能力对Fe3+离子来说比较差。通过向吸附剂中加入-COOH、-OH,对过渡金属离子具有出色的吸附性能。许多研究人员研究制备了包含羧基的交联聚合物,例如交联聚丙烯酰胺,聚丙烯酸-共丙烯酰胺,聚(N-乙烯基咪唑),聚(丙烯酰胺-马来酸),聚(苯乙烯磺酸-马来酸共聚)和其他合成的聚合物。
在过去的几十年中,二氧化硅凝胶由于高孔隙率,出色的隔热性和巨大的比表面积等独特特性受到了极大的关注。在各种凝胶中,对二氧化硅凝胶的研究最为广泛。二氧化硅凝胶已广泛应用于热/声绝缘体、航空航天,吸附传感器、催化工程等。但是,较差的机械性能,较高的生产成本以及传统的二氧化硅气凝胶的局限性限制了它们的进一步应用。
在这项研究中,通过甲基丙烯酸来修饰硅氧烷制备凝胶。研究了甲基丙烯酸与硅氧烷质量比、制备温度、时间等对凝胶吸附性能的影响。由于活性基团羧基的存在,凝胶可以充当生物吸附剂来吸附Fe3+离子。通过分批次吸附实验研究了pH,吸附时间,初始Fe3+浓度和吸附温度等因素的影响。此外,系统地研究了改性二氧化硅凝胶吸附过程的动力学、等温线和热力学。
1.实验部分
(1)材料
乙烯基三乙氧硅烷,甲基丙烯酸,过硫酸铵购自阿拉丁,氯化铁购自Sigma-Aldrich。所有水溶液均用去离子水制备。
(2)凝胶的制备
通过自由基聚合制备凝胶。首先,将3.8g乙烯基三乙氧硅烷溶解在20mL水中,然后在室温下搅拌12h,以获得硅氧烷溶液。使用10mL玻璃瓶制备水凝胶。通过改变硅氧烷和甲基丙烯酸的质量比,研究硅氧烷和甲基丙烯酸之间的相对比例对凝胶性能的影响。每种水凝胶制备三个重复样品。水凝胶的组成在表1中给出。例如,VC-1-2编号的样品是将0.1g乙烯基三乙氧硅烷与0.2g甲基丙烯酸混合制备的。将甲基丙烯酸加入到含有烯基三乙氧基硅烷成分的溶液中,加入去离子水稀释至5ml,超声均匀分散后加入0.01g过硫酸铵。将玻璃瓶密封并在70℃水浴反应12h。最后通过破坏小瓶从玻璃瓶中取出形成的水凝胶。用去离子水置换未反应组分3d,每隔12h更换一次去离子水。冷冻干燥制得气凝胶。

表1 具体配比方案Tab.1 Specific Proportioning Scheme
(3)材料表征
使用ZEISS sigma 500扫描电子显微镜(SEM,德国)观察凝胶的形态和微观结构。使用KBr颗粒在Nicolet IS5光谱仪(FTIR,美国)上记录傅立叶变换红外光谱。凝胶的比表面积通过Micromeritics ASAP2020比表面积和孔隙率分析仪(BET,美国)测量。凝胶的热稳定性通过使用Labsys evo热重分析仪(TGA,德国)进行分析。在所有吸附实验中,Fe3+离子的浓度均通过Agilent 720电感耦合等离子体原子发射光谱仪(ICP,美国)进行测量。
(4)分批吸附试验
系统地进行了分批吸附实验,以评估改性二氧化硅凝胶对Fe3+离子的吸附能力,记录不同pH值、温度、吸附时间和初始浓度对吸附的影响。将凝胶加入到Fe3+离子溶液(10mL)中,然后充分混合并在摇床中震荡。在pH研究中,Fe3+的浓度为150mg/L,用1M HCl和1M NaOH溶液将Fe3+溶液的pH值调节至所需范围。在吸附动力学实验中,Fe3+溶液的浓度范围为50mg/L至200mg/L。为了进行吸附热力学研究,在Fe3+离子浓度为150mg/L的情况下,调节温度范围到308K至328K。
通过ICP测量吸附前后的Fe3+离子浓度,计算出金属离子的吸附量。吸附量的计算公式如下:
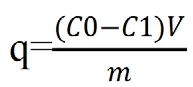
其中,C0和C1分别是Fe3+离子吸附前的初始浓度和吸附后的离子浓度(mg/L);V是Fe3+溶液的体积(mL);m是凝胶的重量(g)。并使用线性回归分析验证吸附结果。
2.结论和分析
(1)凝胶制备条件的选择
为了获得优异的凝胶,分别研究了反应温度,甲基丙烯酸和的质量比,反应时间对凝胶制备的影响。分别在60℃、70℃、80℃和90℃下制备凝胶,结果表明,在70℃下制备的凝胶性能最好。为了探究甲基丙烯酸与乙烯基三乙氧硅烷质量比对凝胶的影响,分别为2:1、3:1、4:1、5:1和6:1。如图所示,当质量比为5:1时,凝胶的比表面积最大。所以后面的吸附性能测试,选择甲基丙烯酸与乙烯基三乙氧硅烷质量比为5:1。还研究了反应时间对凝胶制备的影响。1h后凝胶均形成,所以选择反应12h来使凝胶完全反应。因此,实验采用凝胶都是在上述条件下制备的。
(2)改性二氧化硅凝胶表征
将改性二氧化硅凝胶冷冻干燥,得到多孔干凝胶。块状结构可用于分离和重复使用。多孔吸附剂中的官能团可以完全暴露于金属离子。在红外光谱中,改性二氧化硅凝胶含有特征性的官能团,位于1720cm-1处的羰基。
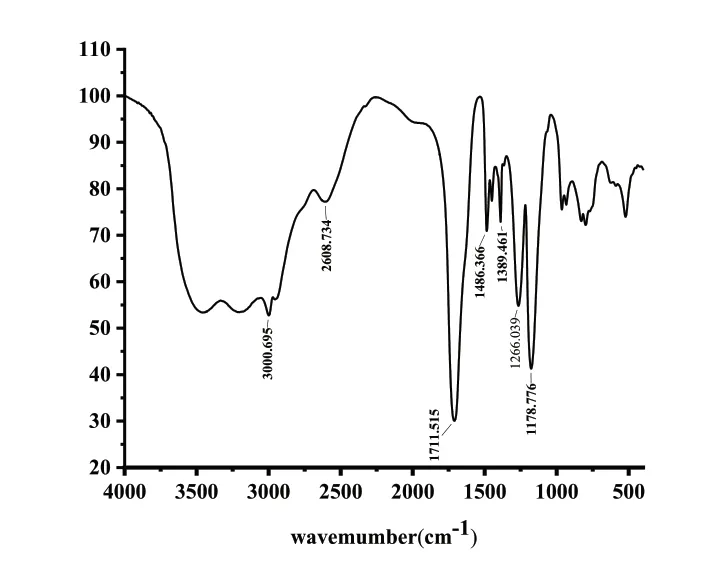
图1 凝胶的红外光谱图Fig.1 The infrared spectrum of the gel
改性二氧化硅凝胶由于具有超分子结构,因此在水中具有出色的稳定性。通过对二氧化硅凝胶的比表面积进行测量并对凝胶进行观察,当甲基丙烯酸与乙烯基三乙氧硅烷质量比为5:1时,凝胶具有较好的微观结构和高孔隙率,金属离子容易从溶液扩散到凝胶中。

图2 凝胶的比表面积Fig.2 The specific surface area of the gel
TGA结果表明,改性二氧化硅凝胶在450℃以上发生热降解,具有良好的热稳定性。

图3 改性硅氧烷凝胶的热重Fig.3 Thermogravimetry of modified silicone gel
(3)铁离子的吸附
①pH值的影响
溶液的pH值会影响凝胶的表面性质,被吸附的铁离子受溶液pH值的影响。在这项研究中,确定了pH值对pH范围为2.0-6.0的溶液吸附过程的影响,选择Fe3+的初始浓度为150mg/L,吸附时间为2h,吸附温度为35℃。使用NaOH和HCl(1M)调节初始pH值。吸附完成后,测试Fe3+浓度。如图所示,pH在2-5范围内,Fe3+吸收量呈上升趋势,Fe3+与吸附剂之间的吸附主要受离子吸引的影响,碱性较低时,氢离子与铁竞争吸附从而降低了铁离子的吸附。在较高的pH值下,吸附逐渐达到饱和。
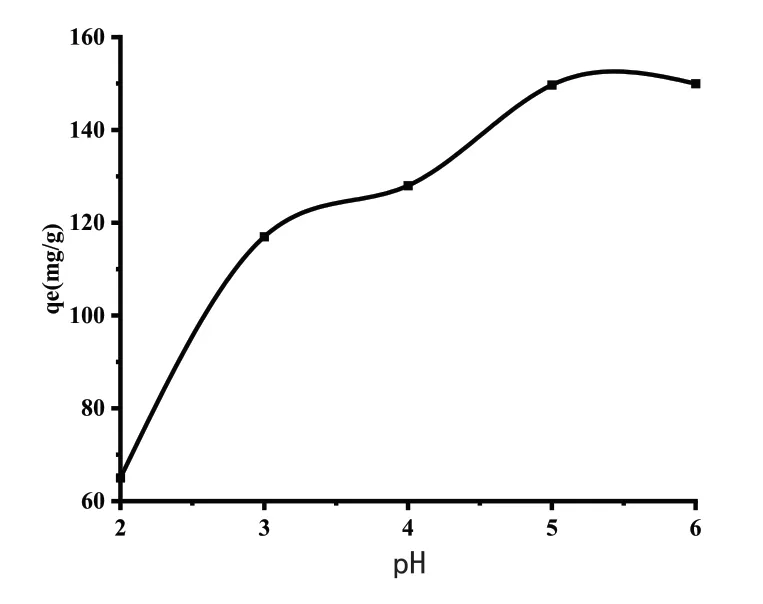
图4 pH对吸附的影响Fig.4 The influence of pH on adsorption
②吸附时间的影响
图5显示了接触时间对吸附容量的影响。在最初的2h内,吸附能力随接触时间而迅速增加,2h后随着接触时间增加吸附量略有变化,达到平衡。这是由于大量的羧基为Fe3+提供了额外的亲和力和更多的可用结合位点,从而加速了Fe3+的吸收。因此,研究中的接触时间保持在120min。

图5 时间对吸附的影响Fig.5 The effect of time on adsorption
③铁离子初始浓度对吸附的影响
吸附受初始Fe3+浓度的影响。如图所示,当Fe3+的初始浓度在50-200mg/L范围内变化时,Fe3+的吸附容量增加,表明凝胶表现出优异的吸附性能。Fe3+的初始浓度提供了必要的驱动力,以减少扩散和界面阻力。此外,吸附过程包括首先将被吸附物分子从本体溶液传输到吸附剂的外表面,然后再从外表面传输到吸附剂的孔。因此,凝胶和Fe3+之间的相互作用可以通过增加Fe3+的初始浓度来增强,从而导致Fe3+的吸附容量增加。结果表明,Fe3+的量不足以占据凝胶的活性结合位点,因此吸附是不饱和的。

图6 初始浓度对吸附的影响Fig.6 The effect of initial concentration on adsorption
④温度的影响
在Fe3+浓度在150mg/L的条件下,研究了温度对吸附容量的影响。图7表明,在308K-318K的增加范围内,吸附容量明显增加,表明较高温度有利于吸附。对改性二氧化硅凝胶上Fe3+离子的吸附,这可能是因为物理吸附主要发生在室温下,导致一定量的吸附。随着温度升高,化学吸附占主导地位,这可能会增加动能以及改性二氧化硅和Fe3+离子活性位之间的相互作用。此外,在较高温度下吸附能力略有下降可能是由于化学吸附过程放热,熵降低。因此,吸附能力随温度升高而降低。

图7 温度对吸附的影响Fig.7 The effect of temperature on adsorption
⑤吸附等温线
吸附等温线可以描述Fe3+与硅氧烷凝胶之间的相互作用。通过Langmuir和Freundlich模型分别分析了改性二氧化硅凝胶和Fe3+在平衡状态下的吸附机理和关系。Langmuir吸附等温线假定吸附发生在结构均质的单层结构上。Langmuir等温方程为:

其中,qe和qm分别是单层的平衡和最大吸附容量,mg/g;Ce是Fe3+离子和b的平衡浓度是与吸附自由能有关的Langmuir吸附常数,L/mg。

Freundlich等温线描述了异质表面的多层吸附。Freundlich模型可以表示为线性:
其中,kf[mg/g(L/mg)1/n]和n是Freundlich等温线常数,描述了多层吸附容量和强度。
根据曲线的斜率和截距计算等温线常数和相关系数,根据相关系数可以得出结论:Freundlich模型比Langmuir模型更适合描述吸附。此外,最大吸附容量(qm)随着温度的升高而增加,表明较高的温度有利于Fe3+在改性二氧化硅上的吸附,并且吸附过程是吸热的。Freundlich模型的n值都超过1,表明改性二氧化硅有利于Fe3+离子的吸附。
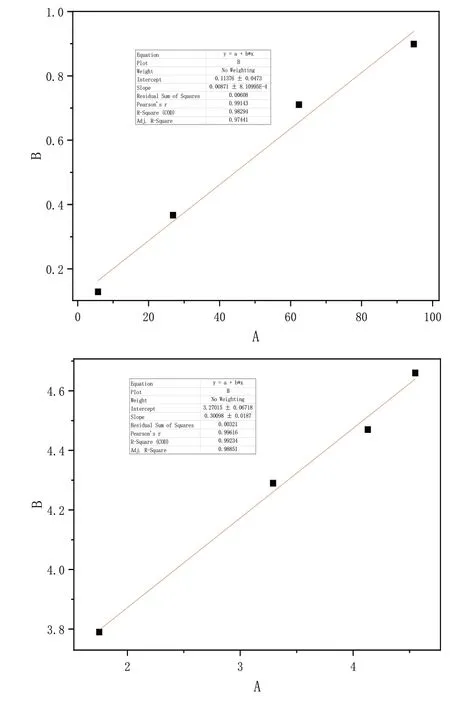
图8 凝胶的吸附等温线Fig.8 Adsorption isotherm of gel
⑥吸附热力学
吸附过程的可行性和自发性可以通过热力学参数反映出来。可以使用以下公式计算吸附过程的热力学参数,例如吉布斯自由能(ΔG0),焓(ΔH0)和熵变(ΔS0):
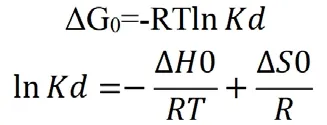
其中,R是通用气体常数(8.314);T是温度(K);K是热力学平衡常数。从拟合线性曲线获得ΔH0和ΔS0的值,并根据等式计算ΔG0的值。ΔG0的负值随温度升高而降低,表明吸附是一个自发过程,而较高的温度更有利于吸附。焓值(ΔH0)为正,表明吸附是吸热过程。放热吸附过程通常是物理吸附或化学吸附,而吸热过程是化学吸附。因此,ΔH0的正值进一步证明,Fe3+的吸附主要是化学吸附而不是物理吸附。ΔS0的正值表明改性二氧化硅凝胶对Fe3+有良好的亲和力。
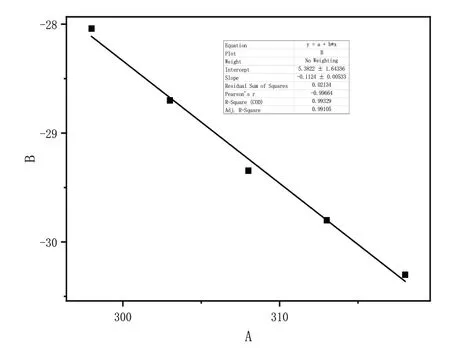
图9 凝胶吸附热力学Fig.9 Gel adsorption thermodynamics
3.结论
在本研究中,通过甲基丙烯与乙烯基三乙氧硅烷反应制备一种新型凝胶。单因素实验用于研究和确定改性反应和吸附铁离子的最佳条件。由于改性二氧化硅凝胶中Fe(III)离子与羧基之间的配位相互作用,改性二氧化硅凝胶对Fe(III)具有良好的吸附性能。
