液体衰减反转恢复序列脑干白质高信号评估前循环急性缺血性卒中的预后
2022-01-15班然然袁涛赵玉婵高珍许蕾全冠民
班然然,袁涛,赵玉婵,高珍,许蕾,全冠民*
1.河北医科大学第二医院影像科,河北 石家庄 050000;2.河北医科大学第二医院神经内科,河北 石家庄 050000;*通信作者 全冠民 quanguanmin@163.com
前循环急性缺血性卒中(acute ischemic stroke,AIS)约占AIS的80%[1],致残率及致死率高,早期评估预后对于选择治疗方案具有参考价值。除侧支循环、缺血半暗带、梗死核心体积、梗死部位等影像学指标影响前循环AIS神经功能预后外,液体反转恢复序列(fluid attenuated inversion recovery,FLAIR)白质高信号(white matter hyperintensity,WMH)也影响预后[2]。WMH可能与梗死体积增大、出血转化、临床预后不良以及脑梗死复发有关[3-5]。然而,早期WMH无症状,依赖影像学检出。
功能MRI有助于显示WMH区域血流灌注及纤维束异常[6-8],MRI形态成像仍是其基本评价方法,FLAIR可提供WMH部位、体积和严重程度等信息。既往研究证实WMH分布与AIS预后有关[9],但主要涉及幕上白质高信号(supratentorial white matter hyperintensity,SWMH),忽略了脑干白质高信号(brain-stem white matter hyperintensity,BWMH)。BWMH出现率较低,容易被忽略,研究较少。
从脑血管病机制方面考虑,脑干FLAIR高信号是缺血性脑血管病变的一部分,推测对前循环AIS预后有一定的影响。脑干包含重要的上下行白质纤维束,其白质病变可能加重神经功能损害。因此,本研究拟探讨BWMH是否可以作为前循环AIS预后的影像学标志,及其对预后评估的改善价值。
1 资料与方法
1.1 研究对象 回顾性收集河北医科大学第二医院2019年1月—2020年9月前循环AIS患者159例。在影像归档和通信系统(PACS)统计影像学资料。纳入标准:①前循环供血区脑梗死;②初次发病;③发病至首次MRI检查时间间隔<72 h;④临床及影像学资料齐全。排除标准:①腔隙性脑梗死,或合并后循环脑梗死;②既往脑梗死史遗留神经功能障碍和脑干华勒变性;③其他导致脑白质FLAIR高信号的疾病,如感染、遗传和中毒疾病等;④合并脑肿瘤、脱髓鞘疾病等及既往颅脑手术史;⑤影像及临床资料不全或图像质量不佳。本研究经本院伦理审查委员会批准(批准号2021-R481),免除患者知情同意。
1.2 临床资料收集 收集患者的性别、年龄、脑血管病危险因素[10]、发病至MRI检查时间、病变最大层面正交值(orthogonal diameters,OD)、入院扩散加权成像阿尔伯塔脑卒中计划早期诊断评分(diffusion weighted imaging Alberta stroke program early CT score,DWI-ASPECTS)、Fazekas评分、入院美国国立卫生研究院卒中量表(national institute of health stroke scale,NIHSS)评分及90 d后改良Rankin量表(modified Rankin scale,mRS)评分;NIHSS评分可分级神经功能缺损程度及评估预后,评分越高,神经受损越严重,预后越差。mRS评分可以评价患者功能恢复情况,评价时间点为首次症状发作后90 d,可以反映较长期的临床结果;根据评分分为预后良好(mRS≤2)和不良(mRS>2)。治疗方案包括静脉内溶栓及抗血小板聚集、降脂固斑、改善循环、营养神经治疗。
由2位具有5年和8年神经内科经验的主治医师采用NIHSS评分评估入院时神经功能缺损严重程度,采用mRS评分量表确定90 d神经功能状态。
1.3 MRI检查 采用3.0T MRI,8通道头线圈。扫描序列包括FLAIR、DWI和MRA。GE MRI扫描参数:FLAIR:TR 8 000 ms,TE 126 ms,TI 2 400 ms,层厚6.5 mm,扫描时间51 s;DWI:单次激发回波平面成像序列(single-shot EPI,SE-EPI),b=1 000 s/mm2,TR 4 500 ms,TE 72.5 ms,层厚6.5 mm,扫描时间97 s;MRA:TR 20 ms,TE 3.2 ms,层厚1.2 mm,翻转角(FA)20°。Philips MRI扫描参数:FLAIR:TR 9 000 ms,TE 140 ms,TI 2 600 ms,FA 120°,矩阵232×184,层厚6.5 mm,扫描时间108 s;DWI:SE-EPI,b=1 000 s/mm2,TR 2 208 ms,TE 96 ms,FA 90°,矩阵168×105,层厚6.5 mm,扫描时间26.5 s;MRA:TR 20 ms,TE 3.5 ms,层厚1.2 mm,FA 15°。
1.4 图像分析 由2名分别具有3年和10年神经影像经验的主治医师及副主任医师采用盲法观察图像,意见不一致时协商或咨询另一位具有20年神经影像经验的主任医师后达成一致。常规MRI:包括AIS病变部位、有无出血转化。采用DWI-ASPECTS评分评估梗死范围。在DWI高信号最大层面测量OD[11]。
WMH评价:BWMH定义为FLAIR图像上脑干边界不清的点状及斑片状异常高信号,T1WI呈等或稍低信号,T2WI呈高信号;横断面FLAIR和矢状位T2WI均出现高信号者认为存在脑干FLAIR高信号,即BWMH阳性,反之为BWMH阴性;若相应DWI同时为高信号则诊断为梗死。SWMH定义为侧脑室周围和(或)皮质下脑白质散在或弥漫性点线状和(或)斑片状T1WI呈等或稍低信号、T2WI呈高信号、FLAIR呈高信号[12]。采用Fazekas量表[12]进行SWML评分。脑室旁病变:0分为无病变;1分为线状或铅笔样薄层病变;2分为病变呈光滑晕圈;3分为脑室旁不规则高信号,延伸到深部白质。深部白质病变:0分为无病变,1分为点状病变,2分为病变部分融合,3分为病变大面积融合。Fazekas总分为脑室旁病变和深部白质病变的分数之和。
1.5 统计学方法 采用SPSS 21.0软件,非正态分布的计量资料以M(Q1,Q3)表示,采用Mann-WhitneyU检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。采用组内相关系数(ICC)评价2位医师评估指标的一致性。
单因素分析筛选出与BWMH阳性和AIS不良预后相关的临床和常规MRI因素,然后采用多因素Logistic回归分析确定预后相关的临床和常规影像学指标,建立临床因素模型(年龄、性别、临床危险因素、入院NIHSS评分)、常规MRI模型(病灶OD值、Fazekas评分、入院DWI-ASPECTS评分)、临床+BWMH指标模型、常规MRI+BWMH指标模型及综合模型(临床+常规MRI+BWMH),并评估预后预测效能。
采用Spearman相关分析BWMH阳性与临床、常规MRI指标的相关性。采用受试者工作特征(ROC)曲线评估上述模型预测预后的效能。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 159 例前循环AIS 中,男114 例(71.70%),女45例(28.30%);年龄30~82岁。高血压99例(62.26%)、糖尿病41例(25.79%)、高血脂10例(6.29%)、冠心病15例(9.43%)、嗜烟54例(33.96%)、嗜酒38例(23.90%)。发病至MRI检查时间为50(35,67)h,入院NIHSS评分4(2,7)分,最大病变层面OD值为3.61(1.38,8.80),入院DWI-ASPECTS评分8(7,9)分,入院Fazekas评分3(2,4)分。
2.2 BWMH阳性危险因素 159例AIS中,BWMH阳性57例(35.85%),阴性102例(64.15%),见图1、2。与BWMH阴性组比较,BWMH阳性组患者年龄较大(P<0.001),入院NIHSS评分、Fazekas评分及90 d mRS较高(P均<0.01),预后不良较高(P<0.001)(表1)。Logistic多因素回归分析显示,入院Fazekas评分是BWMH阳性的独立影响因素(OR=1.977,95%CI1.454~2.687,P<0.001)。Spearman相关分析显示,Fazekas评分与90 d mRS评分、BWMH呈正相关(r=0.409、0.321,P<0.001)。
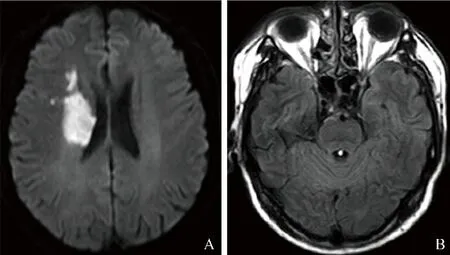
图1 男,63岁,AIS伴BWMH阴性。A.DWI示右侧放射冠异常高信号,梗死病灶正交值为6.34,入院DWI-ASPECTS为6分;B.FLAIR示BWMH阴性,Fazekas评分2分,入院NIHSS为6分,90 d mRS为1分

表1 BWMH阳性组与阴性组急性前循环AIS患者临床及影像学资料比较
2.3 BWMH与预后 159例中,预后良好112例,不良47例。预后良好组与不良组患者年龄、性别、OD值、入院NIHSS评分、Fazekas评分、入院DWI-ASPECTS评分、BWMH阳性率比较,差异均有统计学意义(P均<0.05),见表2。

表2 不同预后前循环AIS患者临床与影像学指标比较
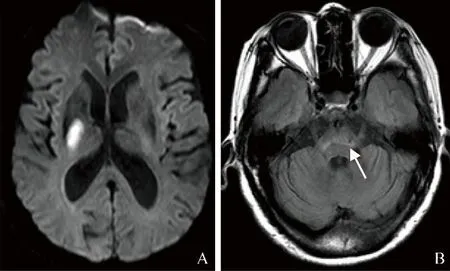
图2 女,73岁,AIS伴BWMH阳性(箭)。A.DWI示右侧基底节区异常高信号,梗死病灶正交值为1.58,入院DWI-ASPECTS为9分;B.FLAIR示BWMH阳性。Fazekas评分4分,入院NIHSS为6分,90 d mRS为3分
采用ROC曲线分析获得预后良好与不良的年龄截断值为64.5岁时Evans指数最大,因此将64.5岁作为预后评估的年龄截断值。多因素回归分析显示,年龄>64.5岁(OR=1.060,95%CI1.014~1.109,P=0.011)、女性(OR=4.130,95%CI1.505~11.323,P=0.006)、入院NIHSS评分较高(OR=1.218,95%CI1.075~1.380,P=0.002)及BWMH阳性(OR=4.216,95%CI1.617~ 10.997,P=0.003)是前循环AIS患者90 d预后不良的独立预测因素(表3)。
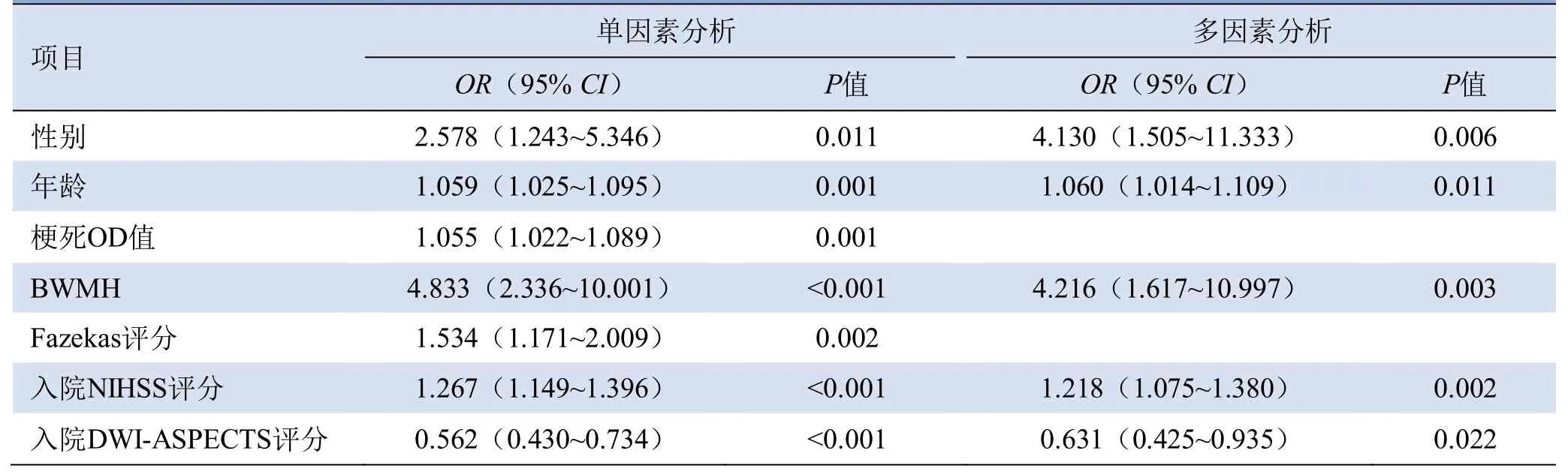
表3 影响前循环AIS患者预后的临床及影像学因素的Logistic分析
2.4 不同模型及BWMH评估AIS不良预后的效能 临床因素模型、常规MRI模型、BWMH、临床+BWMH模型、常规MRI+BWMH模型、临床+常规MRI模型、临床+常规MRI+BWMH的AUC分别为0.837、0.759、0.684、0.862、0.796、0.848和0.876,临床+常规MRI+BWMH的AUC值最大(图3),敏感度、特异度、约登指数分别为0.85、0.83、0.681。

图3 多种模型评估AIS不良预后的ROC曲线
2.5 一致性检验 2名医师对各指标评估的ICC值:入院NIHSS评分0.990(95%CI0.986~0.993)、mRS评分0.970(95%CI0.958~0.978)、病变OD值0.995(95%CI0.781~0.999 ) 、 DWI-ASPECTS 0.966 ( 95%CI0.948~0.977)、Fazekas评分0.971(95%CI0.961~0.979)。
3 讨论
本研究通过分析前循环AIS的BWMH征象,探讨BWMH对前循环AIS预后评估的价值。结果显示,前循环AIS患者BWMH阳性与脑白质病变Fazekas评分和90 d mRS相关,BWMH阳性是前循环AIS预后不良的独立预测因子,其与临床及常规MRI指标结合可以提高不良预后的预测效能。上述结果提示,前循环AIS预后评估中除SWMH外,还应观察有无BWMH,将其纳入临床和影像学指标联合评估模型可能有助于AIS预后评估能力。
3.1 BWMH的危险因素 WMH是脑小血管病常见的影像学表现,在老年人、尤其是女性多见[13]。WMH常见于幕上脑室旁和深部白质[6],发生后循环者见于脑干和小脑。BWMH的影像学表现与SWMH相同,发生机制可能为脑干血管病变引起缺血缺氧、星形胶质细胞增生以及神经细胞凋亡、华勒变性、细胞外间隙增大与液体增多[14]。
本研究显示,BWMH的危险因素与SWMH相似,包括年龄、性别、入院NIHSS评分、Fazekas评分、高脂血症。高龄患者血管脆性增加,椎基底动脉粥样硬化病变更严重[13]。既往研究显示,女性较男性初次卒中年龄大、发生出血性转化的风险高[15],其原因为随着女性年龄增大,提供神经保护和抗炎作用的雌激素和孕激素水平下降[16],绝经后更明显。入院NIHSS评分较高者,颅内动脉狭窄和闭塞相对严重[17],血流灌注减少及血管内皮细胞损伤更明显[18]。Giralt-Steinhaue等[19]报道高脂血症也是BWMH阳性的影响因素(180/337,53.41%),但本研究未发现两者间有显著差异,可能是因为本组高脂血症者较少(仅10例)。然而,关于BWMH阳性的影响因素及其与SWMH关系的报道较少,尚需大样本研究进一步验证本研究结论。
Fazekas评分是BWMH的独立危险因素。本研究结果显示,Fazekas评分越高,幕上脑白质病变越严重,BWMH出现率越高(r=0.409),提示两者发病机制相似,包括缺血性病变所致的局部微循环障碍、星形胶质细胞增生、血管内皮完整性破坏及血-脑屏障通透性增加[20],最终引起局部脑组织细胞外间隙扩大、水分增多。
3.2 BWMH评估AIS不良预后的机制 本研究发现,BWMH与AIS 90 d功能预后有关,预后不良组中该征象出现率明显较高(61.7%),且为独立预测因子;其机制可能是BWMH引起脑干白质损伤、脑功能连接完整性破坏,脑组织对细胞急性缺血和功能障碍的代偿恢复能力下降。脑干是重要的神经功能调节中枢,包括诸多上下行纤维束和重要神经核团、复杂的网状结构,因此在已有前循环AIS病变的基础上,BWMH病变必然加重神经功能障碍的复杂性和严重性,从而增加AIS不良预后的可能性。
3.3 AIS预后不良的其他危险因素 本研究证实病变体积、DWI-ASPECTS评分、Fazekas评分等影响前循环AIS的预后。病变体积直接反映梗死的大小及范围,而DWI-ASPECTS评分和Fazekas评分可以评估AIS早期缺血性改变和脑白质病变程度[21-22],三者均有助于预测血管内治疗效果和远期预后。而患者年龄、性别、入院NIHSS评分等临床因素也与预后有关,即年龄大、女性、NIHSS评分高者预后不良,其原因为高龄、女性及入院NIHSS评分高者自身功能下降,SWMH及BWMH阳性风险增加,进一步增加了预后不良的可能性。入院NIHSS评分较高表明脑血管病变严重,兼顾前后循环,可以从肢体运动、眼球运动、面瘫等神经功能角度判定反映脑干受累,而FLAIR显示脑干高信号为这些神经功能受损提供了病理解剖依据。因此,可以利用上述临床及MRI指标提高预测患者预后不良的可能性。
3.4 BWMH评估AIS不良预后的价值 本研究显示,BWMH阳性对预测AIS不良预后有参考价值,可以作为预测因子。临床及常规MRI指标在提高AIS预测不良效能的价值已得到证实,当增加BWMH指标时,即临床+常规MRI+BWMH,可进一步提高临床及常规MRI指标对AIS不良预后的预测效能,其AUC最大,预测价值最高,提示BWMH是前循环AIS预后评估的协同因素,其病理基础可能是脑干高信号为全脑血管病变的一部分,脑干病变增加了前循环AIS对神经功能的损害,阻碍了远期神经功能康复。因此,对于前循环AIS的预后评估,特别是不良预后预测,除纳入临床指标和常规MRI指标外,还应考虑有无BWMH。
3.5 本研究的局限性 ①本研究为单中心、较小样本的回顾性研究,结论尚需大样本量、多中心研究进一步验证。②仅限于前循环脑梗死患者,BWMH是否也适用于后循环AIS患者尚需进一步研究。③未对BWMH程度进行分级评分,也未区分BWMH的具体部位,而脑干不同部位受累对神经功能影响不同,因此进一步研究应根据脑干内WMH的不同位置区分对临床预后的不同影响。④未采用DTI序列分析量化脑干白质纤维束微结构损伤,DTI可以直观地显示脑干白质纤维束的连续性,FA、MD值等指标可以量化显示白质病变程度。
总之,前循环AIS患者BWMH与SWMH有关,BWMH的危险因素与幕上脑白质病变相似,BWMH是AIS不良预后的独立预测因子,有助于改善前循环AIS不良预后综合模型的预测效能。未来研究应补充DTI在内的多模态MRI技术,并观察BWMH对后循环脑梗死预后的影响,以及对血管内治疗效果的预测价值。
