非生物胁迫处理后拟南芥过氧化氢含量变化的分析
2022-01-13杨丽萍丁晓月金太成
杨丽萍,韩 晗,石 淼,闵 菲,丁晓月,金太成
(吉林师范大学 生命科学学院,吉林 四平 136000)
0 引言
植物的生长发育随着环境的变化而变化,不良的生存环境会严重限制植物生长和发育.而这种环境的限制被称为环境胁迫,它从概念上可以分为生物胁迫和非生物胁迫[1].其中生物胁迫包括各种病原体支原体对植物的感染侵害、食草类动物对植物的入侵等[2].而非生物胁迫根据外界环境条件因素的改变可以分为干旱胁迫、盐胁迫、低温胁迫、热胁迫与重金属污染等[3].生物胁迫和非生物胁迫严重影响了植物已经建立的抗逆体系,扰乱了植物的正常代谢,有些胁迫甚至会出现败育现象,严重影响作物的产量[4].
植物细胞每时每刻都在进行有氧的生命活动,在这个过程中会产生一类代谢副产物,它们统称为活性氧.过氧化氢(H2O2)是植物体内中以最稳定形式存在的活性氧之一,并且它还参与了体内外光合作用时电子的传递[5].植物在非生物胁迫条件下过氧化氢含量急剧升高,导致胁迫信号途径传递加强,植物抵抗非生物胁迫能力增强[6].活性氧包括H2O2和单线态氧(1O2)[7-9].因此,可以通过检测植物体内蛋白质含量的变化,推断植物中活性氧含量的变化[10].
本实验对拟南芥(Arabidopsisthaliana)生态型Col-0进行干旱、低温和盐胁迫处理,并通过对未处理的Col-0和三种非生物胁迫处理的Col-0进行H2O2含量的测定.结果表明,非生物胁迫处理后Col-0中过氧化氢含量有显著增加,为深入研究植物应答非生物胁迫的分子机制奠定研究基础.
1 材料与方法
1.1 植物材料
本研究使用拟南芥(Arabidopsisthaliana)生态型Col-0.
1.2 植物材料播种
用新配置体积浓度为30%的84消毒液对野生型拟南芥(Col-0)种子消毒8 min,然后分别使用新配置75%的酒精和高温灭菌后的蒸馏水冲洗2—3次,然后播种到MS培养基上用封口膜封好培养皿,最后放置到冰箱4 ℃春化2 d;2 d后放置到25 ℃恒温培养房,14 d后将拟南芥移栽至灭菌土中.
1.3 植物材料处理
我们对拟南芥(Col-0)进行干旱、盐、低温处理,同时选取相同苗龄的野生型拟南芥作为对照.干旱处理:选取长势相同的拟南芥(Col-0)作为实验组进行缺水处理7~10 d,对照组的Col-0持续正常浇水,连续缺水处理7~10 d.盐处理:对拟南芥(Col-0)浇灌150 mmol/L的NaCl溶液,连续盐处理3 d,对照组Col-0正常浇水.低温处理:拟南芥Col-0放置于4 ℃条件下低温处理24 h,对照组Col-0放在 25 ℃恒温光照培养室中培养.
1.4 实验药品及试剂
H2O2测试盒(分光光度法);PBS(pH=7.4)缓冲液;考马斯亮蓝;牛血清蛋白.
1.5 主要仪器设备
HC-2518高速冷冻离心机;WHY-2型水浴恒温振荡器;DG-800漩涡混合器;紫外分光光度计;研磨机等.
1.6 组织中H2O2的测定
1.6.1 样本前处理
称取0.3 g拟南芥叶片,放入提前用液氮预冷好的研钵中手动迅速研磨直至将植物材料完全破碎,然后加入0.1 mol/L PBS缓冲液(pH=7.4)2.7 mL,在4 ℃的条件下高速离心10 min,最后用1 mL移液枪吸取0.3 mL的上清液.
1.6.2 操作步骤
需要准备3个5 mL玻璃试管,分别标注为空白对照管、标准滴定管和样本测定管.然后分别向3支试管中加入1 mL试剂一(37 ℃的水浴锅预热10 min);向空白对照管加0.3 mL去离子水(ddH2O),向标准滴定管加入0.3 mL标准品应用液,样本测定管中和0.3 mL上清液;混匀后分别向三支试管中加入1 mL 的试剂二,立刻手动摇匀,并迅速用紫外分光光度计于405 nm处测各管吸光度,用双蒸水调零.最后将剩余的叶片用紫外吸收法和考马斯亮蓝染色法测组织均浆蛋白浓度和匀浆蛋白含量.
1.6.3 计算公式
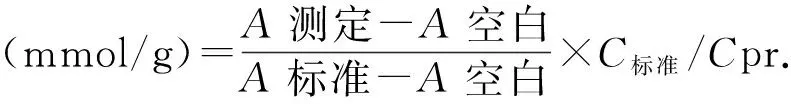
Cpr:组织匀浆蛋白质量浓度(g/L).
1.7 实验数据统计分析
统计数据用平均值(Mean)±标准差(SD)表示;用生物学统计软件Prism进行单因素方差(One-way ANOVA)分析;用Prism软件制作柱状图.
2 结果与分析
2.1 非生物胁迫处理拟南芥表型
由于盐处理与低温处理时间较短,并未观察到实验组拟南芥(Arabidopsisthaliana)形态及表型发生明显变化.我们以干旱处理的拟南芥(Arabidopsisthaliana)为主,进行表型分析.未处理的拟南芥(Col-0)作为对照植株(图1(A)),实验组拟南芥(Col-0)干旱处理4 d(图1(B)),拟南芥植株受干旱影响逐渐开始显现,拟南芥少数叶片边缘出现轻微黄化现象;叶片有少量花青素积累;干旱处理7 d(图1(C)),拟南芥叶片边缘开始向内卷曲变形,部分叶片干枯,花青素积累明显增加;随着干旱处理时间延长,10 d时,拟南芥叶片边缘向内卷曲变形情况加剧,叶片严重黄化、萎蔫甚至死亡,花青素积累大大增加(图1(D)).

(A)拟南芥(Col-0);(B)干旱4 d拟南芥;(C)干旱7 d拟南芥;(D)干旱10 d拟南芥图1 野生型拟南芥和干旱处理拟南芥表型差异Fig.1 Phenotypic differences between wild-type Arabidopsis and drought-treated Arabidopsis
2.2 H2O2含量变化
采用紫外分光光度计对拟南芥H2O2含量进行检测,以未处理的野生型拟南芥(Col-0)作为对照,实验结果表明,盐胁迫(150 mmol/L的NaCl溶液)盐处理3 d后的拟南芥(Col-0)中H2O2含量成倍数增加(P<0.05);干旱胁迫(缺水处理7~10 d)后的10 株Col-0中H2O2含量大幅增加 (P<0.05);4 ℃低温处理24 h的拟南芥中 H2O2含量显著上升 (P<0.05)(见图2).
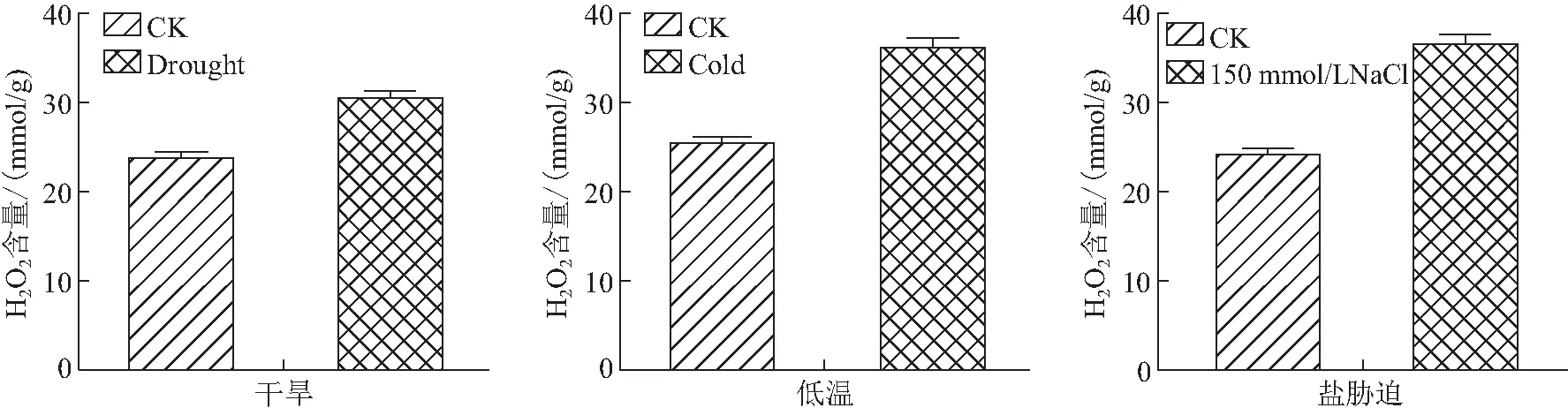
图2 干旱、低温和盐胁迫处理后拟南芥中H2O2含量变化Fig.2 Changes of H2O2 content in Arabidopsis thaliana after drought,low temperature and salt stress
3 讨论
全球粮食产量的减少是由于干旱、盐胁迫、低温胁迫以及金属离子污染等非生物胁迫的干扰导致[11].如今,随着气候环境越来越恶劣,极端天气情况更加频繁,非生物胁迫对植物的迫害更加严重[12].非生物胁迫会影响植物的一系列形态、生理、生化和分子变化,严重影响植物的生长发育[13].极端的环境刺激可以导致植物有过量的活性氧(ROS)积累,并通过一系列的氧化还原使植物代谢通路受损[7].根据已有的研究表明,在非生物胁迫条件下H2O2是相对稳定的一类活性氧分子,它的含量变化严重影响着胁迫信号的传递[14-15];在植物自然生长发育这一生理过程中,H2O2扮演着重要的角色.如果植物对H2O2免疫,那么植物对非生物胁迫的抗性将会大大的增强[16].
本研究测定了干旱、低温和盐处理三种非生物胁迫处理的拟南芥(Col-0)与未处理拟南芥Col-0之间的H2O2含量变化,结果表明:非生物胁迫处理后拟南芥中H2O2含量显著上升,其中盐胁迫和低温胁迫H2O2含量成倍增长,干旱胁迫后H2O2含量也显著增加.说明在非生物胁迫条件下,植物的过氧化氢含量迅速积累,对植物细胞会造成一定的伤害甚至死亡.根据已有研究表明,非生物胁迫严重影响植物的DNA甲基化和去甲基化水平,甲基化水平的高低严重影响着植物对胁迫环境的抗性[17].本研究能够为进一步研究植物通过信号分子激活植物响应基因表达的分子机制提供实验基础和参考依据.
