去甲基化酶ALKBH5在乳腺癌中表达的临床病理意义
2022-01-13李文仿龙彬彬姚方辉赵宗彬张华
李文仿 龙彬彬 姚方辉 赵宗彬 张华
近年来,乳腺癌的发病率呈上升趋势,已位居女性恶性肿瘤的首位[1]。阐明乳腺癌发生发展的分子生物学机制对提高其诊治水平具有一定意义[2]。N6—甲基腺苷(N6-methyladenosine,m6A)修饰RNA是近期肿瘤进展研究的热点。m6A修饰是真核生物mRNA常见的甲基化修饰,参与真核生物mRNA的运输、剪切、翻译等过程[3-4]。m6A修饰通过甲基化酶、去甲基化酶及甲基化识别酶等调控mRNA甲基化,参与膀胱癌、胃癌等恶性肿瘤进展[5-6]。去甲基化酶AlkB同源蛋白5(AlkB homologue 5,ALKBH5)与甲基化转移酶14(METTL14)、Wilms瘤相关蛋白(Wilms tumor 1 associated protein,WTAP)形成mRNA甲基化修饰复合体,是mRNA的m6A甲基化修饰主要调控单位,通过调控肿瘤基因表达,在恶性肿瘤进展中发挥作用[7]。本研究主要探讨乳腺癌组织中ALKBH5的表达及临床意义。
1 材料与方法
1.1 临床资料 收集2017年5月至2018年9月在本院进行乳腺癌手术切除石蜡标本90例,乳腺增生组织石蜡标本20例,以及相应乳腺癌患者的临床资料、免疫组化指标、病理检查结果等。
1.2 siRNA转染 转染试剂Lipofection2000,购自Invitrogen。ALKBH5 siRNA序列由上海生工合成,序列为siRNA1:5′-GCAGC AAGGCAGTCT TTA AGT-3′,无 效 干扰RNA没有相应的mRNA作用靶点(siRNA NC),序列为5′-UUCUCCGAACGUG UCACGU-3′。ALKBH5的siRNA按照转染Lipofection2000说明,转染乳腺癌细胞MDA-MB231。
1.3 RNA提取 收集细胞并裂解,每6 cm培养板的细胞中加入1 mL Trizol溶液,将细胞转移到无RNA酶离心管中。抽提:加入1/5体积的三氯甲烷,剧烈震荡1 min,充分混合后,室温静置 3 min;37 ℃,12 000 r/min离心10 min;将上层RNA层转移至新的无RNA 酶离心管。沉淀:加入等体积异丙醇,混匀,室温静置10 min;4 ℃,12 000 r/min离心10 min,可在底部观察到沉淀的RNA,弃上清保留沉淀。洗涤:轻轻加入1 mL现用现配的75%乙醇,上下颠倒洗涤沉淀及管壁;4 ℃,12 000 r/min离心5 min,弃上清保留沉淀,室温干燥。溶解:加入适量的DEPC处理水,溶解RNA;测量RNA浓度,用琼脂糖凝胶电泳检验所提RNA。
1.4 RT-PCR Prime 5.0软件设计并经过Blast检测,引物序列如下:GAPDH:5′-ACCCAGAAGACTGTGGGGATGG-3′,5′-TCTAGAC GGCAGGTCAGGTC-3′;ALKBH5的 引物 序 列 为:5′-CGGCGAAGG CTACACACT TACG-3′,5′-CCACCAGCTTTTGGATCACCA - 3′。qRT-PCR:取1μg的RNA模板,设置RT反应程序为42 ℃、60 min,70 ℃、10 min。Q-PCR反应以Bio-Rad CFX96仪进行扩增,条件如下:预变性采用95 ℃条件下作用30 s,循环1次;循环扩增次数为38次,95 ℃下作用10 s,60 ℃作用20 s,最后70 ℃延伸10 s。
1.5 MTT实验 10%血清培养细胞,以每孔1000个细胞接种96孔板,每孔体积200 μL,培养3天,每孔加入MTT溶液(5 mg/mL,用PBS配置,PH值为7.4)20 μL,继续孵育4 h,小心吸弃培养液上清。每孔加入150 μL DMSO,震荡10 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫监测仪上测定各孔吸光值,以时间为横坐标,吸光值为纵坐标,绘制细胞生长曲线图。
1.6 免疫组化法 取4μL厚石蜡切片二甲苯脱蜡,加热枸橼酸钠溶液抗原修复液至98 ℃,持续15 min修复抗原,内源性抗原封闭采用山羊血清工作液15 min。兔抗人ALKBH5单克隆抗体(1:100)4 ℃过夜,生物素化二抗37 ℃孵育20 min,加入显色溶液显色[8]。苏木素复染1 min,60 ℃烤片3 h,脱水,透明,中性树胶封片。染色结果采用半定量方法评估染色结果,“-”代表无染色,“+”代表<25%染色,“++”代表25%~50%细胞染色,“+++”代表>50%细胞染色。“-、+”代表阴性,“++、+++”代表阳性。
1.7 Western Blot法 采用RIPA裂解缓冲液(50 mM Tris-HCl,pH 7.4,150 mM NaCl,1%脱氧胆酸钠,1%Triton X-100,0.1%SDS;上海碧云天生物技术有限公司)裂解细胞。全蛋白以每孔50μg上样进行SDS-PAGE电泳。采用PBS稀释相应一抗至1:1000浓度,于37 ℃摇床上孵育过夜,HRP标记的二抗继续孵育300 min。通过ECL试剂在用化学图像发光系统检测蛋白表达。
1.8 细胞克隆实验 MDA-MB231细胞常规消化并计数,将细胞以500个/孔接种于6孔板中,轻轻晃动培养板使细胞分散均匀,37 ℃细胞孵箱培养。每4~5天换液1次,培养10天。吸净培养板中的培养基,用PBS溶液清洗2次,4%多聚甲醛固定30 min,然后用0.1%结晶紫溶液2 mL染色20 min。PBS清洗3次以上,自然风干。以>50个细胞计为1个克隆,克隆形成率=(阳性克隆数/接种细胞数)×100%,计算每组细胞的克隆形成率。
1.9 统计学方法 采用SPSS 17.0统计软件。计量资料以(±s)表示,采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 ALKBH5在乳腺癌组织中表达 采用SP免疫组化法检测ALKBH5在乳腺癌及乳腺增生组织中表达,ALKBH5主要定位于细胞核,胞浆及细胞膜均无ALKBH5表达,见图1。乳腺癌组织中ALKBH5表达的阳性率为57.8%(52/90),乳腺增生组织中ALKBH5表达的阳性率为25.0%(5/20),差异有统计学意义(χ2=7.042,P=0.008)。

图1 ALKBH5在乳腺癌/增生组织中的表达(免疫组化×400)
2.2 乳腺癌中ALKBH5表达与临床病理特征分析 ALKBH5表达与乳腺癌患者的年龄、性别、组织学分级、激素受体及肿瘤分期情况均无关(P>0.05)。ALKBH5高表达与乳腺癌患者的肿瘤大小(P=0.024)、淋巴结转移(P=0.028)密切相关。见表1。
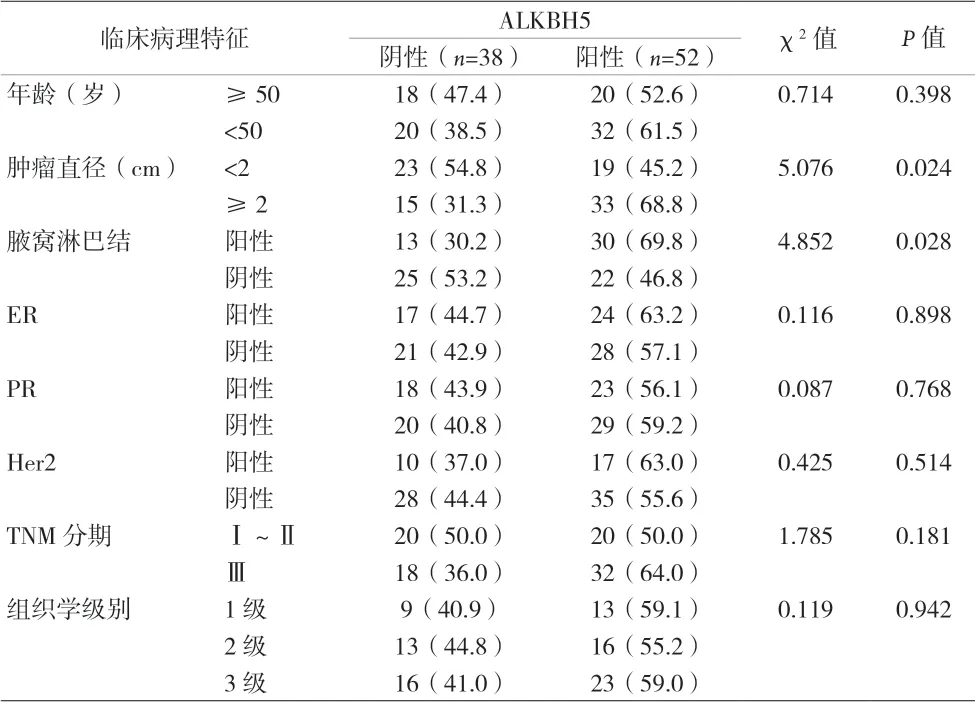
表1 乳腺癌组织中的ALKBH5表达与临床病理特征分析[n(%)]
2.3 基因敲除ALKBH5抑制乳腺癌MDA-MB231细胞增殖 将 si-ALKBH5分别转染至MDA-MB231细胞后,Q-PCR及Western Blot提示siRNA-ALKBH5明显抑制乳腺癌中ALKBH5的mRNA及蛋白表达(P<0.05)。应用MTT观察细胞增殖情况,显示ALKBH5-siRNA转染组MDA-MB231细胞增殖在24 h、48 h及72 h明显受到抑制而克隆形成实验提示,ALKBH5-siRNA转染组MDA-MB231细胞克隆明显受到抑制。见图2。

图2 敲除ALKBH5抑制乳腺癌MDA-MB231细胞增殖
3 讨论
m6A是一种信使RNA的甲基化修饰,是一个动态可逆的修饰过程,由特异性的甲基化酶和去甲基化酶共同协调[9]。m6A修饰的核心甲基化转移酶复合体包括METTL3、METTL14和WTAP,另外一类酶是去甲基化转移酶,主要功能是清除mRNA上的甲基化修饰,包括FTO、ALKBH5等[6,10]。m6A在恶性肿瘤的生长、侵袭和转移中所起的调控作用已引起重视。研究发现,m6A修饰参与胃癌、淋巴瘤等多种肿瘤进展[11-12],ALKBH5参与骨肉瘤等多种恶性肿瘤进展[4,13],但ALKBH5在胰腺癌中却发挥抑癌作用,说明ALKBH5在不同癌组织中作用机制不同[14-15]。本研究发现,乳腺癌中ALKBH5表达增高,与患者淋巴结转移及肿瘤的大小有关,提示乳腺癌中ALKBH5有重要的生物学意义。
ALKBH5调控肿瘤进展的机制与促进靶基因mRNA去甲基化修饰有关,在胰腺癌中高表达与预后较差有关[15]。ALKBH5通过去甲基化修饰FOXM1的mRNA,可明显促进FOXM1表达,促进胶质瘤细胞干性[16]。缺氧乳腺癌细胞干性HIF-1表达,可促进ALKBH5表达,进而影响通过mRNA去甲基化,促进多能性基因NANOG的表达,参与乳腺癌干性进展[17]。ALKBH5在卵巢癌中发挥抑制自噬作用,敲除ALKBH5抑制卵巢癌细胞增殖、迁移和侵袭,其机制与ALKBH5激活EGFR-PIK3CA-AKT -mTOR信号通路,并可稳定BCL2的mRNA及促进BCL2与Beclin1结合[18]。ALKBH家族也通过调控tRNA的去甲基化修饰,ALKBH3也可促进恶性肿瘤进展[19]。本研究发现,乳腺癌中ALKBH5表达增高,表明ALKBH5也可能通过调控相关靶基因表达,影响乳腺癌恶性进展。通过进一步敲低乳腺癌细胞MDA-MB231中ALKBH5,发现能抑制乳腺癌细胞的增殖,提示ALKBH5可能是乳腺癌中发挥增殖促进作用,但具体机制需要进一步阐明。
综上所述,ALKBH5在乳腺癌组织中异常高表达,与患者的淋巴结转移、肿瘤直径较大有关。乳腺癌中ALKBH5可能是一个新的重要的治疗靶点。
