1例盆腔腹膜后Castleman病病例报告并文献回顾
2022-01-11钱瑞君刘智敏李祎娉林宏城任东林
钱瑞君,刘智敏,李祎娉,林宏城,任东林
中山大学附属第六医院肛肠外科 广东广州 510655
Castleman病于1954年由Castleman和Towne首次报道[1],是一种罕见疾病,目前病因尚未明确。Cas⁃tleman病以淋巴源性良性肿瘤为特征,主要分布于纵隔、颈部、腹腔,较少见于盆腔腹膜后[2]。由于缺乏典型的临床表现,且盆腔肿瘤的鉴别诊断较为困难,盆腔Castleman病的临床诊疗有待进一步探索。本文报道1例盆腔腹膜后Castleman病男性患者的诊疗过程,并回顾总结相关文献资料,为临床医师对该病的诊疗决策提供一定的参考。
1 临床资料
患者为65岁男性,2020年初出现频繁夜尿、排粪困难、粪便变细,2020年12月于当地医院就诊,在检查中发现腹部肿块,PET-CT提示左侧盆腔腹膜后高代谢肿块,考虑为间叶组织来源恶性肿瘤,左侧盆腔多发稍大稍高代谢淋巴结,考虑转移。为寻求进一步诊治,于2021年1月在我院门诊以“盆腔肿瘤”收住院。体格检查:腹部触诊时可触及一质软肿块,无压痛、反跳痛;直肠指诊未触及肿物,退出指套无染血。实验室检查未见明显异常。超声检查提示盆腔左侧低回声包块(图1);MRI检查提示肿物呈分叶状,增强扫描呈明显不均匀强化,其内可见小片状低信号影,肿物包膜完整,与周围脏器分界清晰,膀胱受压明显,包膜内较多血管分布,边缘见髂血管分支通过,周围有多个稍大淋巴结,最大直径约5 mm,形态规则,信号均匀(图2)。CT提示肿物位于盆腔腹膜后,直径约65 mm,呈分叶状,周围可见血管伴行,增强扫描呈动脉期明显不均匀强化,静脉期显著强化,病变周围、左侧髂总动脉及腹主动脉旁见多个淋巴结,信号均匀,强化均匀(图3)。影像学考虑间叶组织来源恶性肿瘤可能性大,副神经节瘤可能。术前诊断:盆腔恶性肿瘤。
图1 超声检查见低回声包块

图2 MRI检查所见

图3 CT检查所见
2 治疗过程
因肿瘤血供丰富,为避免术中出血,术前对肿瘤供血动脉进行了数字减影血管造影(DSA)下栓塞。选用5F-RH导管进行左侧髂内动脉造影显示:左侧髂内动脉分支血管阴部内动脉走行迂曲、增粗(图4),实质期可见盆腔左侧壁巨大肿瘤染色影。将微导管分别超选择性插管至左侧阴部内动脉分支再次造影,取直径350~560 μm及560~710 μm PVA颗粒栓塞供血动脉,栓塞结束后再次造影确定供血动脉基本闭塞。栓塞第2天,患者全身麻醉满意后,取截石位,由于膀胱受压明显,行双侧输尿管逆行插管并放置支架以保护输尿管。取长约15 cm中下腹部正中绕脐切口,用切口保护套进行保护,探查全腹,腹腔未见积液,胃、小肠、肝脏未见异常,左侧盆腔可触及一质中肿块。游离乙状结肠,经左侧髂血管入路进入盆腔,游离左侧输尿管,超声刀切除肿瘤周围组织并游离肿瘤,保护膀胱后壁,离断左侧膀胱动脉,保留闭孔神经及动脉,将肿瘤完整切除,移除肿瘤后裸化左侧髂血管(图5),确认无活动性出血,无漏尿,无异常淋巴液渗漏等,留置引流管,关闭髂血管入路腹膜完成腹膜化。冲洗腹腔,逐层关腹。术中出血量约50 mL,术后复苏满意。

图4 术前左侧髂内动脉DSA所见

图5 术中移除肿瘤后裸化的左侧髂血管
手术标本:肿物大小为11 cm×6 cm×6 cm,切面呈灰黄灰红色,质中(图6)。术后病理:淋巴组织显著增生,见较多淋巴滤泡,生发中心伴萎缩,套区增生,个别呈“洋葱皮”样排列,间质血管增生,管壁增厚,伴玻璃样变性(图7)。免疫组化:CD21示FDC(+),CD38、CD138示滤泡间较多浆细胞(+),κ、λ部分细胞(+),CD30(-),CD15部分细胞(+),CD20、PAX-5B细胞(+),MuM1部分细胞(+),CD10、Bcl-6示个别生发中心(+),Bcl-2示套区增宽,Ki-67生发中心增殖指数低。结合免疫组化结果,病变符合Castleman病,透明血管型。送检髂外动脉旁淋巴结4枚,均呈反应性增生。

图6 大体标本
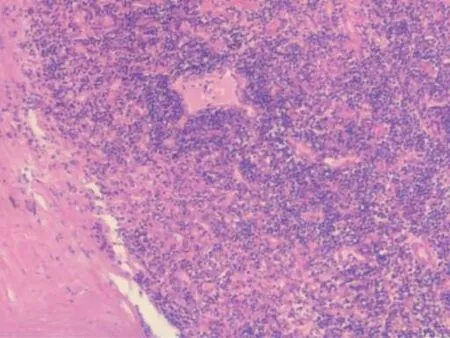
图7 盆腔肿物术后病理(苏木精-伊红染色,×10)
患者术后第21天出院,1个月后复诊,夜尿增多、排粪困难症状好转,复查CT提示左侧髂血管旁、腹主动脉左旁见多发稍大淋巴结,最大直径约7 mm,密度均匀。8个月后再次随访,患者偶感便秘,小便恢复正常,其余情况良好,复查盆腔CT提示左侧腹股沟区多个稍大淋巴结影,最大者直径约20 mm。
3 讨论
Castleman病是一种罕见的淋巴组织增生疾病,发病率为每年(21~25)/1 000 000[3]。Castleman病可发生在任何年龄阶段(2~84岁),确诊时患者中位年龄为34岁,女性略多于男性[4]。部分患者与HHV-8感染有关,可能涉及免疫系统功能失调,具体病因尚未明确[5]。根据病变累及的淋巴结区域和数量可分两种类型:单中心型Castleman病(unicentric Castle⁃man disease,UCD),仅累及单个淋巴结或单个淋巴结站内的多个淋巴结;多中心型Castleman病(multi⁃centric Castleman disease,MCD),累及多个站内淋巴结,甚至淋巴结外器官,如肺、乳腺[6],具体分型及特点见表1[5]。MCD患者常出现由白细胞介素-6(IL-6)和其他细胞因子驱动的全身症状,如发热、体重减轻、疲劳等[7]。UCD最常见的病变部位为纵隔(29%)、颈部(23%)、腹部(21%)和腹膜后(17%),少部分位于腋窝、腹股沟区域以及眼眶、鼻咽和小肠[6]。大部分UCD患者缺乏典型临床表现,或仅在邻近器官(如气道、神经血管束、膀胱、直肠等)受压时出现相应症状。本例UCD患者症状仅为肿物压迫后导致的尿频不适。

表1 Castleman病的分型[ 5]
在术前,UCD的诊断主要依靠影像学检查。应对颈部、胸部、腹部和骨盆进行CT扫描,以确定受累淋巴结区域和数量,并区分UCD和MCD[6]。在CT扫描中,UCD多呈密度均匀、边界清楚的实性肿块影,病灶>5 cm时则常出现密度不均、肿块内低密度影。UCD的重要特征包括中央性分支状钙化和显著的均匀强化[8],平衡期病灶周边比中心强化更显著,出现环形强化征象。渐进式强化静脉期增强高于动脉期,见于透明血管型;持续性强化见于浆细胞型[9]。检查发现单个持续增大的淋巴结,或同一淋巴结区域内>1个持续增大的淋巴结,在CT上呈现中度以上的增强,应考虑诊断UCD。本例患者术前CT和MRI检查有以下几个特征:(1)肿块位于盆腔腹膜后,直径超过5 cm;(2)呈分叶状;(3)内有小坏死灶;(4)边缘有血管分支伴行。这些表现与最常见的腹膜后间叶来源恶性肿瘤CT表现高度吻合[10],因此本例患者在术前的影像学诊断考虑为间叶来源恶性肿瘤,出现误诊。但本例患者在动脉期的强化异常明显,可与脂肪肉瘤等间叶来源恶性肿瘤相鉴别。神经源性肿瘤是第二常见的腹膜后肿瘤[11],主要包括嗜铬细胞瘤、异位嗜铬细胞瘤,同样可表现为动脉期异常强化。UCD在MRI中,T1WI呈低信号病变,T2WI呈高信号病变,增强程度接近于主动脉,滋养血管在平扫时表现为流空低信号,较正常血管迂曲、增粗,增强显著强化,可见同行引流静脉[12-13]。较大肿块增强后出现结节状、裂隙状低信号区,MRI比CT显示更清楚,有相关病理研究证实为纤维组织构成,被认为是UCD特征之一[14]。本例患者MRI增强时可见小片状低信号影,与上述特征相符。
根据最新发布的Castleman病诊断和治疗指南,手术切除为UCD的首选治疗方式。绝大部分患者在病灶切除后临床症状得到缓解,预后良好,复发少见[6,15-16]。对于不可切除且无症状的UCD患者,可进行严密的随诊;合并炎症的UCD患者推荐使用抗IL-6单克隆抗体治疗以改善全身症状;压迫重要邻近组织器官导致相应症状且不可切除的UCD,可进行利妥昔单抗、类固醇等药物治疗,或放疗[6]。UCD对放疗的敏感性高达72%,可以作为手术治疗的替代方案[5]。根据指南,本例患者具有手术切除指征。指南强调,在UCD的病理诊断中,需要将淋巴结完整切除行病检,因此完整手术切除兼具诊断与治疗作用[6]。本例患者术前未经活检明确病理,但总体治疗策略是成功的。由于肿物直径较大,与周围组织器官分界尚清,具有明确供血来源,我们通过术前血管造影,将阴部内动脉分支有效栓塞,降低术中出血风险;并通过术前左侧输尿管支架放置,降低误切损伤风险;在层面外科的概念下,成功保护膀胱侧后壁,完整保留左侧盆神经筋膜,在肿瘤下方保留闭孔神经及动脉,仅通过切断左侧膀胱动脉即实现完整切除,出血量小,效果满意。
本例患者在术后1个月复查CT时提示左侧髂血管旁、腹主动脉左旁见多发稍大淋巴结,最大直径约7 mm,密度均匀,对比术前最大直径增大2 mm。对于多发淋巴结,笔者认为有以下几种可能的情况:(1)手术清扫时遗漏的小卫星淋巴结。有文献描述在切除主要病灶后,残余的小卫星淋巴结很快自发退化[17],与本例患者情况不符合;(2)UCD复发,完全切除后复发少见,但本例患者不排除复发的可能,根据指南推荐,复发性UCD应每年进行一次CT扫描,持续5年[6];(3)左侧髂血管旁、左腹主动脉旁增大淋巴结与原切除病灶不是同一站内淋巴结。截至目前,还未查询到UCD向MCD转化的病例报道。本例患者术后8个月随访,全身状况良好,复查CT提示左侧腹股沟区见多个稍大淋巴结影,最大者直径约20 mm,拟继续追踪观察淋巴结生长情况。
4 小结
通过对本病例诊治经过的回顾,我们对Castle⁃man病有以下体会:(1)术前诊断:详细的影像学检查十分重要,并需注意与间叶组织来源恶性肿瘤相鉴别。(2)术前评估:DSA检查在复杂盆腔病灶的治疗中可起到协助作用,对于血供丰富者尤为重要[18],术前血管造影和栓塞有利于术中止血[19]。(3)组织器官保护:盆腔腹膜后病灶与周围的髂血管、侧方输尿管及神经关系密切,术中应仔细分离以避免输尿管及神经损伤。(4)术式选择:盆腔腹膜后Castleman病常与周围组织粘连,完整剥离难度大[2]。在手术方式选择中,病灶较小的病例可选择腹腔镜手术,借助腹腔镜放大术野的作用,更利于安全解剖[20],本例患者因肿瘤较大、位置较深,仍采用开放术式。
Castleman病较为罕见,多以病例报道形式出现,目前尚缺少系统性研究。本文报道了1例盆腔腹膜后UCD,由于经验不足,术前误诊为盆腔恶性肿瘤。通过对此病例的总结学习,将来评估盆腔腹膜后来源不明肿物以及局灶或多中心淋巴结肿大疾病时,我们应更加仔细判读病灶影像学表现,并将Castle⁃man病纳入鉴别诊断。UCD首选手术切除,本例患者手术经验提示,对于血供丰富的UCD,术前进行血管造影栓塞供血动脉可以达到理想的止血效果。然而,对本病更为深入系统的认识,有待进一步研究。
利益冲突声明 全体作者均声明不存在与本文相关的利益冲突。
