结肠镜EMR和ESD在早期结直肠癌及癌前病变治疗中的应用*
2022-01-11伍秋宁孙家琛卢祎林绪涛范德军胡民辉李初俊
伍秋宁,孙家琛,卢祎,林绪涛,范德军,胡民辉,李初俊
中山大学附属第六医院消化内镜科 广东广州 510655
结直肠癌是危害国人健康的主要癌症之一,在我国常见癌症中位列第三,最新数据显示2015年结直肠癌发病率占全部新发恶性肿瘤的9.87%,其死亡率则占全部恶性肿瘤的8.01%[1]。但是,大部分早期结直肠癌患者行早期治疗后均显示预后良好,五年生存率超过90%,且部分患者仅需要进行内镜下治疗即可获得根治。另一方面,结直肠癌基本遵循腺瘤—腺癌的病变进展模式。早期结直肠癌及癌前病变基本以息肉的形态在结肠镜检查中得以发现。因此在结直肠癌筛查基础上,正确应用内镜治疗早期结直肠癌及癌前病变,是减少患者及社会负担、改善患者生活质量的重要手段。
参考多部国内指南及国际卫生组织(WHO)病理分类标准,国内就早期结直肠癌及癌前病变的定义已达成基本共识,即癌细胞穿透结直肠黏膜肌层浸润至黏膜下层,但未累及固有肌层,为早期结直肠癌(pT1期)。结直肠腺瘤、锯齿状息肉及息肉病(腺瘤性息肉病及非腺瘤性息肉病)、炎性肠病(in⁃flammatory bowel disease,IBD)相关异型增生均属于结直肠癌前病变。腺瘤中形态或结构有异型倾向的称为上皮内瘤变,其中低级别腺瘤、低级别异型增生统称为低级别上皮内瘤变,重度异型增生及没有穿透黏膜肌层的癌称为高级别上皮内瘤变,包括原位癌和局限于黏膜层、但有固有层浸润的黏膜内癌[2-5]。
随着内镜器械和技术的发展,内镜下息肉切除的基本方法主要包括冷活检钳钳除术(cold forceps polypectomy,CFP)、热活检钳钳除术(hot forceps polypectomy,HFP)、冷圈套器息肉切除术(cold snare polypectomy,CSP)、热圈套器息肉切除术(hot snare polypectomy,HSP)、内镜下黏膜切除术(endoscopic mucosal resection,EMR)和内镜黏膜下剥离术 (endoscopic submucosal dissection,ESD)。本文就EMR和ESD在早期结直肠癌及癌前病变治疗中的应用,围绕切除方式的选择、内镜切除新技术等进行述评。
1 EMR和ESD
EMR在圈套器息肉切除术的基础上发展而来,操作难度较低,学习曲线较短。它通过注射针向病灶的黏膜下层注射液体,使病变隆起、远离固有肌层,再使用圈套器电切除病灶。对于大块黏膜病变,EMR有时难达到整块切除,甚至有恶变者,其病变边缘无法评估,容易出现肿瘤组织残留,这时候ESD应运而生。ESD操作包括:在标记的病变周围行黏膜下注射使病变隆起,沿病变周围切开黏膜,暴露黏膜下层,并在病变下方逐步进行黏膜下剥离,最终剥离没有尺寸限制的完整标本。但ESD操作难度大,学习曲线较长。
EMR和ESD对于早期结直肠癌及癌前病变的治疗均具有确切的疗效及较高的安全性,一旦出现非治愈性切除的情况,还可以通过追加内镜切除或外科手术作为补充治疗。一项纳入50篇原始研究的Meta分析评价了直径>20 mm的结肠息肉采用内镜切除的治疗效果,首次切除成功率为92%,仅有8%的息肉因为非治愈性切除追加后续手术治疗,内镜并发症中穿孔发生率为1.5%,出血发生率为6.5%,中位随访时间约2年,随访过程中13.8%的病例出现复发,其中0.3%为浸润性癌,内镜治疗总体成功率为90.3%,死亡率为0.08%[6]。说明恰当地选择内镜切除术可以避免90%以上的外科手术治疗,且严重并发症的发生率比较低。即便随访过程中出现复发,仅小部分进展为癌,大部分仍可再次采用内镜切除作为补充治疗。
2 内镜切除方法选择的主要依据
内镜切除早期结直肠癌及癌前病变的效果无可否认。然而钳除术、圈套器息肉切除术、EMR和ESD操作难度、操作时长、治疗成本、学习曲线均依次递增,早期结直肠癌及癌前病变在形态、大小、数量、部位却具有不同特点,如何选择最恰当的内镜切除方法,既满足经济学效益,又能尽可能遵循整块切除(en-bloc)的原则,还要保证安全性,尽可能避免严重并发症的发生,是每位内镜医师所面临的重要考验。
2.1 息肉的基本参数
首先,息肉的基本参数(如大小、形态、部位)是选择内镜切除方法的主要依据之一。英国一项研究最早提出了对息肉的大小(size)、形态(morphology)、部位(site)和操作抵达难度(ac⁃cess)进行分级的概念,即通过SMSA评分来评估EMR的成功率和安全性。他们研究了共计220枚直径>20 mm的息肉,发现SMSA Ⅱ~Ⅲ级息肉切除成功率为97.5%,SMSA Ⅳ级息肉切除成功率仅87.5%,其中病灶大小和部位是发生并发症的独立影响因素,即内镜切除术的并发症发生率会受到SMSA分级的影响[7]。2015年英国胃肠病学会发布《大型无蒂结直肠息肉诊疗指南》,建议用SMSA评分来评估较大非隆起型息肉的内镜切除难度[8]。该分级的临床实践意义在另一项包含2 675名患者的研究中也得到进一步证实,研究发现在直径>20 mm的侧向发育型息肉中,EMR切除失败率为4.6%并可通过SMSA分级来预测,SMSA Ⅱ/Ⅲ级息肉的术中术后出血率及术后复发率均显著低于SMSA Ⅳ级息肉[9]。这些研究均说明对于直径>20 mm的息肉,可用SMSA分级评估操作难度(见表1),从而对术前知情同意、术中密切监测及术后密切随访提供参考标准,还可据此更改更高效的治疗方式如ESD、外科手术等。

表1 息肉切除难度评分
对于直径<20 mm的息肉,钳除术、圈套器切除术和EMR的选择很大程度取决于内镜医师的偏好。一项纳入125枚直径10~25 mm息肉比较EMR与HSP完整切除率的前瞻性随机对照研究显示,EMR对于直径<19 mm的息肉即达到90%的完整切除率,但HSP对直径<14 mm的息肉才能达到90%的完整切除率[10]。但另一项纳入382枚直径5~9 mm息肉比较EMR与HSP完整切除率的前瞻性随机对照研究显示,HSP与EMR的完整切除率分别为88.4%和92.8%,两者比较差异无统计学意义(P=0.2);虽然HSP术中即时出血率较EMR高,但两者临床严重并发症发生率和组织回收率均无明显差别;在多因素回归分析中,仅病理类型是两种方法非完整切除的独立预测因素,其中锯齿状腺瘤/息肉或增生性息肉的非完整切除概率是普通腺瘤性息肉的近3倍[11]。另一项比较直径6~9 mm息肉切除效率的前瞻性临床试验显示,腺瘤性息肉中CSP的非完整切除率高于EMR,因此在直径<10 mm的息肉中EMR比CSP更有优势[12]。至于钳除术和圈套器切除术的比较,一项随机临床试验显示,CSP和CFP对直径<4 mm腺瘤的完整切除率比较差异无统计学意义,但对于直径5~7 mm的腺瘤性息肉,CSP具有更高的完整切除率[13]。然而以上对直径<20 mm的息肉行内镜切除的研究只关注了息肉大小对完整切除率的影响,忽略了息肉形态、部位对切除方式选择的重要性,因此仍需开展更多深入的对比研究进一步探讨有关问题。
2.2 一次性整块切除
能否实现一次性整块切除(en-bloc)是内镜切除方法选择的另一个重要依据。在EMR中,通过分片而非整块完成内镜切除的治疗方式称为内镜下黏膜分片切除术(endoscopic piecemeal mucosal resec⁃tion,EPMR)。分片切除的缺点在于增加病理评估难度,分片越多,越难评估病灶的边缘是否实现完全切除,从而很难评判是否达成治愈性切除,是否需要追加后续治疗,进而耽误治疗时机。既往研究表明,分片切除的复发风险在14%~20%[14],远高于en-bloc。Belderbos等[15]的Meta分析显示,分片切除是EMR术后复发的唯一独立危险因素。因此,内镜医师应充分了解圈套器的型号特点,尽量避免分片切除病灶。此外,有研究报道直径>20 mm侧向发育型息肉EMR术后应用圈套器头端热烧灼创面边缘,术后初次随访复发率为5.2%,较仅行EMR术的对照组(21.0%)显著降低[16]。因此,对于切除较大息肉或EPMR后,辅助热烧灼创面边缘不失为降低复发率的一种补救措施。相比EMR,ESD具有更高的en-bloc率,但手术并发症多[17],对内镜医师操作水平要求也更高[18]。
3 内镜切除新技术
为了在整块切除的基础上降低手术难度、减少并发症,在EMR和ESD基础上,一些内镜治疗的辅助手段及改良术式逐步得到推广。
3.1 水下内镜下黏膜切除术( underwater EMR,UEMR)
传统EMR(conventional EMR,CEMR)利用气体(空气或二氧化碳)充盈肠腔,即便有黏膜下注射液体形成“水垫”来隔绝热传导损伤,仍有穿孔、电凝综合征等并发症的报道。UEMR则是利用水充盈肠腔,使得病灶在浮力作用下远离固有层,无需行黏膜下注射液体即可实现电圈套完整切除,该术式设计初衷在于减少并发症的发生。然而,一项Meta分析统计了7篇CEMR和UEMR的对比研究,发现对于直径>20 mm的结直肠息肉,UEMR拥有比CEMR更高的en-bloc率和更低的复发率,两者在术后出血或穿孔的发生率方面反而没有明显的差异[19]。在直径10~20 mm的锯齿状息肉中,UEMR同样具有更高的R0切除率和完整切除率[20]。UEMR想要成为主流技术还缺乏足够的研究证据支持,尤其是在减少并发症方面。由于UEMR无需进行黏膜下注射,对于黏膜下纤维化严重无法实现黏膜下注射的病灶,UEMR或许能成为替代选择之一。UEMR和CEMR操作示意图见图1。

图1 UEMR和CEMR操作示意图(图片引用自参考文献[20])
3.2 电刀辅助圈套切除术
混合ESD(hybrid ESD)、预切开EMR(precut EMR)统称电刀辅助圈套切除术(knife assist⁃ed snared resection,KAR),即在病变周围行黏膜下注射使病变隆起后,沿病变周围切开黏膜,伴或不伴有黏膜下层的剥离,最终应用圈套器完整圈套切除病变的方法。该方法降低了ESD操作难度且节省了操作时间。Bae等[21]发现,对于直径>20 mm的病变,混合ESD的平均操作时间为27.4 min,较传统ESD的40.6 min显著缩短,且完整切除率和并发症发生率无明显差异,其中5例无法完成传统ESD的病灶有4例可改用混合ESD达到完整切除。另外,对于直径>20 mm伴有黏膜下纤维化的病变,KAR有效、安全,且具有较低的复发率(16%)[22]。Lee等[23]比较了EMR、预切开EMR和ESD对于直径>20 mm息肉的切除效率,发现en-bloc率分别为32.9%(EMR)、59.4%(预切开EMR)和87.6%(ESD),穿孔率分别为2.9%(预切开EMR)和8%(ESD),复发率分别为25.9%(EMR)、3.2%(预切开EMR)和0.8%(ESD)。该研究虽不是随机对照研究,仍说明了预切开EMR的en-bloc效果优于EMR,次于ESD。关于EMR、KAR、ESD的疗效比较研究仍缺乏足够的随机临床对比试验,值得进一步关注与探讨。
3.3 牵引技术
结肠ESD操作难度大,并发症多,很大程度在于剥离过程中黏膜下层暴露困难,因此促成发展了多种牵引辅助技术,包括:夹子—黏膜瓣法(clipflap method)[24]、夹子—线牵引法(clip-thread traction method)[25]和“S-O”夹牵引法(S-O clip method)[26]等,这些牵引辅助技术均在ESD治疗中起到暴露视野更充分、缩短手术时间的作用。一项随机对照研究比较了传统ESD和夹子—线牵引辅助ESD(traction-as⁃sisted colorectal ESD using a clip and thread,TACESD)的临床疗效,研究结果显示,TAC-ESD可以缩短手术时间,传统ESD组的手术时间为70 min,TAC-ESD组手术时间缩短至40 min[27]。TAC-ESD是利用夹子将线固定在病灶一角,通过牵引线对病灶起到提拉作用,从而更好地暴露病灶下方的黏膜下层。TAC-ESD操作示意图见图2。

图2 TAC-ESD操作示意图(图片引用自参考文献[27])
3.4 口袋法ESD
口袋法(pocket-creation method,PCM)最早于2014年由Hayashi等[28]提出,它的主要特点是先作一个较小的黏膜切开,从黏膜切开处建立一个较大的黏膜下层口袋,然后在内镜头端装上小口径透明帽,在口袋中利用重力作用逐步完成黏膜下层的剥离至病灶的边缘,最终完成病灶的完整切除。该操作设计的目的与牵引辅助法类似,都是为了实现充分的视野暴露。一项纳入5个研究的Meta分析比较了PCM-ESD和传统ESD的临床疗效,结果显示PCM-ESD与传统ESD的R0切除率、en-bloc率和并发症发生率分别为93.5%vs.78.1%、99.8%vs.92.8%、4.4%vs.6.6%,且PCM-ESD操作时间更短,剥离速度更快[29],充分显示了口袋法的优越性。PCM-ESD操作示意图见图3。
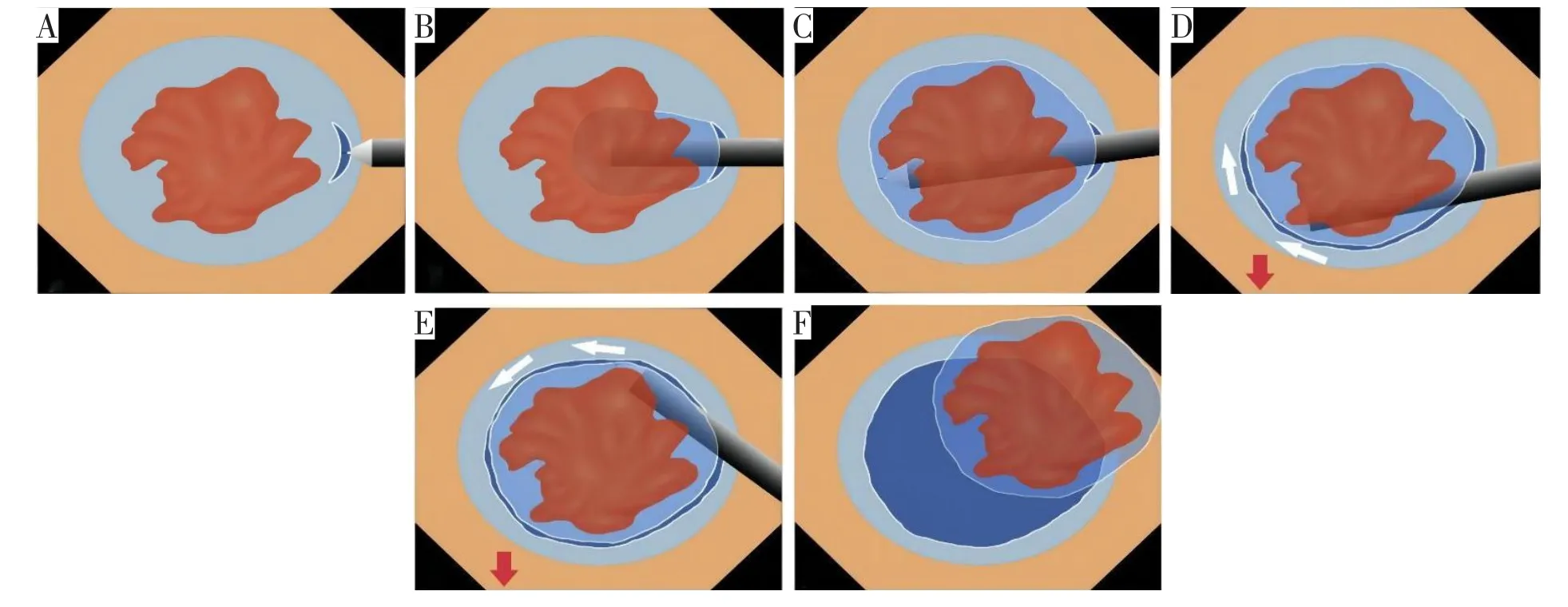
图3 PCM-ESD操作示意图(图片引用自参考文献[29])
综上所述,EMR和ESD仍是大部分早期结直肠癌及癌前病变的标准治疗方法,切除成功率高且具有可接受的并发症发生率。为了提高切除成功率、降低复发率,应根据病变的大小、形态、部位等,本着en-bloc的原则,选择最恰当的内镜切除方法,尽量避免分片切除。此外随着内镜技术的创新与发展,在EMR和ESD基础上,内镜治疗辅助手段越来越丰富,也越来越完善,从而提高了EMR和ESD的有效率和安全性,进而为降低结直肠肿瘤的死亡率、提高患者生活质量提供保障。尽管内镜治疗能治愈大部分的早期结直肠癌及癌前病变,仍应当做好对患者的随访宣教,方能真正达到预防结直肠癌的目的。
利益冲突声明 全体作者均声明不存在与本文相关的利益冲突。
