环状脂肽的结构多样性及结构改造策略
2022-01-10胡仿香刘雨悦
胡仿香,刘雨悦,李 霜
(南京工业大学生物与制药工程学院,江苏南京211800)
脂肽(lipopeptides)是由芽孢杆菌属微生物产生的次级代谢产物,按其结构特征,大致可分为环状脂肽(cyclic lipopeptides,CLPs)与线性脂肽两类[1]。其中,关于线性脂肽的报道有螺旋形素(spiroidesin)及TAN 1511 系列[2],环状脂肽是主要的脂肽形式。在环状脂肽分子中,有疏水的脂肪酸链和亲水的肽链,其显著特征在于由内酯键或酰胺键构成的肽环,主要包括表面活性素(surfactins)、伊枯草菌素(iturins)和芬介素(fengycins)这3类家族,其中,表面活性素家族具有很好的表面活性,在石油化工等领域具有广泛的应用前景[3-4],而伊枯草素和芬介素家族具有很好的抗菌活性,可用于食品、医药等领域[5]。
近年来,环状脂肽的研究主要可分为3个方向:发酵优化、菌株改良及结构改造。发酵优化研究主要涉及pH、温度、搅拌速度、供氧、培养基组分和生物反应器设计[6-7]。随着合成生物学的发展,菌株的理性设计及改良也逐渐成为研究热点[8-9],主要包含关键基因的启动子改造、基因敲除及表达强化等手段促进环状脂肽的合成。环状脂肽的结构改造主要包含肽环结构修饰和脂酰基结构修饰两部分,分子结构改造及修饰对其物理活性和生理活性具有显著影响[10]。
本文重点讨论脂肪酸前体参与脂肽合成的机制及支链氨基酸与支链脂肪酸对环脂肽结构的影响,总结环状脂肽的结构修饰策略,以期推动新型脂肽结构的开发与研究。
1 环状脂肽的结构多样性及性质
环状脂肽根据成环方式的不同可以分为surfactins、iturins和fengycins三大家族(图1),其中,surfactins家族的肽环含有7个氨基酸,脂酰基结构为C13~C15的β-羟基脂肪酸,肽链末位氨基酸的羧基与脂肪酸链上的β-羟基通过内酯键连接成环[11]。由于肽环上1、2、4和7位氨基酸的变化,surfactins家族又被划分为表面活性素(surfactin)、地衣芽孢杆菌素(linchenysin)和短小芽孢杆菌表面活性剂(pumilacidin)三大类。Iturins的肽环同样含有7个氨基酸,脂酰基结构为C14~C17的β-氨基脂肪酸,脂酰基上的β-氨基与肽链末位氨基酸的羧基以酰胺键成环。由于6、7位氨基酸的变化,Iturins家族又被细分为伊枯草菌素(iturin)、抗霉枯草菌素(mycosubtili)和杆菌霉素(bacillomycin)三类。Fengycins的多肽部分是由10个氨基酸构成的,其肽环通过第3位的 L-酪氨酸和末位的 L-异亮氨酸以内酯键结合而成,肽段的 N 端与长度为C14~C18的β-羟基脂肪酸链相连构成疏水尾部[12-13]。Fengycins中芬介素(fengycin)和大侧柏素(plipatatin)的产生主要是由于1,2和4位置上氨基酸的变化而得[14-15]。

图1 环状脂肽三大家族的分子结构式Fig.1 Structures of the three lipopeptide families
由于脂酰基的长度和构型不同,每一种脂肽分子产生了许多异构体。脂肪酸链具有不同的支链形式,根据构型可以分为iso-、anteiso-和straight(n)-(图2),且由于芽孢杆菌脂肪酸从头合成起始步骤对支链脂肪酸的偏爱性,芽孢杆菌产生的脂肽中,脂酰基结构绝大多数为支链脂肪酸形式存在[16]。目前已经表征出来的含支链脂肪酸的surfactin、 bacillomycin和fengycin在各自的总量中都占据主导地位[10,17-18]。

图2 脂肪酸的不同构型Fig.2 Various configurations of fatty acids
这些结构特征上的差异使得各种环脂肽的功能也具有显著差异。Surfactins具有更强的表面活性,iturins具有很好的抗真菌活性,而fengycins则具有比iturins更好的抗真菌活性[19]。除此之外,Bonmatin等[20]发现,当surfactin的肽环组分上第4位由L-Val变成L-Ile的时候,其临界胶束浓度(CMC)值降低一半,但界面稳定性显著提高。Dufour等[21]发现,当surfactin的内酯键结构被破坏时,线性surfactin的溶血性、抗菌性和起泡性等都明显减低。在抗真菌活性和表面活性方面,脂肪酸构型为straight(n)-的surfactin强于iso-强于anteiso-,且链长越长,表面活性也越强[22]。
2 与结构多样性相关的合成途径
环状脂肽生物表面活性剂的结构多样性主要取决于肽段结构和脂酰基结构的合成。肽段结构的合成主要取决于非核糖体肽合成酶(NRPS)和聚酮合成酶(PKS) -非核糖体肽合成酶杂合体系 (PKS-NRPS);而脂酰基结构的合成主要与支链脂肪酸前体的合成以及NRPS、PKS/NRPS的识别有关,其中还涉及支链氨基酸前体的合成。
2.1 非核糖体肽合成酶与结构的关联性
Surfactins、fengycins和iturins的多肽部分都是由NRPS负责合成,NRPS是多功能模块组装的多酶复合体[23]。一个基本的NRPS延伸模块至少包含3个基本结构域:腺苷酸化结构域(A)、肽基载体蛋白结构域(PCP)(也被称为硫醇化结构域(T))和缩合结构域(C)。A域用于识别氨基酸底物并将其激活为氨酰基-腺苷酸, 在辅因子4′-PP的作用下,PCP(T)域上的巯基与氨酰腺苷酸结合,形成氨酰载体复合体,并在该结构域的作用下被传送到C域,与前一个模块的肽链相连接。有的模块还会有一个差向异构酶结构域(E),其作用是将被激活的 L-氨基酸转化为 D-氨基酸。NRPS的末端模块通常具有硫酯酶域(TE),该域参与环化和产物释放[24]。Surfactin、fengycin和iturin的合成酶基因簇如图3所示,其中,负责surfactin合成的基因簇包含3个编码基因srfAA、srfAB和srfAC,srfAA和srfAB负责前6个氨基酸的整合,而srfAC负责最后1个氨基酸的整合。与surfactin合成基因簇类似,编码fengycin合成酶的基因主要包含fenC、fenD、fenE、fenA和fenB这5个基因。不同于surfactin和fengycin,iturin是通过杂合体系 PKS-NRPS合成的[25],后3个基因ituA、ituB和ituC负责编码合成iturin肽环结构的NRPS,位于基因簇最上游的ituD负责编码脂酰基结构前体合成有关的丙二酰辅酶A转酰酶(MCT domain),ituA的部分基因也参与编码脂酰基结构合成相关的聚酮合成酶[26]。由此可见,脂肽的肽环结构主要取决于NRPS,其氨基酸多样性也主要与该模块A域对氨基酸底物的专一性有关。

图3 Surfactin、fengycin、plipastatin和iturin的合成酶基因簇Fig.3 Operons of surfactin,fengycin,plipastatin and iturin synthases
2.2 脂肪酸链的合成相关途径
环脂肽中的脂酰基结构与细胞中的脂肪酸前体密切相关。由于枯草芽孢杆菌中负责脂肪合成起始的3-酮脂酰ACP合成酶Ⅲ(FabH)对支链脂酰-CoA 前体具有高选择性和高活性,使其在枯草芽孢杆菌中能大量合成支链脂肪酸[27];Youssef等[10]研究发现,带有支链脂肪酸的脂酰基结构在所有芽孢杆菌属产的脂肽中占主导地位。因此,支链脂肪酸的合成对于环脂肽的合成及结构都具有十分重要的意义。支链脂肪酸的合成与支链氨基酸的代谢密切相关[28],如图4所示,异亮氨酸、缬氨酸和亮氨酸在支链氨基酸脱氢酶复合体的作用下会降解为相应的支链脂酰CoA:α-甲基丁酰CoA、异丁酰CoA和异戊酰CoA,这些支链脂酰CoA就是支链脂肪酸的合成前体,这些前体先与丙二酰-ACP在FabH的作用下缩合为相应的脂酰-ACP;紧接着,这些脂酰ACP前体进入脂肪酸的生物合成循环,生成相应的支链脂肪酸:anteiso-奇数脂肪酸、iso-偶数脂肪酸和iso-奇数脂肪酸[8,29-30]。由此可见,支链氨基酸是通过酶系降解为不同的支链脂酰CoA,从而参与到支链脂肪酸的合成中。Dhali等[22]通过敲除支链氨基酸降解途径中相关基因,使得芽孢杆菌中的支链脂肪酸合成严重受阻,从而进一步影响了surfactin中支链脂肪酸的组分。

图4 支链氨基酸的代谢与支链脂肪酸的合成Fig.4 Metabolism of branched-chain amino acids and synthesis with branched-chain fatty acids
脂肪酸参与surfactin的合成是通过以下步骤进行的:①游离脂肪酸在脂肪酸β羟基化细胞色素酶和长链脂肪酸CoA连接酶的作用下,生成羟基化脂肪酰CoA;②羟基化脂肪酰CoA被surfactin合成酶基因簇的第一个C域所识别,从而参与到surfactin的合成中,且C域对脂肪酸链长的识别具有专一性,特异性识别C13~C15的链长,这也是surfactin脂肪酸链长有局限性的原因[31-32]。脂肪酸参与iturin的合成主要是由iturin合成酶基因簇上的ituA基因负责的:①脂肪酸被长链脂肪酰基AMP连接酶 (FAALs)活化为酰基-腺苷酸酯;②酰基-腺苷酸酯与辅酶CoA反应形成酰基-CoA硫酯中间体,由酰基连接酶(AL)负载到酰基载体蛋白1(ACP1)上,丙二酰辅酶A通过MCT负载到酰基载体蛋白2(ACP2)上,两者通过酮合酶(KS)结构域缩合得到一个被AMT结构域还原胺化的α-酮硫酯;③α-氨基脂肪硫酯通过缩合(C)和肽基载体蛋白(PCP)传递到ituA的NRPS结构域上[33]。关于脂肪酸是如何参与到fengycin合成中的研究还没有详细报道,但是由于fengycin的结构及合成酶簇与surfactin十分相似,因此推测脂肪酸参与fengycin的合成过程也大致相同。
3 环脂肽分子的结构修饰策略
随着分子生物学技术的发展,目前许多研究开始致力于修饰环脂肽的结构,以期产生新型脂肽。环脂肽的结构修饰包括两个方面:一方面是针对肽环的改造,另一方面是对脂酰基构型的改造。通过基因工程技术,有目的地改变与环脂肽结构相关的合成途径,形成可预测的新结构产物,这些人为产生的新结构化合物表现出新的功能或活性。
3.1 具有不同肽环结构的新型环脂肽
在脂肽分子中,肽结构部分的序列通常与NRPS模块和结构域的线性排列一致。理论上,这种结构能够通过基因片段的重组产生肽结构的衍生物阵列。因此,通过合理设计NRPS模块就可以获得丰富的脂肽多样性。目前,肽环结构的修饰主要是对NRPS基因簇中负责识别氨基酸专一性的结构域或模块进行点突变,结构域或模块被指定不同底物的替代物和/或模块的插入/缺失引起的相关模块进行定点突变、删除、替换、插入和模块“洗牌”[34]。
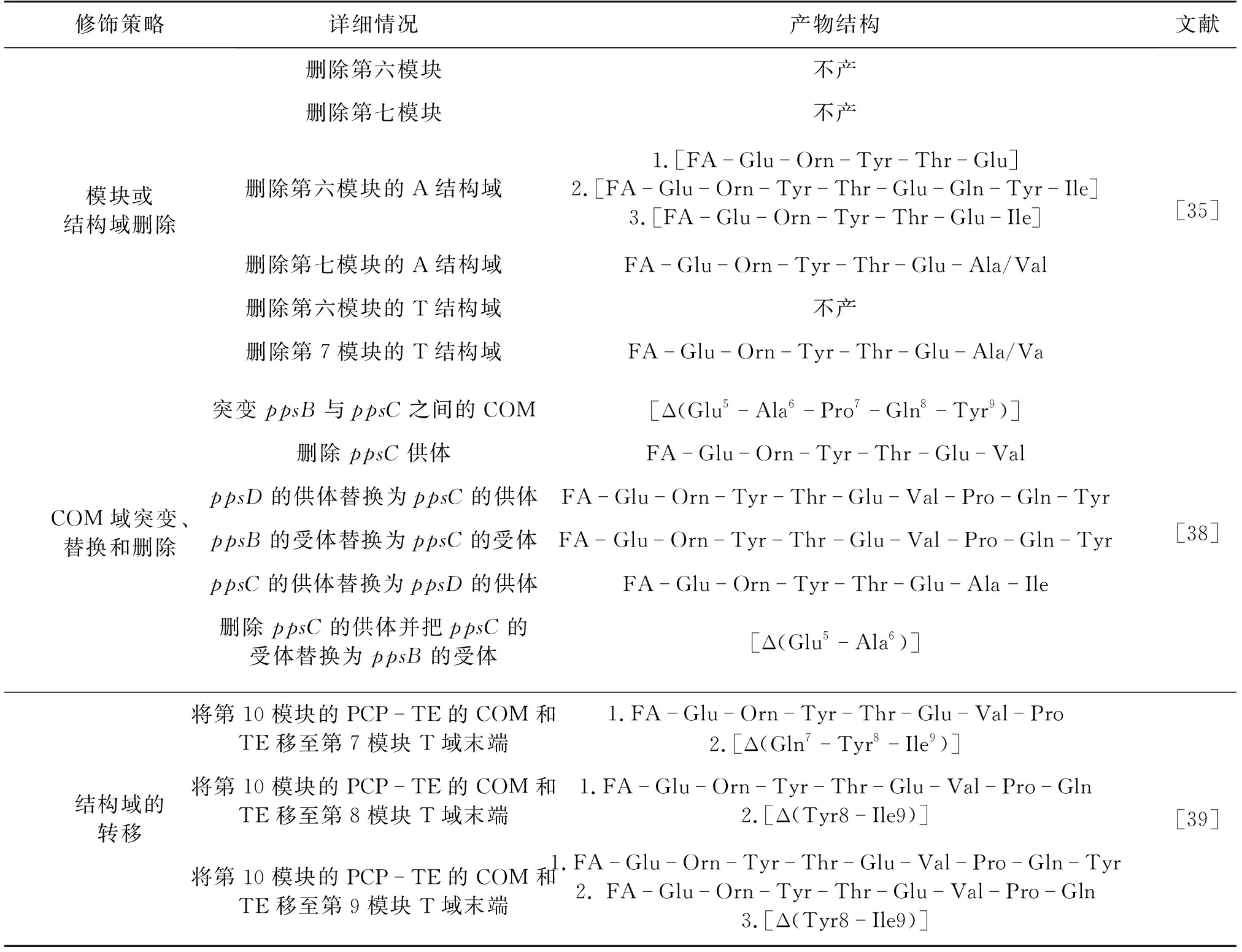
表1 改造B. subtilis BP2-L1菌株获得肽环修饰的新型plipastatin
目前,关于脂肽sufactin和plipastatin的肽环结构研究比较多,且关于surfactin肽环结构的修饰策略已有详细阐述,主要包含模块的突变、替换和删除这3种手段。文献[8]对surfactin肽环结构改造进行了较为全面的总结,新型surfactin通常有更低的溶血活性和更高的抗菌活性,但是新结构产物在细胞中的合成量也严重受损。
目前,针对fengycins家族的肽环结构修饰研究也有报道,其中对B.subtilisBP2-L1菌株中plipastatin的结构研究最为丰富,如表1所示。Gao等[35]对脂肽plipastatin的NRPS合成酶相关模块和结构域进行删除后,产生了一系列plipastatin衍生物,结果发现,整个模块的删除往往会导致整个酶复合物的失活,从而导致plipastatin不能合成,而不同结构域的删除却会产生不同的结果:例如,当整个模块6和模块7被删除时以及第六模块的单个结构域T缺失时,菌株丧失了合成plipastatin的能力;当模块7中的单个结构域(A/T结构域)缺失时,造成了NRPS合成装配线的截断,导致线性六肽的产生;当第六模块的单个结构域A缺失时,通过模块跳跃机制(module-skipping mechanism)产生多条装配线,导致了3种新型脂肽(线性五肽、六肽和八肽)的产生。
除了对常规结构域的修饰,还有一些研究主要是针对linker,即信息介导域(COM)结构域的修饰。COM结构域是在NRPS合成酶中结构域与结构域之间存在的一段具有特殊序列的肽段,它确保了各个结构域、模块以及结构域与模块之间的信息交流,从而保证NRPS合成的连续性,且这种作用的关键在于COM的供体和受体[36]。不同COM具有不同的选择性,这种选择性是特定肽产物的合成基础。Chiocchini等[37]也通过COM域交换实验证实了COM域在模块之间的控制作用,且进一步发现,当打破COM结构域的选择性时,可以合成不同的脂肽产物。Liu等[38]通过改造芬介素家族plipastatin中的COM结构域,进一步证实了COM结构域对于合成新型脂肽的重要意义,通过点突变、供体删除、置换以及删除和置换这4种策略成功获得了5种新型脂肽:环状五肽,线性六肽、九肽、七肽和环状八肽(表1),且新型脂肽具有很好的抗真菌活性。除此之外,Gao等[39]还通过将plipastatin合成酶基因簇C端TE域移至其他模块PCP域,进一步证实了COM域在脂肽合成中的重要性,结果发现,只有采用第10模块的PCP-TE的COM作为TE域与其他PCP域连接时,重组菌才能成功地产生可预测的截短的环状或线性脂肽,反之则不能;但是,重组菌产的新型脂肽产量相当低,普遍低于10 mg/L。
由此可见,在改造sufactin和plipastatin的肽环结构时,产生的新型化合物虽然有更好的抗菌活性,但是往往会造成不产和产量极低的情况,因此,通过改造NRPS的组装线来实现脂肽结构和功能的多样性充满了挑战性。NRPS作为一个复杂而又精致的分子装配机器,各模块、结构域及链接区之间功能联系的复杂性导致了实际操作结果的不理想。不过,值得借鉴的案例是,Beer等[40]在改造负责蓝色颜料靛蓝合成的NRPS时发现,用高度同源性的不改变活性中心位点的人工合成T结构域替换天然T结构域可以显著提高靛蓝产量。这表明,实现NRPS酶系的真正组合生物合成必须充分地认识每个结构域并进行合理的设计来确保NRPS模块、域或亚域的变化不会对合成过程产生有害影响。
3.2 脂肽的脂酰基结构的改造
脂肽的脂酰基结构与脂肽的物理化学性质和生物活性紧密相关,目前关于脂酰基结构改造的研究相对较少。脂酰基的结构多样性主要体现在脂肪酸的链长以及脂肪酸的构型。一方面,脂肪酸的链长明显会影响iturin家族的抗菌活性和surfactin家族的表面活性:脂肪酸链越长,iturin家族bacillomycin和mycosubtilin的抗真菌活性越强,surfactin的表界面活性显著增强[10,41];脂肪酸的链长对脂肽的发泡能力也有影响,脂肪链为C14的surfactin的发泡能力强于C13和C15的[22]。另一方面,脂肪酸的构型对脂肽的抗真菌活性和表面活性也有影响,构型性能强弱顺序(从大到小)为straight(n)-、iso-、anteiso-。构型的占比不同对脂肽的活性也有很大的影响,当lichenysin中支链构型增多时,表面活性明显降低;反之,则表面活性增高[42]。Liu等[43]的研究结果也表明:surfactin的脂酰基结构差异对其在微生物采油(MEOR)中的应用效果有显著影响;在同等工作浓度下,脂肪链为C15的surfactin组分含量越高,其对油砂清洗效率和原油驱替效率越高。因此,通过对脂肽的脂酰结构改造,有可能获得具有特殊理化性质及生物活性的新结构化合物,促进脂肽在表面活性剂和抗菌等领域的应用。
尽管脂肪酸前体对脂酰基结构的合成具有重要影响,但是向培养基中添加油脂或游离脂肪酸并不能促进脂肽的合成,反而起抑制作用[44];而添加氨基酸却可以使脂肽的脂酰基结构和产量发生明显变化[45]。Liu等[46]发现,向B.subtilisT89-42菌株的培养基中添加Arg、Gln时,可以增加surfactin的偶数β-羟基脂肪酸组分(C14、C16),而添加Cys、His、Met、Ser或Thr可以增加奇数β-羟基脂肪酸组分(C13、C15);除此之外,他们还发现添加支链氨基酸会引起更显著的脂酰基结构变化:添加L-亮氨酸(L-Leu)会明显增加产物中iso-奇数脂酰基组分的占比;添加L-异亮氨酸(L-Ile)会增加产物中anteiso-奇数脂肪酰基组分的占比;而添加L-Val则会增加iso-偶数脂酰基组分的占比。笔者所在课题组的研究结果[47-48]证明了支链氨基酸添加对surfactin合成及组分占比具有显著影响,并进一步揭示了不同的支链脂肪酸(异丁酸、异戊酸与2-甲基丁酸)对最终surfactin组分占比的影响。
近年来,通过代谢工程手段改造支链氨基酸合成途径来促进surfactin合成或改变surfactin脂酰基组分成为研究热点。Coutte等[29]通过敲除支链氨基酸合成途径的负调控因子codY使得支链氨基酸L-Leu的合成能力增强,最终不仅让surfactin的产量达到最高,还使得surfactin的结构组分发生了变化:对照菌株中C13和C14的组分分别是39.7%和21.2%,而敲除了codY后的这一比例分别为26.5%和40.6%。后来,他们在此基础上敲除了负责支链氨基酸最后一步降解的基因lpdV后,带有直链C14的surfactin产量提高了2.5倍[22]。
显而易见,通过外源添加氨基酸或内源改造氨基酸代谢途径还是不能突破surfactin脂酰基结构的局限性,不能定向合成特定的构型和链长的脂酰基结构。因此,探究脂肪酸前体参与脂肽合成的机制并打破脂酰基底物识别的局限性具有重要意义。笔者推测,通过解析surfactin合成起始模块C域的底物脂肪酸选择机制及对底物识别的关键活性位点,有可能构建出能催化特殊结构脂酰基底物的起始模块,从而获得新型surfactin。而对iturin脂酰基结构改造的关键节点在于AL-ACP1结构域,ACP1可以承载多种脂肪酸底物,改造脂酰CoA连接酶FACLs和起始模块ACP域的底物选择性,有望获得基于PKS/NRPS合成的新型天然产物。关于fengycins家族的脂酰基合成机制目前没有详细报道,仍需进一步研究,可从以下两个方面入手:第一,找到不同的脂肪酸CoA连接酶,通过基因敲除的手段验证脂肪酸CoA连接酶对于fengycin合成的影响;第二,解析起始模块中C域对不同脂肪酸的偏爱性。
4 前景展望
芽孢杆菌属产生的环脂肽次级代谢产物,由于具有多种功能活性,在环境、农业和MEOR等领域都有很好的应用前景。然而,由于生产成本高和易发泡等问题,目前关于脂肽的研究还普遍处于实验室水平,不能达到工业化生产规模。为了解决这两个问题,一方面,可以参考之前关于surfactin合成途径改造策略:利用基因工程模块化改造前体供应模块,中间转录调控模块及外排和提高自身耐受性模块来获得高产的优良菌株。另一方面可以通过生产工艺,如固定化培养、无泡反应器设计及调节供氧水平解决脂肽发酵过程中的泡沫溢出问题。
除了以上两点外,未来关于脂肽的研究重点还会集中在脂肽的结构改造上。由于微生物合成的环脂肽家族产物均为各种结构组分的混合物,且不同结构组分的性质有所差别,因此,通过定向改造获得特定组分或新型结构的脂肽产物,有助于适应特定目标和拓展脂肽的应用领域。随着NRPS的结构解析以及组合生物合成技术在NRPS结构改造中的应用,定向改造脂肽的肽环结构部分会获得强大的技术支撑。目前,关于脂肽结构改造的瓶颈主要包含肽环结构改造后的目标产物产量极低及脂酰基结构仍然缺乏可靠的调控手段两方面。当前,解决肽环修饰带来的低产问题及找到更好的定向修饰脂酰基结构的方法,是未来脂肽结构改造需要突破的核心问题。
