蓝藻泥释放藻蛋白及藻渣应用于培养芽孢杆菌
2022-01-10史琳琳吴剑荣詹晓北
史琳琳,王 犇,吴剑荣,刘 和,詹晓北
(1. 江南大学生物工程学院, 江苏无锡214122;2. 江南大学环境与土木工程学院,江苏无锡214122)
蓝藻是对我国现有水体造成严重污染的一种水生原核生物。由于水体富营养化,蓝藻水华频频爆发,严重影响我国水体生态文明和饮用水安全。蓝藻治理一直是世界难题,目前我国蓝藻治理主要以打捞为主。以无锡为例,据统计,2007—2009年,无锡市共打捞蓝藻140万t[1],2017年打捞近1 179万t,蓝藻暴发时,每天打捞量达数千吨,这些打捞的蓝藻,如果不及时妥善处理,蓝藻腐烂、渗透会造成二次污染[2]。实际上,蓝藻含有丰富的营养物质[3-5],其干物质中主要含有40%~60%的蛋白质和18%~25%的多糖类物质,且藻蓝蛋白是天然色素,在化妆品、食品[6-8]以及生物、医药行业应用广泛[9-12],具有显著的资源化利用潜力。
蓝藻泥资源化利用领域主要有发酵产沼气[13-16]、堆肥发酵[17-18]和生物塑料[19]等。由于蓝藻含氮量高、有腥臭味以及潜在的藻毒素安全隐患等问题,导致蓝藻泥资源化成本高、推广困难。虽然可利用反复冻融法、超声波法、有机溶剂萃取法等[20-22]方法从蓝藻中提取藻蓝蛋白,但这些方法能耗高,且提取后的蓝藻藻渣在处理方面存在安全隐患,易造成二次污染,所以实际的应用并不多。芽孢杆菌因能产高活性的蛋白酶、脂肪酶等产品,所以其具有保护土壤、促进有机质的分解、产生丰富的代谢物和抑制有害菌等作用,在水产、家禽等养殖业中以及环境治理领域有非常广泛的应用[23-24],同时在生物降解蓝藻及藻毒素方面也有显著的效果[25-26]。因此,为了高效资源化利用蓝藻,同时避免环境污染,亟须开发新型的蓝藻资源化技术。
本文针对蓝藻含有丰富有机质的特点,将低成本的蓝藻泥进行高压均质处理,破碎蓝藻细胞以释放蛋白质,再将废弃物——蓝藻藻渣与麦麸、秸秆等廉价物质混合,用于培养枯草芽孢杆菌和地衣芽孢杆菌并制成生物菌剂,以期达到综合利用蓝藻的目的。
1 材料与方法
1.1 试验材料
所用蓝藻泥均是2018年5月份中下旬在无锡太湖黄泥田打捞站打捞的新鲜蓝藻泥(含水率为90%~95%),4 ℃冰箱保存。
枯草芽孢杆菌(ATCC14579),笔者所在实验室保藏;地衣芽孢杆菌(CICIM B0109(T)),江南大学中国高校工业微生物平台(原始菌源自ATCC 14580)。
麸皮,市售;藻毒素标品,国家标准物质网;甲醇色谱级、蛋白测定用BCA增强型试剂盒,上海碧云天生物技术有限公司。
LB液体培养基:酵母提取物5.0 g、胰蛋白胨10.0 g、NaCl 10.0 g、纯净水1.0 L,NaOH调pH至7.2左右。
LB固体培养基:在1.0 L LB液体培养基中加20 g琼脂粉。
蓝藻固体培养基:将蓝藻破碎后收集的藻渣(含水率90%)与麸皮按质量比55.5∶44.5混合均匀,121 ℃高压蒸汽灭菌30 min。
1.2 试验方法
1.2.1 蓝藻泥的细胞破碎处理
将新鲜蓝藻泥与去离子水混合均匀,过0.15 mm的分子筛,并用去离子水洗涤分子筛,加水将稀释后的蓝藻泥配制成总固体含量(TS)分别为1.6%、2.9%和3.6%(质量分数)悬液后,分别在80 MPa下用高压均质机进行细胞破碎,循环管路5次,收集破碎后的蓝藻细胞溶液,用显微镜观察蓝藻细胞在均质前后变化。
为探究不同方法对蛋白质释放的影响,取部分蓝藻溶液按照以下方式处理并进行蛋白分析:
①未经过破碎处理的蓝藻溶液以8 000 r/min低温离心10 min,上清液作为对照溶液;②均质后的蓝藻溶液以8 000 r/min低温离心10 min,上清液记为CV;③均质后的蓝藻溶液在功率为400 W的超声波清洗机内超声30 min后,8 000 r/min低温离心10 min,上清液记为CVU;④均质后的蓝藻溶液-40 ℃冷冻12 h,8 000 r/min低温离心10 min,上清液记为CVF;⑤均质后的蓝藻溶液先在超声波清洗机内超声30 min,再-40 ℃冷冻12 h,8 000 r/min低温离心10 min,上清液记为CVUF;⑥将其他大量破碎后的蓝藻溶液在4 500 r/min低温离心15 min,收集固体藻渣,混合均匀后,-4 ℃冰箱保存备用。
1.2.2 蓝藻破碎液蛋白分析
采用凯氏定氮法分析不同TS的蓝藻溶液中的总蛋白;蓝藻破碎前后的上清液中可溶性蛋白质的检测则采用BCA试剂盒法。可溶性蛋白浓度及蛋白质释放率按式(1)~(2)计算。

(1)

(2)
式中:n为稀释倍数。
藻胆体浓度的测定则通过紫外可见分光光度计测其破碎液在620、652和562 nm这3处的吸光度A,并以蒸馏水为空白对照,式(3)~(6)分别计算蓝藻上清液中藻蓝蛋白(PC)和别藻蓝蛋白(APC)、藻红蛋白(PE)和藻胆体浓度[27-28]。
(3)
(4)
(5)
ρ(藻胆体)=n(ρ(PC)+ρ(APC)+ρ(PE))
(6)
1.2.3 蓝藻破碎液的电泳分析
使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析蓝藻破碎前后蛋白质[29],配制12%的聚丙烯酰胺凝胶,取经高速离心后TS为3.6%的蓝藻细胞破碎上清液30 μL与10 μL 4×Protein SDS PAGE Loading混合均匀,沸水浴10 min,10 800 r/min离心2 min后,取上清液20 μL进行电泳,先用80 V恒压进行电泳,当蛋白跑到分离胶与浓缩胶边界时,将电压调高到150 V,电泳结束后用考马斯亮蓝R-250染色,并用脱色液进行脱色处理。
1.2.4 固态发酵
挑取已活化的枯草芽孢杆菌和地衣芽孢杆菌单菌落接入LB液体培养基,于37 ℃、200 r/min摇床生长至对数期,将得到的枯草芽孢杆菌和地衣芽孢杆菌种子液按20 g/L的接种量接入TS为47%的蓝藻固体培养基上,37 ℃静置培养,每隔12 h翻动一次。
1.2.5 蓝藻固态发酵过程中微生物的生长曲线
在发酵期间,分别在0~96 h取5 g样品进行活菌计数,微生物菌落计数参照文献[30]进行;将样品在105 ℃烘干至恒质量,测定发酵过程中培养基的含水率。
1.2.6 pH测定
准确称取10 g发酵干样品加入100 mL纯净水中,混合均匀,并用超声波清洗剂超声20 min,静置30 min后6 000 r/min离心3 min,用pH计测其上清液的pH[31]。
1.2.7 发酵过程中营养物质分析
采用凯氏定氮法测定发酵样品中的粗蛋白。准确称取发酵干样品0.500 g (精确至0.001 g),加入10 mL蒸馏水混匀,用T18DS25型分散机(无锡旭野科技有限公司)在12 000 r/min高速搅拌2 min,8 000 r/min离心10 min,上清液用BCA法测定其可溶性蛋白质含量。
精确称取1.000 g(精确至0.001 g)的未发酵样品和发酵60 h的样品,用5%三氯乙酸溶解并定容至25 mL,混合物常温超声处理20 min后静置2 h,用双层滤纸过滤,滤液以15 000 r/min离心30 min,上清液采用高效液相色谱-质谱(HPLC-MS)法分析其游离氨基酸组成[29]。
将上清液适当稀释,采用蒽酮硫酸法测其总糖含量,取1 mL上清液与4 mL蒽酮硫酸溶液混合均匀,沸水浴10 min,冷却至室温,在620 nm处测其吸光度A620。以蒸馏水为空白,根据葡萄糖标准溶液的吸光度计算发酵样品中的总糖含量。
灰分根据文献[32]测定。
1.2.8 藻毒素检测
采用HPLC-MS法测定样品中的藻毒素[33-34]。准确称取研磨粉碎后的发酵干样品5.000 g,溶解于10 mL甲醇溶液(80%),超声处理30 min后,8 000 r/min离心10 min,收集上清液。残渣重复提取2次,合并上清液并过滤。经C18固相萃取小柱(1 g,Waters公司)净化后,收集洗脱液并浓缩至接近干燥,加入1 mL甲醇溶解残留物,用有机相微孔滤膜过滤,进行HPLC-MS分析。
2 结果与讨论
2.1 蓝藻均质前后显微镜照片
蓝藻含有藻胆素(藻红素、藻蓝素和别藻蓝素的总称)及叶绿素a、无叶绿素b。通过显微镜观察蓝藻细胞在破碎前后形态结构变化来确定蓝藻细胞的破碎情况,结果如图1所示。由图1可知:未经过高压均质处理过的新鲜蓝藻细胞形态完整,呈蓝绿色;经过高压均质后的蓝藻细胞形态结构被破坏,成为细胞碎片,同时也说明高压均质机反复破碎可以较好地将蓝藻细胞破碎。
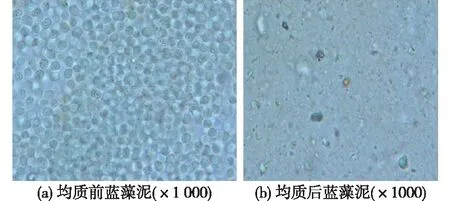
图1 均质处理前后蓝藻泥显微镜Fig.1 Microscopic observation of cyanobacteria before and after treatment with homogenization
2.2 蓝藻细胞破碎前后蛋白质的变化
蓝藻细胞破碎前后可溶性蛋白变化如图2所示。由图2可知:当TS为1.6%、2.9%和3.6%的蓝藻溶液经高压均质处理后,可溶性蛋白质质量浓度分别从1 176.8、1 752.0和2 276.8 mg/L增加到1 750.5、3 219.2和4 121.7 mg/L,对照溶液中含有较高的可溶性蛋白,主要是因为蓝藻胞外蛋白质以及蓝藻泥在藻水分离时,部分蓝藻受到涡旋离心机的损伤而释放的蛋白质;而CVU、CVF、CVUF中可溶性蛋白质浓度与CV相比,差别不大,说明超声、冷冻处理对均质处理后的蓝藻细胞破碎影响不大,并不能增加可溶性蛋白的释放量。
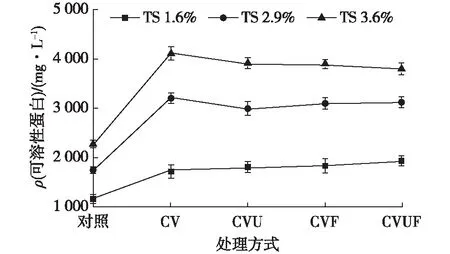
图2 蓝藻泥释放的可溶性蛋白的影响Fig.2 Effects of different treatment on soluble protein concentration from cyanobacteria sludge
图3为不同TS下蓝藻泥的蛋白释放率。由图3可知:不同TS蓝藻溶液(1.6%、2.9%、3.6%)经高压均质处理后,蛋白质释放率分别从13.1%、12.8%、12.4%增长为19.5%、23.5%、22.4%;TS为1.6%的蓝藻溶液在CV、CVU、CVF和CVUF中的蛋白质释放率缓慢增高,从18%增加到21%,而TS为2.9%和TS为3.6%的蓝藻溶液在CVU、CVF和CVUF中的蛋白质释放率比在CV中的偏低,总体变化不大。尽管蓝藻破碎处理后蛋白释放率不高,由于此时总蛋白为蓝藻泥溶液中所有含氮有机物的总和,并非都为可溶性蛋白,因此可以推断,反复均质能较好地破碎蓝藻细胞。

图3 蓝藻泥释放的蛋白释放率Fig.3 Effects of different treatment on protein release rate from cyanobacteria sludge
图4为不同TS的蓝藻上清液在不同破碎处理下的藻胆体的浓度变化。由图4可知:不同TS的蓝藻溶液在均质处理后,在CV中藻胆蛋白质量浓度可达到198.7 mg/L(TS为1.6%)、338.3 mg/L(TS为2.9%)、458.1 mg/L(TS为3.6%);在CVU、CVF、CVUF中的藻胆体浓度并未增加,反而有微量的减小,说明超声、冷冻处理并不能增加蓝藻的破碎度,这与上述关于反复均质能较好地破碎蓝藻细胞结构的假设相同。蓝藻破碎前后,溶液的颜色从绿色变为蓝色,TS越高,破碎后藻胆体浓度越高,则颜色越深,在光照下有明显的偏光性。

图4 蓝藻泥释放的藻胆体浓度Fig.4 Effects of different treatment on phycobilisome concentration from cyanobacteria sludge
藻胆蛋白是一类多亚基蛋白质,基本结构单元是α和β亚基,亚基的分子量大约为(1.7~2.2)×104,藻红蛋白分子量为5.0×104[35-36],均质处理前后蓝藻溶液SDS-PAGE电泳分析如图5所示。由图5可知:蓝藻细胞破碎液中的藻蓝蛋白主要集中在2.0×104附近;CV、CVU中的蓝藻蛋白液分子量条带分布一样,而CVF中5.0×104附近的颜色变浅,经CVUF处理后,大分子蛋白明显被降解,说明冷冻处理对蓝藻蛋白有一定的降解作用,这与王水晶[37]研究结果一致。由此可见,超声、冷冻处理对反复高压均质处理后的蓝藻泥破碎液中的蛋白质释放并没有增强作用。
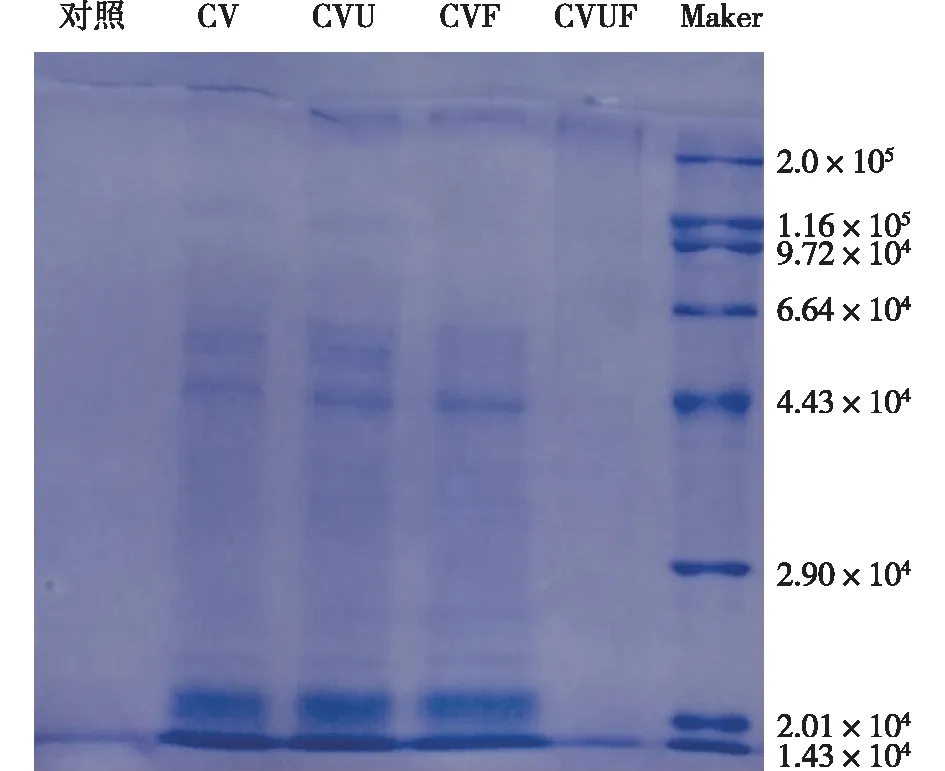
图5 均质处理前后蓝藻溶液SDS-PAGE电泳分析Fig.5 SDS-PAGE electrophoresis analysis of cyanobacterial solution with homogenization treatment
2.3 固态发酵过程中组分的变化
早期,蔡健等[38]和谭超等[39]直接利用蓝藻为氮源培养芽孢杆菌,取得了一定的效果。因此,笔者尝试将蓝藻细胞破碎液进行固液分离后的固体蓝藻渣用于培养芽孢杆菌,结果如图6所示。由图6可知:枯草芽孢杆菌和地衣芽孢杆菌在用蓝藻渣固体培养基发酵过程的前12 h为生长延迟期,12~48 h为对数期,48 h达到稳定期,同时活菌数达到最大((3.0~3.6)×1010CFU/g),但是没有衰亡期;蓝藻渣固体培养基经枯草芽孢杆菌和地衣芽孢杆菌发酵后,其含水率从53%分别增加到57.7%和59.9%。同时发现,培养基含水率增加是从发酵24 h时开始,地衣芽孢杆菌的培养基明显要比枯草芽孢杆菌的培养基水分增加得快。
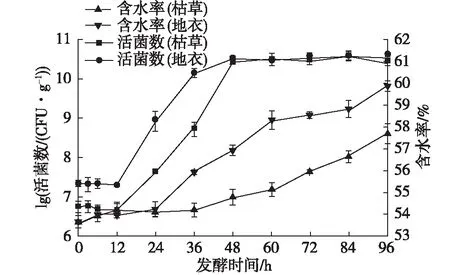
图6 芽孢杆菌菌落数和含水率Fig.6 Total numbers of Bacillus colonies and water content
固态培养基中的粗蛋白及可溶性蛋白的变化如图7所示。由图7可知:培养物中的粗蛋白含量明显增加,直到发酵结束,枯草芽孢杆菌和地衣芽孢杆菌发酵培养基中的粗蛋白含量分别缓慢增加到222.2和225.3 g/kg,该结果与Shiu等[40]研究结果相同,其可溶性蛋白含量变化趋势则是先减少后增加,尤其在24~36 h时,可溶性蛋白下降最快,36 h后可溶性蛋白明显增加,且含量趋于稳定。这可能是菌种在发酵前期利用培养基中的可溶性蛋白生长,发酵后期菌体代谢分泌蛋白。综合考虑发酵过程中活菌数、营养成分变化以及能耗问题,选取72 h为发酵终止时间。
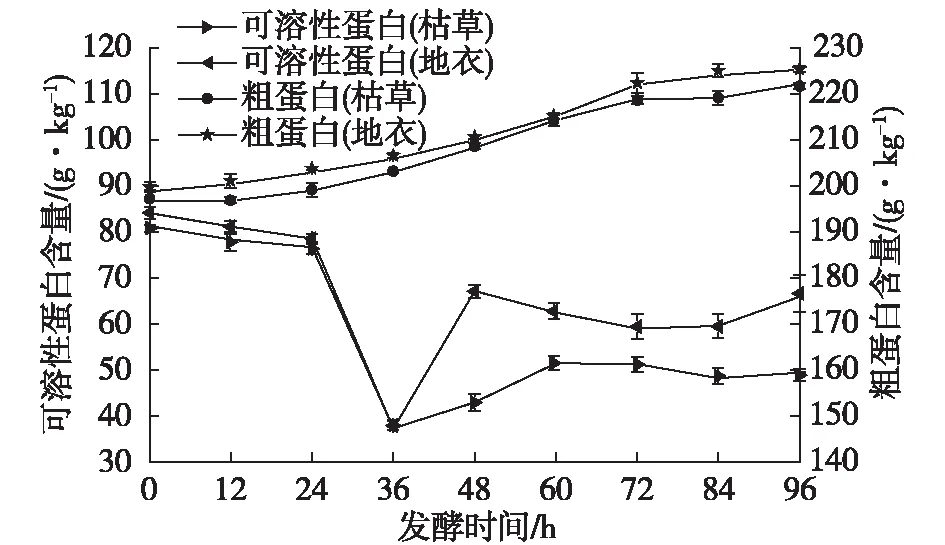
图7 芽孢杆菌培养过程的粗蛋白和可溶性蛋白变化Fig.7 Changes of crude protein and soluble protein in culture with Bacillus
2.4 蓝藻渣固态发酵前后组成分析
利用芽孢杆菌发酵处理可改善蓝藻培养基成分及风味[41],考察芽孢杆菌发酵前后培养基组成,结果如表1~2所示。
由表1~2可知:利用枯草和地衣芽孢杆菌发酵蓝藻培养基后,培养基气味改善,无腥臭味;粗蛋白含量分别增加11.9%和13.5%;发酵后培养基中游离氨基酸总含量(以100 g蛋白计)达到804.9、3 127.8 mg,比发酵前分别增加了154.0%、887.0%;灰分含量也有显著增加,这与Wu等[42]研究结果一致。发酵后培养基中的可溶性蛋白及总糖含量与发酵前相比,则有明显的下降,这与芽孢杆菌利用培养基中的碳源、氮源有关。发酵后pH同样发生了明显的变化,从6.0升高到7.2左右,这可能与发酵过程中蛋白质或氨基酸产生有关,因为芽孢杆菌在发酵过程中会产生大量碱性蛋白酶,蛋白酶水解蛋白质会产生氨,导致培养基pH升高[43-44]。另外,芽孢杆菌可以降解藻毒素,在未发酵培养基中并未检测到藻毒素,这可能与取藻的时间有关:一般蓝藻适宜的生长温度为25~35 ℃,5—9月为其生长期,本次蓝藻样品则在5月中下旬连续阴雨天后取的,主要处于生长期,而细胞在死亡腐烂时才释放藻毒素。

表1 芽孢杆菌发酵前后培养基组成
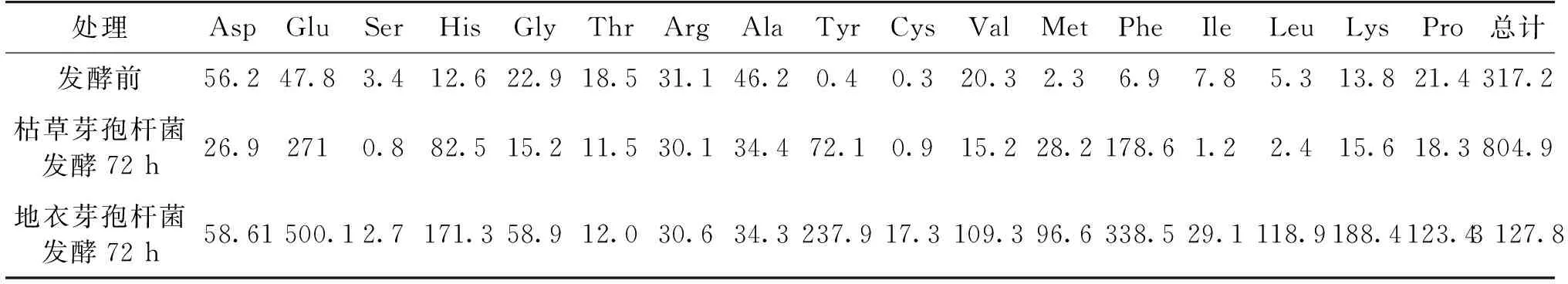
表2 游离氨基酸组成
3 结论
采用高压均质处理蓝藻泥能释放出22%左右的可溶性蛋白。藻渣(含水率90%)与麸皮按质量比55.5∶44.5混合后可以用于培养芽孢杆菌作为生物菌制剂,枯草芽孢杆菌和地衣芽孢杆菌的活菌数可分别达到3.12×1010、3.69×1010CFU/g,培养物中蓝藻腥臭味被去除,粗蛋白含量提高约12%。以蓝藻为原料制备生物菌制剂,在未来有望应用于土壤改良、环境治理、水产养殖等领域,为蓝藻泥处置提供新的资源化利用途径。
