大豆GmWRKY50的抗体制备及其蛋白水平表达分析
2022-01-10范会芬孙天杰苏伟华肖付明王冬梅
范会芬,孙天杰,苏伟华,肖付明,张 洁,王冬梅
(1.省部共建华北作物改良与调控国家重点实验室,河北农业大学 生命科学学院,河北省植物生理与分子病理学重点实验室,河北 保定 071001;2.河北省邯郸市农业科学院,河北 邯郸 056001)
大豆(Glycinemax)是重要的经济作物,在世界食用油生产中占有重要地位[1]。提高产量并保障供应,是大豆生产面临的重要问题。大豆的产量不仅受到气候条件和土壤条件(盐分、干旱和金属污染)等环境因素的影响,还深受大豆花叶病毒(Soybeanmosaicvirus,SMV)等病原物的危害[2]。大豆花叶病毒侵染引起的大豆花叶病毒病频繁流行,可导致大豆的株高和荚果数分别下降57%,68%,给大豆生产造成巨大损失[3]。因此,发掘抗病基因,提高大豆产量是保障大豆生产安全的关键。
过氧化氢(H2O2)作为活性氧(Reactive oxygen species,ROS)的主要成员之一,在植物免疫应答过程中发挥重要作用[4]。研究发现,细胞可利用其质膜上的NADPH(Nicotinamide adenine dinucleotide phosphate)氧化酶(又称呼吸爆发氧化酶同系物RBOH)等在胞外产生H2O2。胞外H2O2可进入胞质,进而氧化修饰胞内蛋白质,从而诱导下游信号转导,以调控生物的生长、发育及其对胁迫的响应[4]。H2O2在植物防御病毒的侵染早期可引起寄主细胞局部坏死,也作为信号分子诱导抗病防御反应[5]。有研究表明,烟草叶片受烟草花叶病毒侵染后,质膜NADPH氧化酶蛋白表达量增加,H2O2水平升高,并且在坏死斑边缘的细胞壁有胼胝质的积累[6]。利用水杨酸处理烟草叶片,可激活ROS信号通路和诱导胼胝质在胞间连丝上的沉积,抑制番茄花叶病毒(TMV)的扩散[7]。Sun等[8]前期研究结果表明,在大豆与SMV互作体系的不亲和组合中,H2O2主要分布在寄主的细胞壁及质膜部位;预注射NADPH氧化酶抑制剂咪唑后,H2O2的产生和胼胝质的沉积均明显减少,说明H2O2的产生可能主要依赖于NADPH氧化酶,通过参与调控胼胝质在胞间连丝的沉积,完成对病毒胞间转运的阻断。
WRKY转录因子家族广泛存在植物细胞中,可调控ROS的产生和清除[9],在植物应对各种生物胁迫的免疫反应中发挥着重要作用[10-11]。研究表明,过表达GhWRKY15基因的烟草植株通过调控ROS信号通路增强了对TMV和黄瓜花叶病毒(CMV)的抗性[9]。在大豆与赤霉菌互作过程中,GmWRKY40能够与茉莉酸信号途径抑制因子JAZ蛋白互作,通过激活H2O2合成途径和抑制H2O2的清除,参与大豆抵抗大豆赤霉病的过程[10]。过表达CsWRKY50能够提高H2O2的清除能力,增强黄瓜对霜霉病的抗性[12]。
Sun等[8]前期通过高通量测序构建了清除H2O2前后大豆与SMV互作的转录组数据库。本研究在前期工作基础上,从中筛选得到一个差异表达的WRKY转录因子家族成员GmWRKY50,通过原核表达技术获得了其带有6×His标签的纯化蛋白并制备了多克隆抗体,利用制备的抗体检测了GmWRKY50在大豆与SMV互作过程中的蛋白水平表达变化,旨在为进一步阐明GmWRKY50在H2O2调控下参与大豆抵御SMV侵染的功能和分子机制奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 大豆的种植 大豆(冀豆7号)由光照强度为10 000 lx的高压钠灯进行照射,温度恒定在25 ℃,光周期为16 h/8 h(L/D)。挑选颗粒饱满的冀豆7号种子,种植于装有蛭石的塑料培养盆(直径为15 cm)中,每盆种植16株。
1.1.2 病毒的繁殖和保存 病毒SMV株系N3的繁殖通过叶片进行,将带有N3的大豆花叶症状明显的南农1138-2叶片放入标记好取样日期的1.5 mL的Ep管中,液氮速冻,分批冻存于-80 ℃。叶片保存的时间越长,病毒的活力越弱;通过保存叶片的方法保存病毒,并不能使病毒长存,要及时更新并储存新繁殖的病毒叶片;病毒的继代繁殖可以通过接种大豆活体植株进行。将具有明显花叶症状的带病毒叶片放入研钵中,辅以金刚砂的阻力,加入适量0.01 mol/L磷酸盐缓冲液(pH值7.0)进行充分研磨,然后作为接种剂进行摩擦接种,用无菌毛刷蘸取研磨液均匀刷在两周龄的南农1138-2植株的展开叶片及主茎中(增加繁殖效率),每5 d进行一次接种,接种3次,最后一次接种病毒1个月后,观察新生叶片是否发生了花叶卷曲,并取卷曲叶片进行PCR扩增,验证叶片是否含有SMV-CP,验证无误后进行后续试验。
1.2 试验方法
1.2.1 总RNA的提取及cDNA第一条链的合成 种植冀豆7号15 d,在3轮复叶接种SMV后48 h取样,液氮速冻,研磨,并提取RNA(具体步骤参考说明书);经反转录试剂反转为cDNA待用。
1.2.2GmWRKY50基因生物信息学分析 根据转录组数据库中的基因ID为Glyma.17G224800.1在http://soykb.org/网站进行检索,下载该基因编码区序列;在NCBI在线搜索并分析该基因片段长度,获得该基因的核酸序列和蛋白质序列具体信息;同时在NCBI BlastP中搜索大豆、水稻(Oryzasativa)、拟南芥(Arabidopsisthaliana)、烟草(Nicotianatabacum)、蒺藜苜蓿(Medicagotruncatula)等物种中具有相似序列的基因,并进行序列筛选,下载并以FASTA形式保存筛选的序列,运用ClustalW软件进行序列比对,保存比对结果;使用MEGA 7.0软件以邻接法构建发育树,选择泊松模型,校验参数为Bootstrap=500。
1.2.3GmWRKY50原核表达载体构建 根据GmWRKY50的基因序列设计带有BamH Ⅰ酶切位点的F-ggatccATGACAGACAAAATACCAAAACCACCAC和带有Hand Ⅲ酶切位点的R-aagcttGGAAGAACTTGGATGAGTGTGGTTG扩增目的基因(小写字母为酶切位点序列),用T4DNA连接酶连接至pCold Ⅱ并转化到大肠杆菌菌株Top10中,通过Amp抗性培养基筛选阳性克隆,进行培养并提质粒,双酶切验证后,送至北京华大基因科技有限公司进行测序。将构建成功的pCold Ⅱ-GmWRKY50质粒转化到BL21菌株中,Amp抗性培养基筛选出阳性单克隆。
1.2.4 GmWRKY50重组蛋白的诱导及溶解性分析 将正确的单克隆菌株培养至OD600为0.3~0.4,置于4 ℃ 1 h,然后通过终浓度不同的IPTG,培养不同的时间,以确定最适合的诱导条件。吸取2 mL菌液以7 000 r/min离心后,加入蛋白裂解液(0.5 mmol/L NaCl,20 mmol/L Tris,pH值8.0)60 μL重悬后加入6×Loading Buffer,煮沸10 min,经SDS-PAGE检测表达量;并通过Western Blotting技术验证诱导后的目的蛋白是否为带有His标签的重组蛋白。检测具体步骤参考麻楠等[13]的方法,以BSA为阴性对照,取纯化后的蛋白进行SDS-PAGE:①将电泳后的凝胶以90 V的电压转移至硝酸纤维素膜(PVDF)上,持续50 min;②清洗PVDF膜15 min,其间更换2次TBST缓冲液(2.42 g/L Tris,8.80 g/L NaCl,2 mL/L Tween 20);③用含有5%脱脂奶粉的TBST缓冲液封闭1 h;④用Anti-GmWRKY50进行孵育3 h,抗体稀释比例为1∶6 000;⑤Anti-His孵育完毕后,用TBST缓冲液清洗PVDF膜15 min,其间更换2次缓冲液;⑥再使用HPR标记的羊抗鼠IgG(为1∶6 000)孵育1 h后,用TBST缓冲液将PVDF膜清洗15 min,其间更换2次缓冲液,直至清洗干净;并借助Immobilon Western HRP 底物于暗室进行显影。
根据上述探索的IPTG浓度以及诱导时间进行诱导,收集2 mL诱导后菌体,用400 μL裂解液(PMSF工作浓度为0.05 mmol/L)重悬,超声波处理10 min(功率90 W,超声30 s,间隔10 s)后4 ℃离心(12 377 r/min,15 min),分离上清液和沉淀并通过SDS-PAGE检测。
1.2.5 GmWRKY50蛋白的纯化 ①纯化过程借助12 mL的亲和层析柱,向柱中加入2 mL Ni-NTA SefinoseTMResin,用缓冲液(0.5 mmol/L NaCl和20 mmol/L Tirs,pH值8.0)清洗后,使用配套的筛板对纯化介质进行排气,此过程缓冲液的高度高于筛板,将纯化介质压平整,待用;②将样品加入盛有纯化介质的柱子里,控制流速(约1 mL/min);③分别使用不同咪唑浓度的洗脱缓冲液(表1)洗脱目的蛋白,每种浓度加2 mL,每1 mL收集为1管,分别标记为1和2;④SDS-PAGE检测纯化效果。

表1 缓冲液的制备Tab.1 Buffer preparation mmol/L
1.2.6 收集纯化的蛋白 将250 mmol/L咪唑洗脱下来的蛋白进行收集,加入6×Loading Buffer,煮沸10 min,以牛血清白蛋白(BSA)为标准,检测蛋白洗脱效果。用考马斯亮蓝G-250进行考染观察,纯化的总蛋白量大于2 mg后,送北京华大蛋白质研发中心有限公司进行抗体的制备。
1.2.7 抗体特异性检测 抗体特异性检测具体步骤参考1.2.4,提取大豆叶片的总蛋白:将蛋白酶抑制剂(PMSF)终浓度为0.05 mmol/L的蛋白提取液(50 mmol/L Tris、0.15 mol/L NaCl、0.5%NP-40,pH值8.0)加入研磨至粉末状的样品中,在涡旋振荡器上进行充分涡旋,每10 min涡旋1次,涡旋1次1 min,全程在冰上进行,其间补加PMSF。蛋白检测步骤如1.2.6,该步骤选用的Anti-GmWRKY50稀释比例为1∶3 000,使用HPR标记的羊抗兔IgG的稀释比例为1∶4 000。
1.2.8 GmWRKY50在大豆抵抗SMV侵染过程中的表达量变化 GmWRKY50在大豆抵抗SMV侵染过程中的表达量变化,即对大豆叶片蛋白的提取及表达量检测:具体参考1.2.4和1.2.7。
2 结果与分析
2.1 GmWRKY50基因的克隆及其生物信息学分析和原核表达载体构建
以大豆品种冀豆7号的cDNA为模板,PCR扩增获得GmWRKY50编码序列(图1-A),并对该基因进行了生物信息学分析,结果显示(图1-B-E),该基因CDS全长为495 bp,编码氨基酸165个,含有1个WRKY结构域;从氨基酸序列可以看出,WRKY结构特征为WRKYGKK,锌指结构特征为C2H2(CX4-CX23-HXH)。
通过NCBI在线检索GmWRKY50蛋白同源基因,选择大豆、水稻、拟南芥、烟草、小麦等物种中的相似序列,利用MEGA 7.0软件进行系统进化树分析,结果表明(图1-E),GmWRKY50与模式生物拟南芥AtWRKY50同源关系最近。
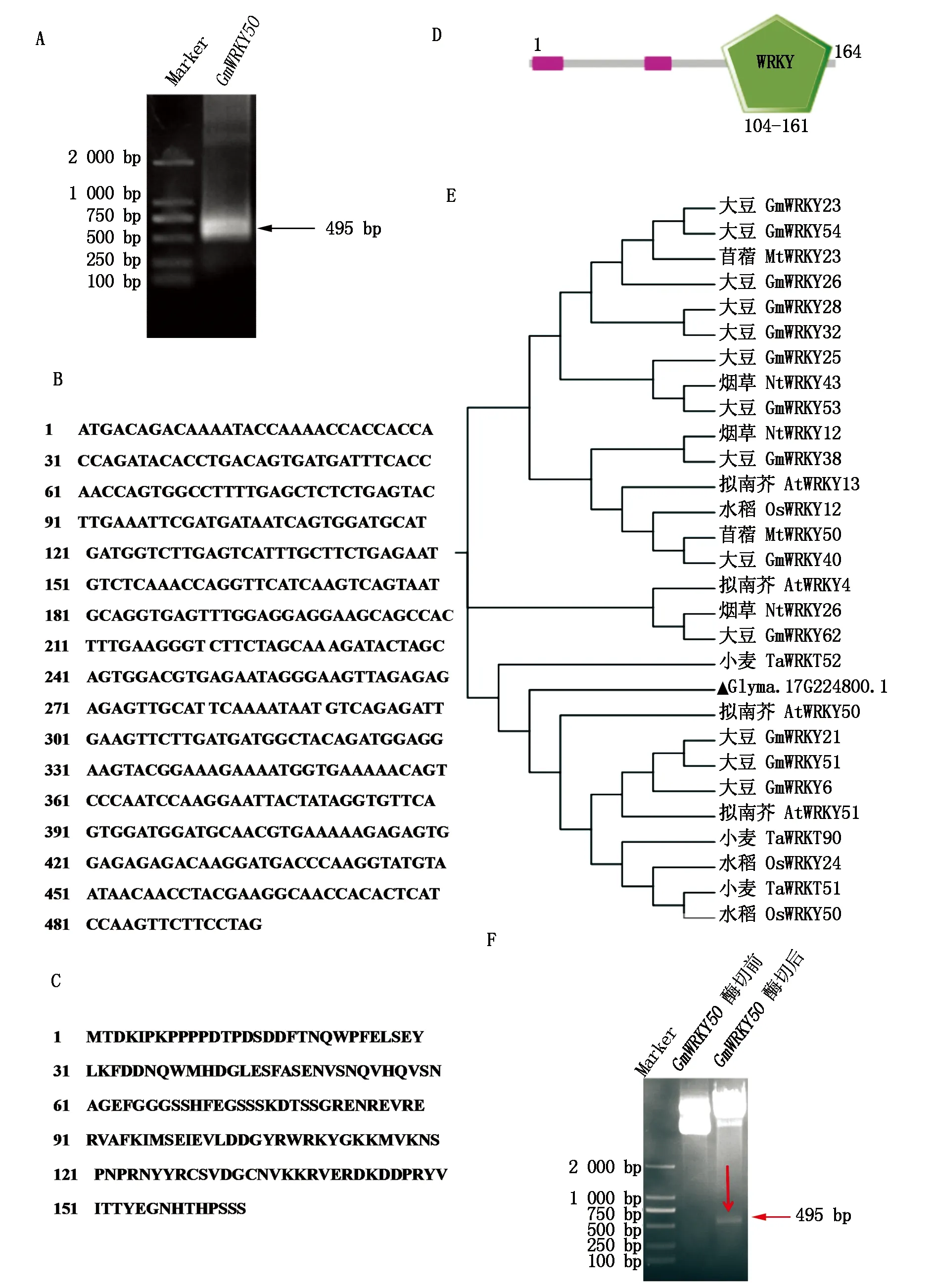
A.GmWRKY50基因的克隆;B.GmWRKY50的CDS序列;C.GmWRKY50的氨基酸序列;D.GmWRKY50结构域;E.GmWRKY50系统发育树分析;F.pCold Ⅱ-GmWRKY50重组质粒的酶切前后对比。A.Cloning of GmWRKY50 gene; B.GmWRKY50 CDS sequence; C.GmWRKY50 amino acid sequence; D.GmWRKY50 domain;E.GmWRKY50 phylogenetic analysis; F.Comparison before and after restriction digestion of pCold Ⅱ-GmWRKY50 recombinant plasmid.
以大豆品种冀豆7号的cDNA为模板,PCR扩增获得GmWRKY50编码序列,与pCold Ⅱ质粒重组构建原核表达载体后,进行双酶切验证,均在495 bp(图1-A、F)处有相应大小的条带,同时测序后序列比对完全正确,说明pCold Ⅱ-GmWRKY50原核表达载体构建成功。
2.2 GmWRKY50融合蛋白的诱导及可溶性分析
为分析GmWRKY50-6×His重组蛋白表达的优化条件,使用不同终浓度的IPTG和不同培养时间进行处理。SDS-PAGE分析发现,IPTG终浓度为0.5 mmol/L、诱导4 h的重组蛋白表达效果良好,高效的表达出了分子量约为18.86 ku的GmWRKY50重组蛋白。以上述条件诱导蛋白表达后,收集菌体进行超声破碎并离心,分别取上清液及沉淀进行电泳检测。结果表明,重组蛋白在上清液和沉淀中均表达,取上清液中的重组蛋白进行纯化(图2)。

A.IPTG诱导GmWRKY50的表达;B.检测诱导的重组蛋白;C.GmWRKY50溶解性分析。A.IPTG induces the expression of GmWRKY50; B.Detection of induced recombinant protein; C.GmWRKY50 solubility analysis.
2.3 GmWRKY50融合蛋白的纯化与富集
超声破碎离心后,取上清液,使用Ni-NTA亲和纯化介质进行GmWRKY50重组蛋白的纯化,以表1中纯化缓冲液进行洗脱,结果表明(图3),使用250 mmol/L咪唑洗脱的目的蛋白纯度相对较高,且洗脱较为完全。将250 mmol/L咪唑洗脱下来的蛋白进行富集,向洗脱样品中加入6×Loading Buffer,煮沸5 min,使用12%分离胶、5%浓缩胶的SDS-PAGE检测蛋白洗脱效果,GmWRKY50的纯度较高,且浓度达5 mg/mL以上,将考染后的条带切下,送北京华大蛋白质研发中心有限公司进行抗体的制备。
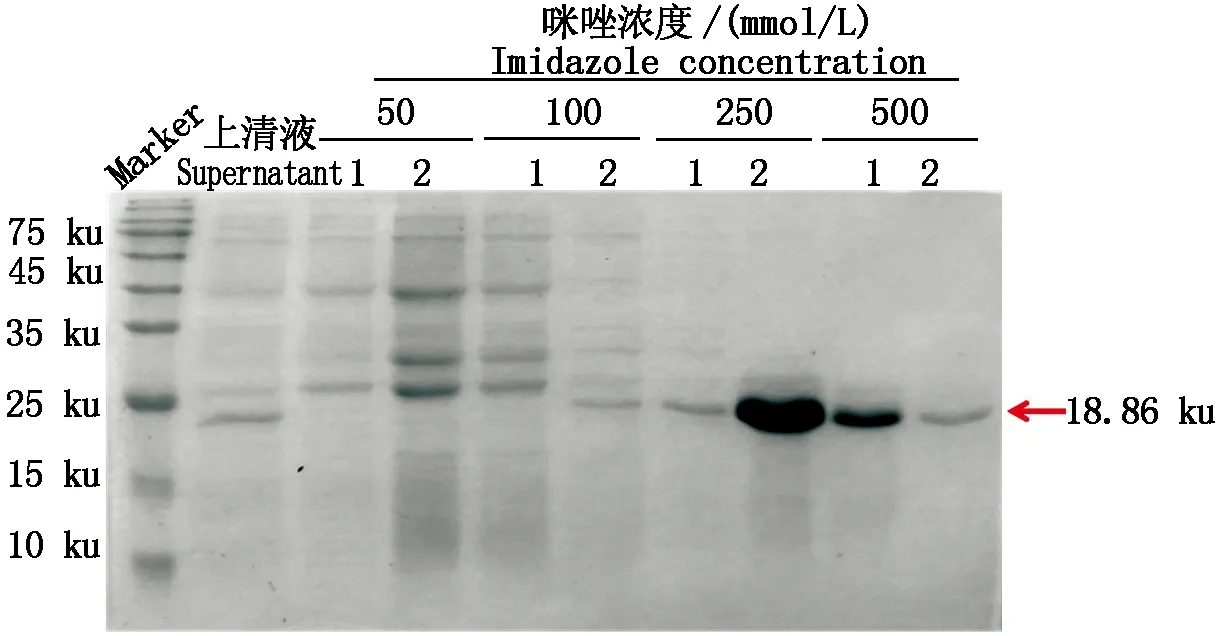
1-2.不同浓度咪唑的洗脱液1和洗脱液2。1-2.Eluent 1 and eluent 2 of different concentrations of imidazole.
2.4 GmWRKY50抗体的特异性检测
提取大豆叶片总蛋白并进行电泳,借助Western Blotting进一步验证Anti-GmWRKY50抗体的特异性,结果显示(图4),当抗体稀释比例为1∶3 000时,出现的条带位置与GmWRKY50预期分子量大小以及诱导后使用Anti-His抗体(1∶6 000)杂交后的位置基本一致,表明该抗体能够特异性识别GmWRKY50。
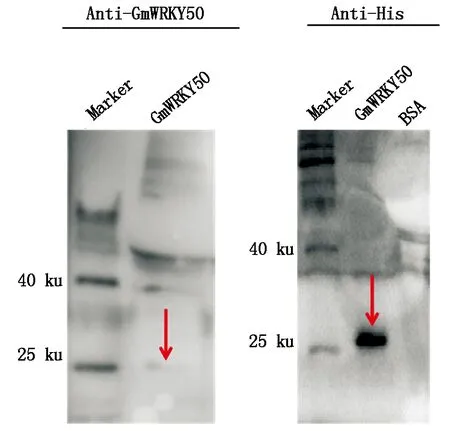
图4 Anti-GmWRKY50抗体的特异性检测Fig.4 Specific detection of Anti-GmWRKY50 antibody
2.5 GmWRKY50在大豆与SMV互作过程中的表达量检测
为了进一步分析大豆中GmWRKY50在抵抗SMV过程中的作用,对大豆叶片接种大豆花叶病毒N3后在0,12,24,48 h进行取样,并提取叶片总蛋白,检测GmWRKY50在蛋白水平的表达量变化。结果表明(图5),SMV侵染12,24,48 h的样品中GmWRKY50的蛋白水平表达量均高于0 h。说明GmWRKY50受到了SMV侵染的诱导,进一步说明GmWRKY50在蛋白水平响应SMV侵染过程。
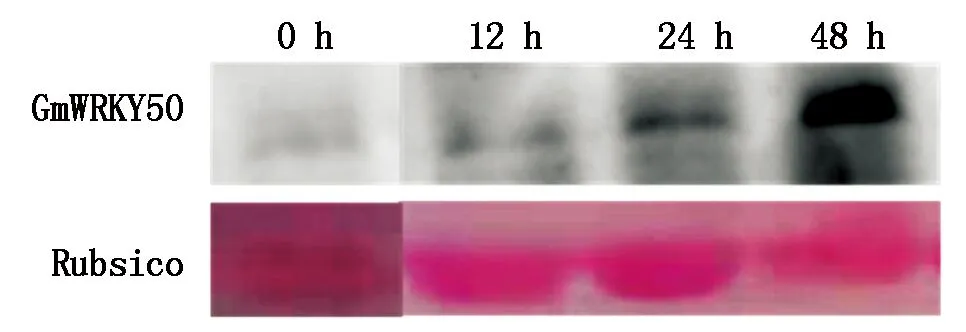
GmWRKY50.Western Blotting检测GmWRKY50;Rubsico.丽春红染色检测Rubsico。GmWRKY50.Western Blotting to detect GmWRKY50;Rubsico.Ponceau stain to detect Rubsico.
3 讨论
WRKY类转录因子是植物特有的,具有1个或2个保守的WRKY结构域(约60个氨基酸)[14]。其分子结构特征为具有保守的肽序列Trp-Arg-Lys-Tyr(WRKY)和锌指结构域C2HXH[15],WRKY蛋白的核心序列是WRKYGQK。WRKY转录因子分为3个家族,将有2个WRKY结构域的分为Ⅰ族[14];有一个WRKY结构域且锌指结构为HXH的分别为Ⅱ族,为HXC的分为Ⅲ族[14]。Ⅱa-b、Ⅱc、Ⅱd-e是对Ⅱ族的进一步分化;Ⅲ族分为Ⅲa和Ⅲb 2个亚家族。Ⅰ族的锌指特征CX4-CX22-23HXH,Ⅱa/Ⅱb/Ⅱd/Ⅱe的保守序列为CX5-CX23-24HXH,Ⅱc与Ⅰ族的保守序列相同[15],Ⅲa的保守序列为CX7-CX23-30HXC,而Ⅲb为CX6-9-CX23-30HXC[16]。
目前,拟南芥中已确定的WRKY家族成员有74个[17],烟草中有164个[18],水稻中有111个[19],小麦中有171个[20],大豆中有178个[21]。在不同作物中WRKY结构域经常发生变异。在大豆中,WRKYGQK中的Q优先突变,而W、K和Y相对保守,WRKYGKK突变体较多,该突变影响蛋白质与DNA的相互作用[21];WRKYGKK大多数来自第Ⅱ组WRKY基因家族,这也说明第Ⅱ组WRKY基因的生物学功能更加多样化[21]。在小麦中发现了3个突变体,分别是WRKYGKK(10)、WRKYGEK(11)和WSKYGQK(1),10个突变为WRKYGKK结构域的转录因子分布在Ⅱc亚家族,11个突变为WRKYGEK结构域的转录因子分布在Ⅲ族,突变为WSKYGQK结构域的转录因子为TaWRKY157[20]。本研究中发现GmWRKY50蛋白中结构域的序列为WRKYGKK-CX4-CX23-HXH,而且在拟南芥中AtWRKY50结构域为同为WRKYGKK-CX4-CX23-HXH[22],在进化发生关系的分析中发现GmWRKY50与AtWRKY50同源关系最近,同为Ⅱc家族的转录因子。
为了进一步研究GmWRKY50基因的功能,将GmWRKY50蛋白进行了原核表达,GmWRKY50蛋白的相对分子质量约为18.86 ku,带6个His标签,其分子量约为0.84 ku,GmWRKY50-6×His相对质量约为19.70 ku,与电泳检测结果的大小基本一致,但还是有偏差,尤其是Western Blotting的结果,首先造成这种偏差的原因可能是因为蛋白质翻译水平后修饰造成了不同的折叠构象,小麦的TCTP蛋白表达亦有类似情况发生[13];出现该现象的另一种原因,可能是用来衡量蛋白质分子量大小的蛋白质Marker可能存在不同程度的偏差。本研究通过该技术获得了纯化蛋白并制备了多克隆抗体,进一步通过蛋白质印迹法证明GmWRKY50在蛋白表达水平响应SMV的侵染。本研究制备的特异性抗体为进一步研究GmWRKY50在响应SMV侵染过程中的功能和作用机制奠定了基础。
