不同乳酸菌发酵葡萄酵素过程中代谢产物及其抗氧化特性分析
2022-01-08梁红敏郭亚芸史红梅
梁红敏,郭亚芸,史红梅
(山东省葡萄研究院,山东 济南 250100)
根据国际葡萄与葡萄酒组织(International Organisation of Vine and Wine,OIV)2018 年数据统计,2017年全球用于酿酒的葡萄占比52%,中国的葡萄主要以鲜食为主(占比83%),鲜食是酿酒的7.5倍[1]。鲜食葡萄如巨峰葡萄一般粒大汁甜、营养丰富,广受消费者喜爱,然而由于其皮薄、含糖量高、果实硬度低,极易受机械损伤以及微生物污染等特点,不易储存和运输,葡萄产后流通环节薄弱,导致我国鲜食葡萄年损耗率达27%,从而制约了鲜食葡萄产业的发展[2-6]。目前,我国酵素产业正处于高速发展时期,酵素生产水平不断提高,生产规模也在不断扩大,现在产品出口量增多,正在打开国际市场。将鲜食葡萄制作成酵素产品,不仅能减少我国鲜食葡萄的损耗,并且能够极大地提高产品的附加值。
在酵素食品行业里,常用的微生物有乳酸菌类、酵母菌及其复配菌等。通过选择不同益生菌发酵酵素饮料,可以获得不同营养价值和风味的酵素产品。乳酸发酵是最古老、最经济的发酵方法和最有价值的生物技术方法之一,用于维持或改善水果的营养、感官、安全和保质期[7]。杨志鹏等[8]对海棠果酵素中的益生菌菌株进行筛选,优选出鼠李糖乳杆菌217-3为发酵菌株。葛瑞宏等[9]选择益生菌(保加利亚乳杆菌、嗜热链球菌、嗜酸乳杆菌、青春双歧杆菌)为发酵菌种制备桂圆酵素,获得的桂圆酵素原液营养丰富且具有一定的抗氧化活性。马晓伟等[10]以产乳酸芽孢杆菌、鼠李糖乳杆菌、植物乳杆菌为发酵菌株制备火龙果酵素,得到的酵素饮品不仅具有清雅和谐的果香和发酵香味,而且营养丰富。
本研究以巨峰葡萄为发酵原料,选择干酪乳杆菌、植物乳杆菌、副干酪乳杆菌、鼠李糖乳杆菌4种乳杆菌分别进行发酵,跟踪检测不同乳酸菌发酵葡萄酵素过程中代谢组分及抗氧化活性的变化,为鲜食葡萄深加工提供数据支撑和理论支持。
1 材料与方法
1.1 材料与试剂
巨峰葡萄采自山东省葡萄研究院仲宫试验基地,位于济南市历城区仲宫镇卧虎山水库南岸。
副干酪乳杆菌、干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌:中国工业微生物菌种保藏管理中心。
乳酸菌通用培养基(MRS培养基)参照文献[11]配制。蛋白胨10g、牛肉膏10g、酵母提取物5g、磷酸氢二钾2 g、柠檬酸氢二铵2g、乙酸钠5g、葡萄糖20g、吐温801mL、MnSO40.25 g、MgSO4·7H2O 0.5 g,蒸馏水 1 000 mL,pH6.2~6.4,121℃高压蒸汽灭菌锅中灭菌20 min。固体培养基在液体培养基的基础上添加1.8%琼脂。
1,1-二苯-2-三硝基苯肼 (1,1-dipheny1-2-picryhydrazyl,DPPH)、2,2'-联氮双(3-乙基-苯并噻唑啉-6-磺酸)[2,2'-azino-bis-(3-ethylbmzothiazoline-6-sulfonic acid,ABTS]、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylicacid,Trolox)、2,4,6-三 (2-吡啶)-1,3,5-三嗪[2,4,6-Tris(2-pyridyl)-5-triazine,TPTZ]、没食子酸(gallic acid,GAE)标准品、福林酚试剂:美国Sigma公司;氢氧化钠、邻苯三酚、福林酚、三氯化铁、无水乙醇、乙酸钠、浓盐酸(均为分析纯):国药集团化学试剂有限公司;超氧化物歧化酶(superoxide dismutase,SOD)测试盒:苏州科铭生物技术有限公司。
1.2 仪器与设备
TDL-5型高速离心机:上海安亭科学仪器厂;UV5200紫外可见分光光度计:上海元析仪器有限公司;YXQ-LS-70A型立式压力蒸汽灭菌器:上海博讯实业有限公司;BPC-生化培养箱:上海一恒科学仪器有限公司;SW-CJ-ZD双人单面净化工作台:苏州净化设备有限公司;ML204/2型电子天平、FE20pH计:上海梅特勒-托利多仪器有限公司;THZ-C-1型台式恒温振荡器:苏州培英实验设备有限公司。
1.3 方法
1.3.1 菌种活化及生长曲线的绘制
菌种活化参照文献[12]的方法,并略作修改。从安瓿瓶中取出菌种,接入MRS液体培养基中,置于37℃培养24 h,再继代培养2次后,活化液在4 000 r/min,4℃条件下离心10 min,收集微生物菌体,用0.1%的无菌生理盐水进行洗涤,制成种子液(浓度1×109cfu/mL)。
乳酸菌生长曲线的绘制:将活化后的副干酪乳杆菌、干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌种子液分别接入100 mL MRS的液体培养基,接种量为3%,发酵温度为37℃,从接种开始计时,每隔2 h分别测量其活菌数,连续测量20 h。以培养时间为横坐标,生物量OD660nm值为纵坐标,分别绘制副干酪乳杆菌、干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌的生长曲线。
1.3.2 葡萄酵素的制备
将葡萄洗净沥干,破碎,加入干净的玻璃坛中,65℃灭菌15 min,冷却后在无菌操作台中按1×108cfu/mL接种量分别加入4种乳酸杆菌,进行密封发酵,每天无菌条件下搅拌1次,连续发酵15 d,在发酵的过程中前7 d每天连续取样,然后每隔1 d取样。
1.3.3 发酵过程中微生物生长的变化
参考Yang等[13]的方法,采用菌落计数法测定发酵过程中微生物(乳酸菌)的生长情况。在不同的时间间隔提取发酵的葡萄酵素样品,然后立即进行微生物培养。在一系列的稀释过程中,用扩散平板法将样品接种到MRS平板培养基上。接种后,将平板倒置,在37℃培养72 h。然后计算菌落总数,结果显示为log10转换的数据。将周围有透明带的菌落计数为总乳酸菌,并记录每次连续稀释时3个平板的平均值。
1.3.4 pH值的测定
pH值由酸度计直接进行测定。
1.3.5 总酸的测定
参考GB/T 12456—2008《食品中总酸的测定》对样品进行总酸含量测定,结果以乳酸(g/L)计。
1.3.6 SOD酶活力的测定
将葡萄酵素液在4000r/min离心10min后,取上清液,根据SOD测试盒说明书进行SOD酶活力的测定。
1.3.7 总酚含量的测定
参考王华等[14]的方法,以没食子酸为标准品,绘制标准曲线。分别对4种不同乳酸菌发酵样品,再按照制作标准曲线的方法进行操作。没食子酸标准曲线线性方程为 y=0.000 9x+0.007 9,R2=0.999 1,其中:y 为吸光度,x为没食子酸浓度(μg/mL)。
1.3.8 对DPPH自由基清除作用的测定
参考 Espín 等[15]的方法,称取 0.039 4 g DPPH,用无水乙醇定容至100 mL,再用无水乙醇配制成浓度为1×10-4mmol/L的DPPH溶液。取发酵过程中不同时间间隔的样品溶液以10 000×g离心5 min,去除发酵样品中的不溶性残渣。取上清液0.5 mL分别加入3.5 mL DPPH乙醇溶液中,避光反应2 h,测量其在波长517 nm处的吸光度值(Ai)。取0.5 mL无水乙醇与3.5 mL DPPH溶液反应,避光反应2 h,波长517 nm处测吸光度值(A0),按照下列公式计算自由基清除率。

以水溶性维生素E类(Trolox)为标准品,以不同Trolox浓度对清除率绘制标准曲线,结果以每升(L)发酵样品中 Trolox(μmol)的量表示[17]。DPPH 乙醇体系标准曲线线性方程为y=0.403 4x+1.444 7,R2=0.999 2。
1.3.9 对ABTS+自由基清除作用的测定
参考MARFIL等[16]的方法配制ABTS反应储备液,使用时用无水乙醇将其稀释至吸光度值为0.70±0.02,取发酵过程中不同时间间隔的样品溶液以10 000×g离心5 min,去除发酵样品中的不溶性残渣,取上清液200 μL分别加入6.0 mL ABTS工作液中,避光反应30 min,以乙醇溶剂作空白对照,测量其在波长734 nm处的吸光度值(Ai)。取200 μL无水乙醇与6.0 mL ABTS工作液反应,避光反应30 min,波长734 nm处测吸光度值(A0),按照下列公式计算自由基清除率。

以Trolox(水溶性维生素E类)为标准品,以不同Trolox浓度对清除率绘制标准曲线,结果以每升(L)发酵样品中 Trolox(μmol)的量表示[17]。ABTS 乙醇体系标准曲线线性方程为y=0.168 4x-0.146,R2=0.999 6。
1.3.10 铁离子还原能力(ferric reducing antioxidant power,FRAP)测定
参考Suárez B等[18]的方法,略作修改,取发酵过程中不同时间间隔的样品溶液以10 000×g离心5 min,去除发酵样品中的不溶性残渣,取上清液200 μL分别加入4.0 mL TPTZ工作液(由0.1 mol/L醋酸盐缓冲液25 mL,10 mmol/L TPTZ 溶液 2.5 mL,20 mmol/L FeCl3溶液2.5 mL组成)。混匀后37℃反应10 min,波长593 nm测定吸光度值。
以水溶性维生素E类(Trolox)为标准物质,以不同Trolox浓度对吸光度绘制标准曲线,结果以每升发酵样品中Trolox(μmol)的量表示。标准曲线线性方程为 y=0.002 1x+0.176,R2=0.999 6。
1.4 数据处理
试验结果为平行试验的平均值表示。采用Origin 8.6软件处理数据、作图。
2 结果与分析
2.1 4种乳酸菌生长曲线的绘制
4种乳酸菌经过3代活化的生长曲线见图1。

图1 不同乳酸菌的生长曲线Fig.1 Growth curve of different lactic acid bacterial strains
由图1可知,在0~2 h,4种乳杆菌在发酵温度为37℃的恒温培养条件下,增长速度相对平缓,这是由于刚刚进入新的培养液,菌种需要一段适应的过程,此段时期属于延滞期;通过延滞期的调整,菌体适应生长环境后,进入对数生长期,此阶段菌体数目呈几何增长,不同乳杆菌处于对数生长期时间长短不同,副干酪乳杆菌与植物乳杆菌在2 h~12 h处于对数生长期,干酪乳杆菌在2 h~10 h处于对数生长期,鼠李糖乳杆菌在2 h~16 h处于对数生长期;随着时间的延长,不同乳杆菌分别进入稳定期。因此,在后续的试验中,对于副干酪乳杆菌与植物乳杆菌选定培养12 h作为接入发酵液的时间,干酪乳杆菌选定培养时间为10 h,鼠李糖乳杆菌选定为16 h。
2.2 发酵过程中微生物的生长变化
在发酵过程中,微生物的生长可以为发酵的特性提供重要的信息。以发酵时间为横坐标,活菌数的对数值为纵坐标,绘制微生物总数的变化曲线,如图2所示。

图2 不同乳酸菌发酵过程中菌落总数的变化Fig.2 Changes of total bacterial count during fermentation by different lactic acid bacterial strains
由图2可知,4种乳酸菌在基础培养基中经过活化培养后按1×108cfu/mL接种量接种到发酵液中,第1天测定4种乳酸菌数量明显降低,这是由于将乳酸菌接种到新的坏境中需要一个适应过程,从第2天开始,不同乳酸菌数量迅速增加,干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌在第4天达到最大值,其后略有下降,在5d~13d达到稳定。副干酪乳杆菌在第5天达到最大值,其后略有下降,在6d~13d达到稳定。在13d后4种乳酸菌数量都降低,可能是由于发酵过程中pH值的变化,pH值不断降低,在一定程度上能够抑制微生物的生长[19]。
2.3 发酵过程中pH值和总酸的变化
在乳酸菌发酵过程中,pH值和总酸可间接反映乳酸菌在发酵液中的生长状况以及乳酸菌作为饮料发酵菌种的潜质[20]。因此pH值和总酸是乳酸菌发酵特性的重要指标。不同乳酸菌发酵对pH值和总酸变化的影响见图3。

图3 不同乳酸菌发酵过程中pH值和总酸的变化Fig.3 Changes in pH and total acid during fermentation by different lactic acid bacterial strains
由图3(a)可知,发酵液最初pH值约为4.10。在15 d内,随着发酵时间的延长,4种乳酸菌在发酵过程中pH值变化规律一致,均呈下降趋势;其中,在发酵第15天时干酪乳杆菌、植物乳杆菌发酵液的pH值最低,分别为3.01和3.04。由图3(b)可知,初始总酸含量约为2.50 g/L,在15 d的发酵时间内,随着发酵时间的延长,4种乳酸菌在发酵过程中总酸含量变化趋势一致,均呈增加趋势,在0~7 d这种增加趋势尤为明显,7 d~15 d,总酸含量较为稳定。不同菌种的产酸能力不同,这4种乳酸菌在葡萄发酵液中的产酸能力大小依次为干酪乳杆菌﹥植物乳杆菌﹥副干酪乳杆菌﹥鼠李糖乳杆菌,这与图3不同乳酸菌pH值的变化相符合,干酪乳杆菌发酵15 d时总酸含量最大,达到8.40 g/L。陈晓维等[21]用不同乳酸菌发酵冬瓜汁也得到相似结果。pH值和总酸含量的变化可能是由于乳酸菌发酵过程中产生的有机酸浓度增加,尤其是乳酸的产生。
2.4 发酵过程中总酚含量的变化
不同乳酸菌发酵对总酚含量变化的影响见图4。
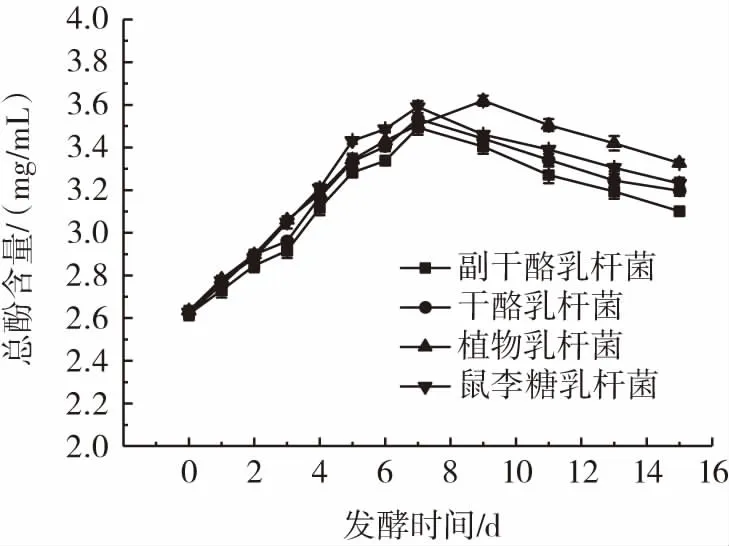
图4 不同乳酸菌发酵过程中总酚含量的变化Fig.4 Changes in total phenol content during fermentation by different lactic acid bacterial strains
由图4可知,总酚含量在发酵前约为2.63 mg/mL。在15 d的发酵时间内,随着发酵时间的延长,不同乳酸菌在发酵过程中总酚含量变化趋势一致,均呈先增加后减少的趋势,干酪乳杆菌、副干酪乳杆菌和鼠李糖乳杆菌在发酵第7天总酚含量达到最大,分别为3.53、3.49 mg/mL和3.59 mg/mL,植物乳杆菌在发酵第9天达到最大,为3.62 mg/mL。有研究表明,微生物的转化以及一些化合物解聚作用能够解释在发酵过程中总酚含量的增加[22],另外,在发酵过程中,一定浓度的酚类物质又可以起到抑菌作用,而乳酸菌为了保持生长会降解酚类,这一活动可能会导致总酚含量的降低[23]。
2.5 发酵过程中SOD酶活力的变化
SOD是最重要的抗氧化酶之一,一些乳酸菌能在发酵过程中产生SOD,提高系统的抗氧化活性。不同乳酸菌发酵对SOD酶活力变化的影响见图5。

图5 不同乳酸菌发酵过程中SOD酶活力的变化Fig.5 Changes in SOD activity during fermentation by different lactic acid bacterial strains
由图5可知,在发酵过程中,随着发酵时间的延长,不同乳酸菌在发酵过程中SOD酶活力变化趋势一致,均呈先增加后减少的趋势,干酪乳杆菌在发酵第6天SOD酶活力达到最大,为284.57 U/mL,副干酪乳杆菌在发酵第7天达到最大,为274.26 U/mL,植物乳杆菌和鼠李糖乳杆菌在发酵第9天达到最大,分别为262.22 U/mL和272.33 U/mL。有研究表明,发酵期超氧化物歧化酶(SOD)活性的增加可能与菌株的生长有关,SOD是一种胞内酶,可通过微生物的细胞裂解而释放[24]。SOD活性的降低可能是在发酵温度条件下SOD本身的不稳定性引起的,也有可能是由于乳酸菌的生长受环境(例如pH值、压力)变化的影响,进而影响SOD 酶活力[25]。
2.6 发酵过程中DPPH自由基清除率变化
DPPH自由基是较稳定的自由基,与其他测定抗氧化能力的方法相比,DPPH自由基清除法可以短时间内评价抗氧化活性。不同乳酸菌在发酵过程中DPPH自由基清除率的变化见图6。
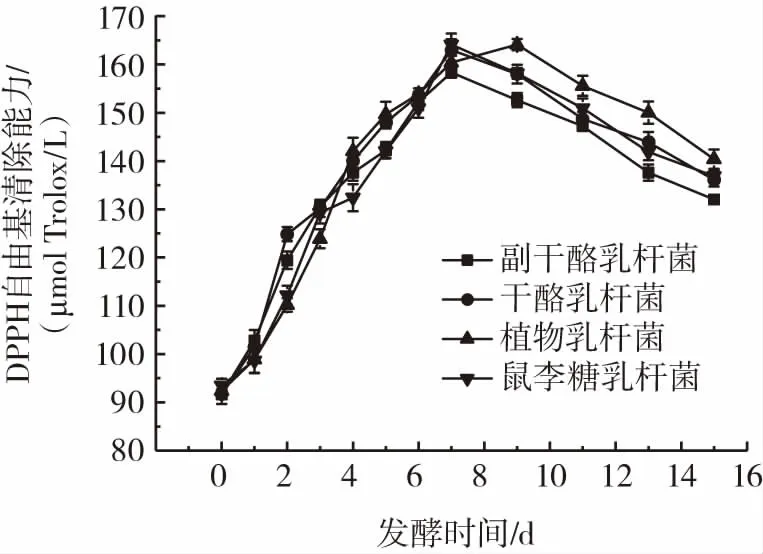
图6 不同乳酸菌发酵过程中DPPH自由基清除能力变化Fig.6 Changes in DPPH radical scavenging activity during fermentation by different lactic acid bacterial strains
由图6可知,在发酵期内,不同乳酸菌在发酵过程中DPPH自由基清除能力均呈现先增加后减少的趋势。副干酪乳杆菌、干酪乳杆菌和鼠李糖乳杆菌在发酵第7天达到最大,分别为158.34、162.98 μmol Trolox/L和164.09 μmol Trolox/L。植物乳杆菌在发酵第9天达到最大,为164.08 μmol Trolox/L。结合图4中总酚含量的变化曲线图,有研究认为酚类物质可以提供出一个氢离子,并通过共振杂化而稳定,影响自由基清除率[26]。
2.7 发酵过程中ABTS+自由基清除能力的变化
ABTS+自由基清除能力是评价体外抗氧化能力应用较为广泛,也是较为简单的方法。不同乳酸菌在发酵过程中ABTS+自由基清除能力的变化见图7。

图7 不同乳酸菌发酵过程中ABTS+自由基清除能力的变化Fig.7 Changes in ABTS+radical scavenging activity during fermentation by different lactic acid bacterial strains
由图7可知,在发酵期内,不同乳酸菌在发酵过程中ABTS+自由基清除能力变化曲线与DPPH自由基清除率的变化曲线相似,均呈现先增加后减少的趋势。副干酪乳杆菌与鼠李糖乳杆菌在发酵第7天达到最大,分别为 334.35、338.53 μmol Trolox/L。干酪乳杆菌与植物乳杆菌在发酵第9天达到最大,分别为41.44、346.97 μmol Trolox/L。
2.8 发酵过程中铁离子还原能力(FRAP)的变化
抗氧化物质可以通过自身的还原作用破坏自由基的链式反应,并给出电子清除自由基,还原力是物质提供电子的能力,物质的还原能力与多种抗氧化机制有关。不同乳酸菌在发酵过程中还原力的变化见图8。
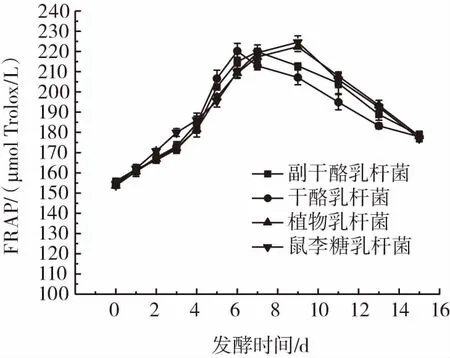
图8 不同乳酸菌发酵过程中还原力的变化Fig.8 Changes in reducing power during fermentation by different lactic acid bacterial strains
由图8可知,在发酵期内,不同乳酸菌在发酵过程中铁还原能力变化均呈现先增加后减少的趋势。干酪乳杆菌在发酵第6天达到最大,为220.19μmolTrolox/L、副干酪乳杆菌在发酵第7天达到最大,为219.87μmolTrolox/L。鼠李糖乳杆菌与植物乳杆菌在发酵第9天达到最大,分别为224.636μmolTrolox/L和222.41μmolTrolox/L。这4种不同乳酸菌发酵葡萄酵素抗氧化能力测定指标DPPH自由基、ABTS+自由基和FRAP变化趋势大致相同,在6 d~9 d达到最大值,这与Yang等[13]对乳酸菌发酵蔬菜水果混合饮料抗氧化性能分析相一致。
3 结论
本试验以巨峰葡萄为原料,通过比较4种不同乳酸菌发酵葡萄酵素过程中pH值、总酸、菌落总数、总酚、SOD酶活力以及抗氧化活性的动态变化,得出结论:本试验选择的4种乳酸菌均能在发酵过程中较好的生长且均能产酸,总酸含量变化趋势一致,均呈增加趋势,不同菌种的产酸能力不同,这4种乳酸菌在葡萄发酵液中的产酸能力大小依次为干酪乳杆菌﹥植物乳杆菌﹥副干酪乳杆菌﹥鼠李糖乳杆菌。不同乳酸菌在发酵过程中总酚含量、SOD酶活力变化均呈先增加后减少的趋势,抗氧化性测定指标DPPH自由基清除能力、ABTS+自由基清除能力和FRAP变化趋势与总酚变化趋势大致相同,表明抗氧化活性的大小与总酚含量具有一定的相关性,这4种乳酸菌均能用于葡萄酵素的发酵。
