长白山紫苏黄酮提取及其对小鼠非特异性免疫功能研究
2022-01-08吕萍
吕萍
(吉林农业科技学院食品工程学院,吉林 吉林 132101)
紫苏(Perilla frutescens L.Britt.)又名桂荏、赤苏、香苏等,属唇形科一年生草本植物,原产于东亚地区[1-4],因其显著的经济效益,现欧美一些国家也有大面积商业种植,中国是紫苏栽种面积和年出口量较大的国家[5]。北方以油用为主,兼以药用;南方以药用为主,兼作香料和食用[6]。紫苏叶、茎和果实均能入药,在医药领域有重要价值,紫苏是卫生部第一批规定的既是药品又是食品的60种作物之一[7],其中紫苏叶(Folium Perillae)常用入药,始记于《名医别录》,称其“主下气,除寒中。”《本草汇言》提到紫苏“散寒气,清肺气,宽中气,安胎气,下结气,化痰[8-12]。”紫苏叶有多种生物活性成分,主要有黄酮类、挥发油类、酚酸类、花色苷类、多糖类、三萜类、甾体类化合物等,其中黄酮类化合物具有增强免疫力、抗癌、抗氧化、抗炎、降血糖等生理功能[13-16]。
随着人们保健意识的增强,紫苏叶因其既能作为食材又有生理功效逐渐成为研究热点。目前对长白山紫苏的研究较少,且较多集中在挥发油方面,对其黄酮及免疫活性研究较少。机体免疫功能分为特异性免疫和非特异性免疫,淋巴细胞可反映机体特异性免疫功能的状态,而巨噬细胞的吞噬作用可反映机体非特异免疫功能的强弱。目前,国内外学者广泛使用小鼠碳粒廓清实验作为药物及生理活性物质对非特异性免疫功能影响的检测指标。因此,本文通过正交试验优化超声波辅助提取长白山道地紫苏黄酮,并采用小鼠碳粒廓清法研究长白山紫苏黄酮的非特异性免疫活性,以期为长白山紫苏的深加工及综合利用提供支持。
1 材料与方法
1.1 材料与仪器
长白山地区紫苏叶:市售,经烘干粉碎后备用;芦丁标准品(纯度>96.6%)、乙醇、甲醇、正丁醇、浓盐酸、锌粉、三氯化铝、亚硝酸钠、硝酸铝、氢氧化钠、碳酸钠、碳酸氢钠、印度墨汁、环磷酰胺(均为分析纯):国药集团化学试剂有限公司。
实验动物(KM 小鼠 SPF 级,18 g~20 g):辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2015-0001,动物于实验前在动物房环境适应1周。
毛细管(100 mm,1.8 mm~2.2 mm):国药集团化学试剂有限公司;电子天平(BEM220.4):上海卓精电子科技有限公司;多功能粉碎机(XS-10):上海兆申科技有限公司;超声波清洗机(JL-60DT):上海杰理科技有限公司;离心机(H2050R-1):湖南湘仪实验室仪器开发有限公司;紫外可见分光光度计(752N):上海仪器分析有限公司;电热恒温鼓风干燥箱(DHG-9223A型):成都瑞派斯科技有限公司;恒温水浴锅(HH-5):苏州威尔实验仪器开发有限公司;旋转蒸发仪(RE-52AA):上海亚荣生化仪器厂。
1.2 试验方法
1.2.1 工艺流程
长白山紫苏鲜叶→除杂→干燥→粉碎→称重→浸泡→定性分析→超声波辅助提取→冷却→离心→定容→定量分析→紫苏黄酮→非特异性免疫活性分析
1.2.2 原料预处理
长白山紫苏经人工除杂、80℃干燥1 h、粉碎等预处理后,加入一定量乙醇溶液,采用超声波辅助法浸提紫苏黄酮。
1.3 长白山紫苏黄酮的定性分析
1.3.1 HCl-Zn粉反应
取5 mL长白山紫苏黄酮提取液,加少许锌粉振摇,再滴加几滴浓盐酸,必要时加热显色,HCl-Zn粉反应中显示淡红色,说明有黄酮的存在[17-18]。
1.3.2 三氯化铝反应
取5 mL样品的乙醇溶液,加l%三氯化铝甲醇溶液,呈色。三氯化铝反应中显示亮黄色,说明有黄酮的存在[19-22]。
1.4 长白山紫苏黄酮的定量分析
1.4.1 芦丁标准曲线的绘制
取芦丁标准液(0.3 mg/mL)1、2、5、8 mL 置于 25 mL容量瓶中,用30%乙醇溶液补充至12.5 mL,加入0.7 mL NaNO2溶液摇匀,放置5 min后加入0.7 mL A(lNO3)3溶液,6 min后再加入5 mL NaOH溶液,用30%乙醇溶液定容。10 min后于波长510 nm处进行比色测定,以试剂空白做参比。取长白山紫苏提取液和对照品溶液各5 mL按上述方法显色后在510 nm处测其吸光度,代入回归方程计算得率。
1.4.2 长白山紫苏黄酮得率的计算
长白山紫苏黄酮得率的计算公式如下。

式中:C为提取液中的黄酮浓度,mg/mL;V为提取液的体积,mL;N为上清液稀释倍数;M为原料的质量,g。
1.5 长白山紫苏总黄酮提取的单因素试验
1.5.1 乙醇浓度对紫苏黄酮得率的影响
分别准确称取紫苏的烘干样5 g各5份于锥形瓶中,在超声功率为 400 W,料液比为 1∶20(g/mL),提取温度为50℃,乙醇浓度分别为50%、60%、70%、80%、90%下提取30 min。之后在4 000 r/min转速下离心10 min,取上清液按1.4.1的方法测定吸光度,计算出黄酮的得率,试验做3次重复,计算平均值,研究不同乙醇浓度对紫苏中黄酮得率的影响[23]。
1.5.2 料液比对紫苏黄酮得率的影响
取紫苏叶的烘干样5 g各5份于锥形瓶中,在超声功率为400 W,选取乙醇浓度为70%,提取温度为50 ℃,料液比 1∶10、1∶20、1∶30,1∶40、1∶50(g/mL)下提取30 min。之后在4 000 r/min转速下离心10 min,取其上清液按1.4.1的方法测定吸光度,计算出黄酮的得率,试验做3次重复,计算平均值,研究不同料液比对紫苏中黄酮得率的影响。
1.5.3 提取温度对紫苏黄酮得率的影响
分别准确称取紫苏叶的烘干样5 g各5份于锥形瓶中,在超声功率为400 W,选取乙醇浓度为70%,料液比 1∶20(g/mL),提取温度分别为 30、40、50、60、70 ℃下提取30 min。提取后冷却至室温(20℃),在4 000 r/min转速下离心10 min,取其上清液按1.4.1的方法测定吸光度,计算出黄酮的得率,试验做3次重复,计算平均值,研究不同提取温度对紫苏中黄酮得率的影响。
1.5.4 超声时间对紫苏黄酮得率的影响
分别准确称取紫苏的烘干样5 g各5份于平底烧瓶中,在超声功率为400 W,选取乙醇浓度为70%,料液比 1∶20(g/mL),分别于 50 ℃水浴超声提取 15、20、25、30、35 min,之后在4 000 r/min转速下离心10 min,取其上清液按1.4.1的方法测定吸光度,计算出黄酮的得率,试验做3次重复,计算平均值,研究不同料液比对紫苏中黄酮得率的影响。
1.6 长白山紫苏黄酮提取的正交试验优化
根据单因素试验结果,针对影响长白山紫苏黄酮提取的4个因素,即乙醇浓度、料液比、提取温度和超声时间作为考察因子,以长白山紫苏黄酮得率为考察指标,进行L9(34)正交试验,正交试验因素水平见表1。

表1 正交试验因素水平Table 1 Factors level of orthogonal test
1.7 长白山紫苏黄酮非特异性免疫活性研究
通过碳粒廓清实验测定长白山紫苏黄酮的免疫活性,将75只KM小鼠,6周龄~8周龄,体重18 g~22 g,随机分为5组,每组15只。分别为空白组、环磷酰胺(cyclophosphamide,Cy)模型对照组、低剂量黄酮组(100 mg/kg)、中剂量黄酮组(200 mg/kg)、高剂量黄酮组(300 mg/kg)。除空白组外,其他各组小鼠根据体重每天腹腔注射环磷酰胺(50 mg/kg)连续4 d,建立小鼠免疫抑制模型。建模后,使用相应剂量紫苏黄酮对各组小鼠进行灌胃,空白组和模型组给予等体积的生理盐水(0.2 mL/10 g),每天称重、灌胃1次,于第14天给药1 h后,对每只小鼠尾静脉注射经稀释的印度墨汁(0.1 mL/10 g),待墨汁注入,立即计时。2 min(t1)和10 min(t2)后,分别从每只小鼠眼眶静脉丛取血 40 μL于4mL0.1%的NaHCO3溶液中,用752N紫外分光光度计在600 nm处测其吸光度OD值,以0.1%的NaHCO3溶液空白调零,以计算碳粒廓清指数K。然后将小鼠处死,取肝脏、脾脏,用滤纸吸干表面的血液,称其重量,同时称体重、胸腺重和肝脾重,按下列公式计算胸腺指数、脾指数、碳粒廓清指数K和吞噬指数α[24-25]。
胸腺指数=胸腺重(mg)/体重(g);脾指数=脾脏重(mg)/体重(g)。
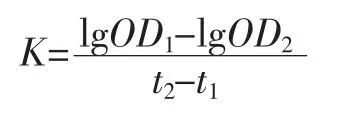
式中:K 为碳粒廓清指数;OD1、OD2分别为 2、10min时采血的吸光度;t2-t1为两次采血的时间差,min。
α=体重(g)/[肝重(g)+脾重(g)]×K1/3
1.8 数据分析
文中采用Excel作图,利用SPSS 17.0软件对数据进行统计学描述和分析,采用单因素方差分析进行多组间均值比较,结果以平均值±标准差表示。
2 结果与分析
2.1 长白山紫苏黄酮的定性分析
长白山紫苏黄酮的定性结果见图1。

图1 长白山紫苏黄酮的定性结果Fig.1 Qualitative results of flavonoids from Changbai Mountain Perilla
如图1所示,1号试管为空白对照,2号试管为盐酸-锌粉法的比色结果,HCl-Zn粉反应显示淡红色,说明有黄酮的存在,3号试管为三氯化铝法的显色结果,三氯化铝反应显示亮黄色,均证明有黄酮存在。
2.2 芦丁标准曲线
芦丁标准曲线见图2。
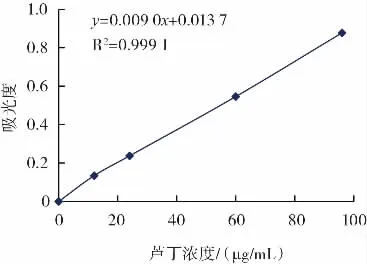
图2 芦丁标准曲线Fig.2 Rutin standard curve
由标准曲线得到回归方程:y=0.009 0x+0.013 7,R2=0.999 1。
2.3 长白山紫苏黄酮提取的单因素试验
2.3.1 乙醇浓度对紫苏黄酮得率的影响
乙醇浓度对紫苏黄酮得率的影响见图3。
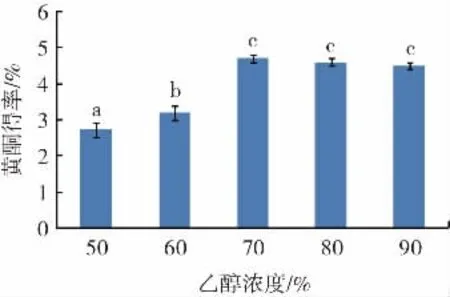
图3 乙醇浓度对长白山紫苏黄酮得率的影响Fig.3 Effect of ethanol solution concentration on flavonoids yield of Changbai Mountain Perilla
由图3可知,长白山紫苏黄酮的得率在乙醇浓度为70%~90%时较高。当乙醇浓度为70%时,黄酮得率最高,为4.7%,可能是增加乙醇浓度可以提高溶液对紫苏物料的渗透性,进而提高紫苏中黄酮得率。乙醇浓度增到90%,黄酮得率略微下降,可能是高浓度乙醇会使紫苏细胞内的蛋白质发生变性凝固,进而影响黄酮溶出。故选用浓度为70%~90%的乙醇进行后续的优化试验。
2.3.2 料液比对紫苏黄酮得率的影响
料液比对长白山紫苏黄酮得率的影响见图4。
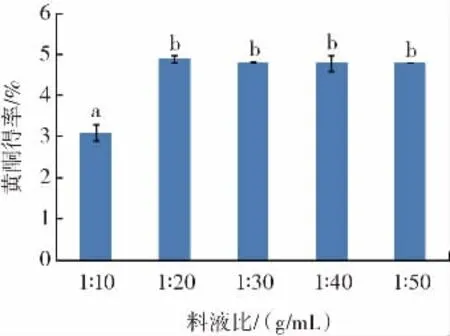
图4 料液比对长白山紫苏黄酮得率的影响Fig.4 Effect of material-liquid ratio on the flavonoids yield of Changbai Mountain Perilla
由图4可知,长白山紫苏黄酮得率随着溶剂用量的增加呈现先增长后缓慢降低的趋势。料液比1∶20(g/mL)时黄酮得率最高,为4.9%,料液比达到1∶50(g/mL)时,黄酮得率变化较小,可能是随着溶剂用量的持续增加,黄酮物质的浸出也趋于稳定状态,考虑到溶剂的增加会造成资源浪费,因此选取料液比1∶20(g/mL)进行后续的优化试验。
2.3.3 提取温度对紫苏黄酮得率的影响
提取温度对长白山紫苏黄酮得率的影响见图5。
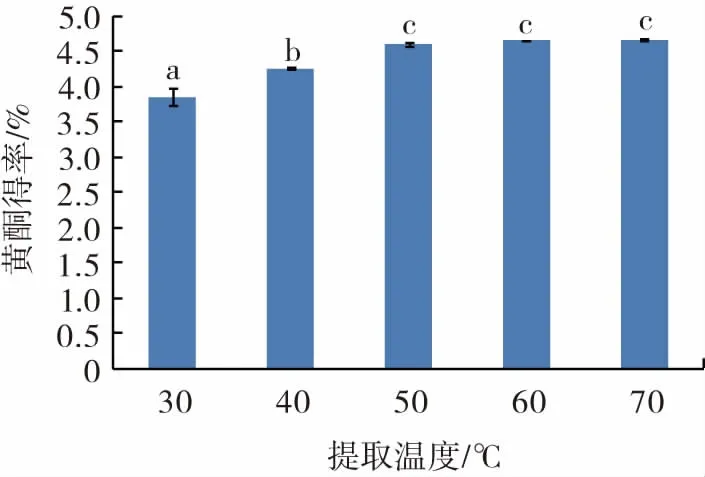
图5 提取温度对长白山紫苏黄酮得率的影响Fig.5 Effect of extraction temperature on flavonoids yield of Changbai Mountain Perilla
由图5可知,长白山紫苏叶中黄酮得率随着提取温度的升高呈现先增长后缓慢上升的趋势。随着温度的增加,黄酮的得率会增加,这说明温度越高,黄酮的溶解率越高,但在50℃~70℃范围内变化并不大。考虑到节省成本,故选提取温度50℃左右为宜。
2.3.4 超声时间对紫苏黄酮得率的影响
超声时间对紫苏黄酮得率的影响见图6。
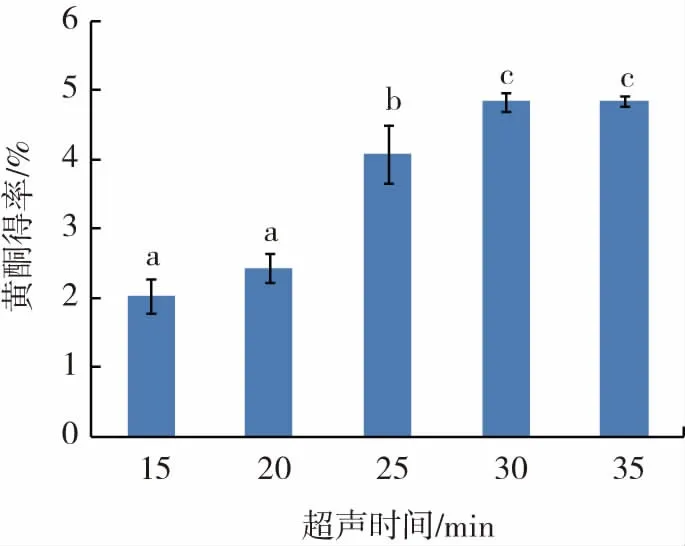
图6 超声时间对长白山紫苏黄酮得率的影响Fig.6 Effect of ultrasonic time on flavonoids yield in Changbai Mountain Perilla
由图6可知,长白山紫苏叶黄酮在提取时间为15 min~30 min时,黄酮的得率随着超声时间的延长逐渐上升。可能是随着超声时间的增加,黄酮类物质不断地从物料中溶出,在30 min时溶出较多,此时黄酮得率最大。超声时间在30 min之后,黄酮得率趋于稳定,这可能是紫苏黄酮已基本被溶出,所以继续延长超声时间也不能使得率产生明显的提高。此外由于长时间的超声波辐射,也会使一些热不稳定的黄酮变性损失,或者导致溶剂挥发,从而影响黄酮提取效果,使黄酮得率下降。因此选用30 min左右的超声时间进行后续的优化试验。
2.4 正交优化试验
根据单因素试验结果,针对影响长白山紫苏黄酮提取的4个因素,即乙醇浓度、料液比、提取温度和超声时间作为考察因子,以长白山紫苏黄酮得率为考察指标,进行L9(34)正交试验,试验结果见表2,方差分析见表3,Duncan检验分析结果见表4。

表2 正交试验结果分析Table 2 Analysis of orthogonal test results
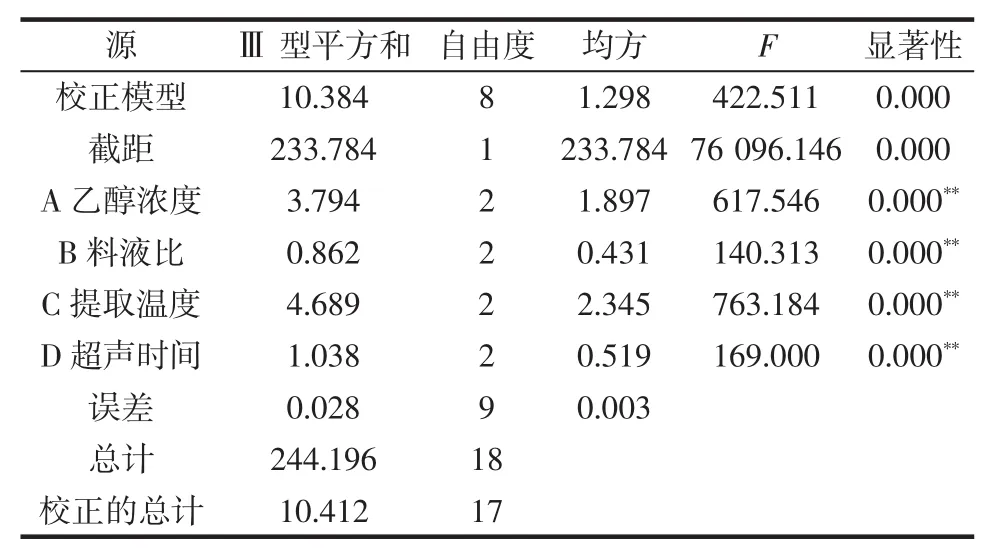
表3 方差分析Table 3 Analysis of variance

表4 Duncan检验分析结果Table 4 The results of Duncan tests
由表3和表4可知,乙醇浓度、料液比、提取温度、超声时间4个因素均对长白山紫苏黄酮得率有显著影响,4个因素对长白山紫苏黄酮得率的影响主次顺序:提取温度>乙醇浓度>超声时间>料液比。最优的浸提工艺条件是A1B2C2D3,即提取的最佳条件:乙醇浓度70%、料液比 1∶20(g/mL)、提取温度 50 ℃、超声时间35 min,在此条件下长白山紫苏黄酮的得率为5.01%。
2.5 长白山紫苏黄酮非特异性免疫活性的研究
碳粒廓清实验是通过测定血液中碳粒的消失速度来反映单核巨噬细胞系统吞噬异物的能力,碳粒廓清指数K和吞噬指数α越大,表明其体内免疫作用越强[25]。长白山紫苏黄酮对小鼠巨噬细胞吞噬功能的影响结果见表5,对Cy诱导免疫低下模型小鼠胸腺及脾指数的影响见表6。
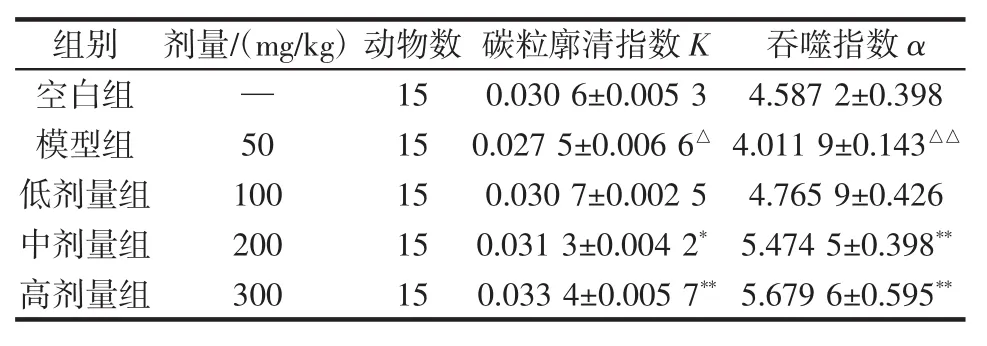
表5 长白山紫苏黄酮对小鼠巨噬细胞吞噬功能的影响Table 5 Effect of flavonoids from Changbai Mountain Perilla phagocytic function of macrophages in mice
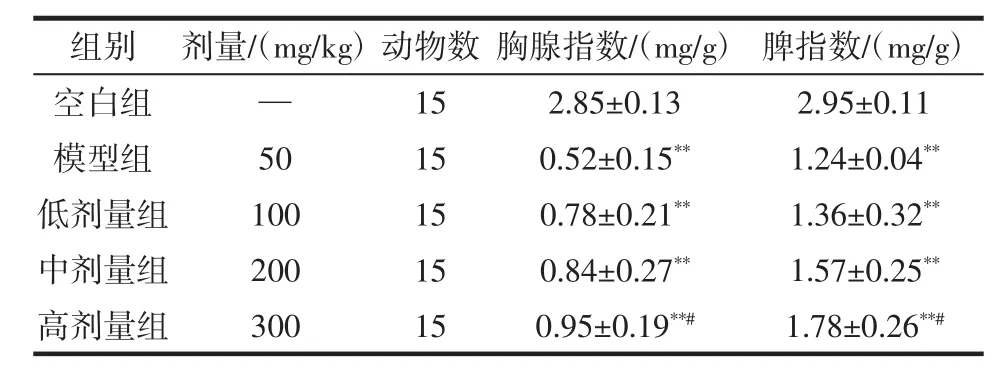
表6 长白山紫苏总黄酮对Cy诱导免疫低下模型小鼠胸腺及脾指数的影响Table 6 Effect of total flavonoids from Changbai Mountain Perilla on thymus and spleen index of Cy induced immunosuppression mice
由表5可知,模型组动物碳粒廓清指数K及吞噬指数α明显低于空白组,表明用此剂量的环磷酰胺能造成小鼠免疫低下模型,相对于对照组,实验组的K值和α值都有提高,并且中、高剂量组呈现了显著(p<0.05)或极显著性差异(p<0.01),表明中、高剂量的长白山紫苏黄酮均能不同程度地提高Cy模型小鼠碳粒廓清指数K及吞噬指数α;提示提高长白山紫苏黄酮剂量可增强免疫低下小鼠腹腔巨噬细胞的吞噬功能,具有促进小鼠免疫功能的作用。由表6可知,长白山紫苏黄酮对Cy诱导免疫低下小鼠胸腺指数及脾指数的影响,与空白组相比,模型组及各剂量组小鼠胸腺指数、脾脏指数均极显著降低(p<0.01)。与模型组相比,长白山紫苏黄酮高剂量组小鼠胸腺指数、脾脏指数均显著增加(p<0.05)。模型组小鼠的免疫器官指数显著低于空白对照组,可初步推断免疫抑制组小鼠在灌服Cy后,胸腺、脾脏生长发育受到抑制,因此免疫器官指数下降,而导致小鼠免疫能力降低。而长白山紫苏黄酮高剂量组胸腺及脾脏指数与模型组相比显著增加,表明高剂量组可促进小鼠胸腺及脾脏生长发育,使免疫器官指数升高,小鼠免疫能力增强。
3 结论
通过正交试验优化得到超声波辅助乙醇溶液提取长白山紫苏黄酮的最佳工艺条件:乙醇浓度70%、料液比 1∶20(g/mL)、提取温度 50 ℃、超声时间 35 min,在此条件下,长白山紫苏黄酮的得率为5.01%。且提取温度对得率的影响最大,其次为乙醇浓度、超声时间,料液比对其影响较小。此外,通过小鼠碳粒廓清实验表明长白山紫苏黄酮在适当剂量下能不同程度地提高Cy诱导免疫低下小鼠的巨噬细胞碳粒廓清指数K及吞噬指数α,且高剂量组可促进小鼠胸腺及脾脏生长发育,使免疫器官指数升高,小鼠免疫能力增强,可增强小鼠的非特异性免疫,对小鼠体质有一定的改善作用,为长白山紫苏的进一步研究和开发提供了理论依据,综上,长白山紫苏黄酮可以作为一种免疫促进剂,增强机体的非特异性免疫,有效地发挥免疫调节作用,具有一定的研究价值和开发前景。今后有必要对长白山紫苏黄酮的具体成分,以及与免疫活性相关的成分及其免疫活性机制进行深入研究。
