运用乳腺癌新辅助化疗多基因表达差异构建化疗疗效预测模型
2022-01-06陆眉杨晓娟邹洁雅郭瑢王鑫张倩邓学鹏陶建芬聂建云杨庄青
陆眉,杨晓娟,邹洁雅,郭瑢,王鑫,张倩,邓学鹏,陶建芬,聂建云,杨庄青
0 前言
乳腺癌是女性最常见的恶性肿瘤,发病率及死亡率高居女性恶性肿瘤首位,严重危害女性身心健康[1]。化疗是乳腺癌全身治疗的重要手段,新辅助化疗(neoadjuvant chemotherapy,NAC)指术前化疗,是临床上常用的全身治疗手段,与辅助化疗相比,它在保证长期临床疗效的同时还能使无法手术的肿瘤变得可手术,并提高了保乳手术的比率[2]。更重要的是,NAC的带瘤治疗可视为一个研究平台,在该平台上可以描述传统抗癌药物的生物学作用,鉴定预后和寻找预测性生物标志物,并加快靶向药物的开发[3]。
乳腺癌NAC疗效最为直观的病理指标是病理完全缓解[4](pathological complete response,pCR)。pCR是指NAC后原发灶无浸润性癌残留以及区域淋巴结阴性,分期达到ypT0N0或ypT0/is/ypN0。无论分子亚型或化疗方案是否相同,新辅助治疗后达到pCR均意味着复发率约降低80%[5],此外,达pCR患者可获得更好的长期预后[6]。
乳腺癌的诊治已经进入了精准医学时代,传统的免疫组织化学已经不能满足乳腺癌个体化治疗的预后判断,需要进一步将基因表达特征纳入临床风险分层,以协助判断肿瘤预后[7]。因此,我们选择乳腺癌NAC患者作为研究对象,以NAC后是否达到术后pCR作为疗效分组指标,通过比对乳腺癌NAC前后不同疗效组间基因表达差异,识别乳腺癌化疗耐药相关基因,为精准治疗提供科学数据。
1 资料与方法
1.1 一般资料
经昆明医科大学第三附属医院伦理委员会批准(伦理审批号:KYLX202134)后,收集2018年9月—2019年3月昆明医科大学第三附属医院(云南省肿瘤医院)收治的60例乳腺癌患者化疗前穿刺癌组织、化疗后癌组织(NAC后达pCR的患者无术后癌组织)标本、临床及病理特征等。入组标准:(1)签署知情同意书,自愿加入研究;(2)初诊肿瘤大于2 cm,接受NAC;(3)使用基于蒽环和紫杉类的化疗方案,化疗不少于6周期,每两周期化疗使用MRI进行疗效评估;(4)HER2阳性患者需使用曲妥珠单抗靶向治疗。排除因患者个人因素、中途因经济原因或身体原因、无法规范化行新辅助化疗的患者。
1.2 实验方法
1.2.1 标本采集方法 所收集标本均由昆明医科大学第三附属医院病理科确诊为乳腺癌,采用真空微创旋切针取标本约0.5 g并切碎放置于RNALatte液中,常温放置10 min后,置于-80°C冰箱保存。
1.2.2 高通量RNA-seq样本检测 由北京诺禾致源生物有限公司完成,主要过程包括总RNA样品检测、文库构建及库检、合格样本上机测序及原始数据处理[8-10]。其中,使用Illumina公司高通量测序平台(HiSeq/MiSeq)进行测序。
1.2.3 分组标准 本研究根据NAC后是否达pCR分为化疗敏感组及化疗耐药组,患者达术后pCR视为NAC敏感组,未达pCR(non-pCR)视为NAC不敏感和(或)耐药组。病理完全缓解[4](pCR)的定义为:NAC后病理诊断乳房及腋窝淋巴结均未找到癌细胞或仅残存导管内癌,即术后分期达到ypT0ypN0或ypT0/is/ypN0。
1.3 统计学方法
采用卡方检验评估不同疗效组间患者的基本特征。采用单因素、多因素二元Logistic回归分析评价临床病理特征。非参数U检验、W检验评估目标预测基因在NAC前后表达差异及不同疗效组间表达的差异,建立单因素及多因素Logistic回归模型,将模型用来制作列线图并预测每例患者NAC后能达到non-pCR的可能性。采用随机抽样法进行内部验证,抽样次数设为1 000,用Hosmer-Lemeshow拟合优度检验评价校正曲线。检验方法均采用双尾检验,统计软件使用SPSS25.0和R软件3.5.1版,检验水准设定P<0.05为差异有统计学意义。
2 结果
2.1 患者基线信息特征
两组患者临床特征基线齐,差异无统计学意义,具有可比性,见表1。
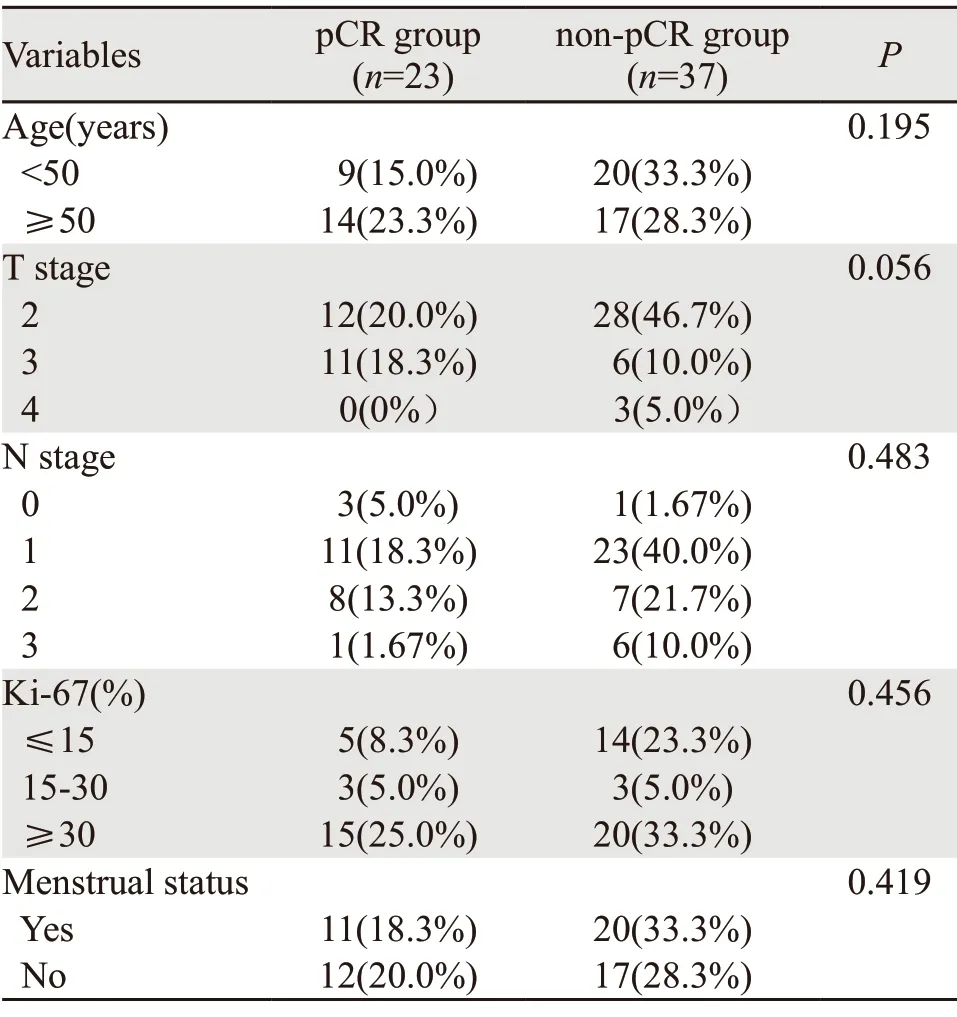
表1 新辅助化疗pCR组与non-pCR组化疗前基本特征Table 1 Basic information of pCR group and non-pCR group before NAC
2.2 60例乳腺癌患者NAC前后RNA-Seq表达变化
2.2.1 NAC后疗效反应及non-pCR组NAC前后RNA-Seq表达变化接受NAC后,37例(61.7%)患者未获得pCR(non-pCR),23例(38.3%)患者获术后pCR,无化疗后癌组织标本,所以仅收取NAC前肿瘤标本。在non-pCR组中,在排除非编码RNA的基础上,选取NAC前后上调或下调大于2倍、P<0.05的差异基因,其中,化疗后残余癌组织基因表达上调953个,下调2 041个,见图1。
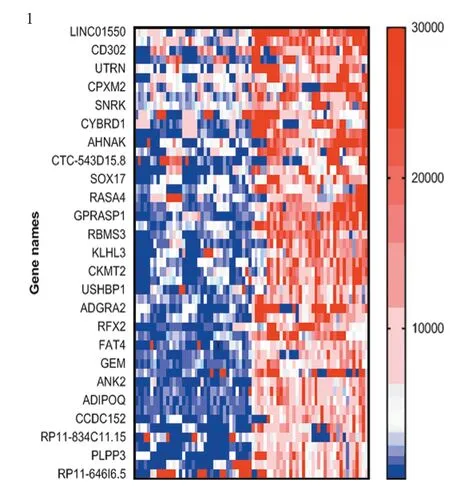
图1 新辅助化疗前(左半部分)后(右半部分)基因表达差异Figure 1 Different gene expressions before (left half part) and after (right half part) neoadjuvant chemotherapy
2.2.2 non-pCR组与pCR组RNA-Seq表达差异 37例non-pCR与23例pCR相比,选取上调或下调大于两倍、P<0.05的差异基因,其中,nonpCR组较pCR组上调基因457个,下调基因1 361个,见图2。
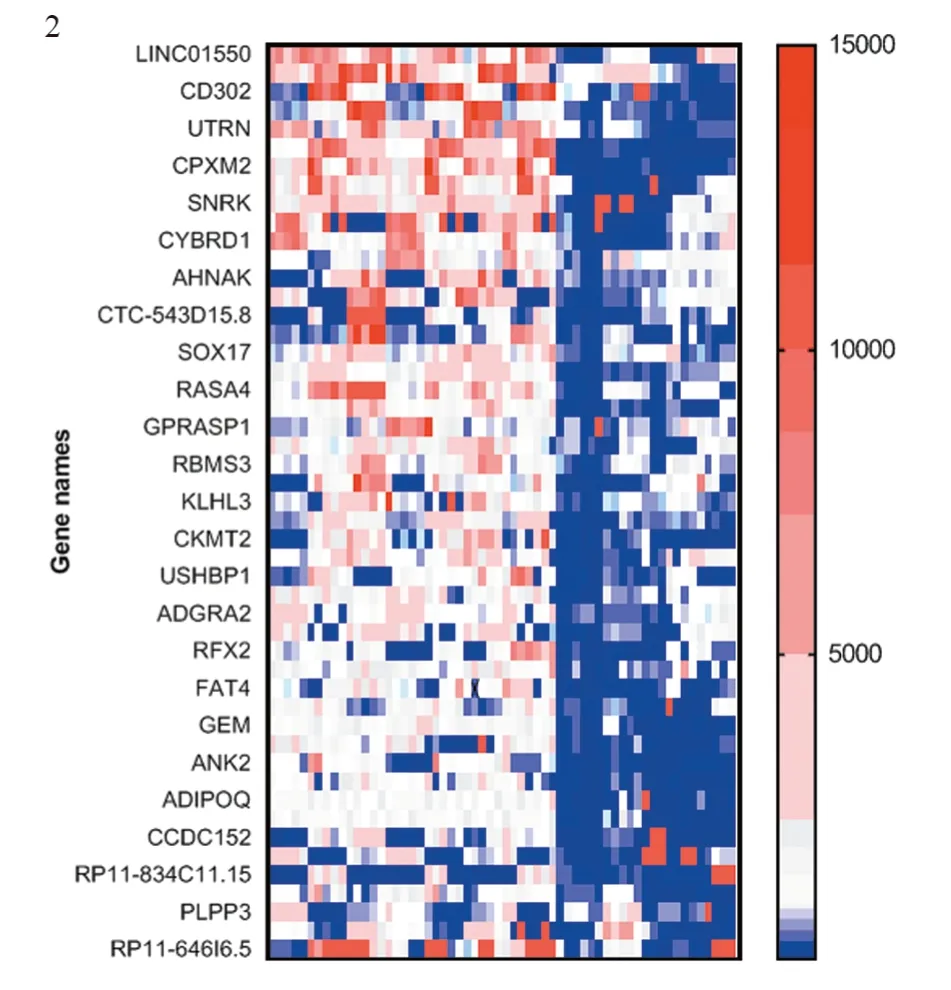
图2 non-pCR(图左半部分前37列)与pCR(右半部分后23列)患者部分基因高表达Figure 2 High expression of some genes in non-pCR group (the left anterior 37 columns) and pCR group (the right posterior 23 columns)
2.2.3 乳腺癌NAC潜在耐药基因的筛选 进一步筛选NAC后表达上调大于两倍同时在non-pCR患者中显著高于pCR患者两倍的差异基因,最后,共找到满足条件的基因28个,见图3。在这28个基因中,通过基因在乳腺癌中的表达量、基因功能、在肿瘤中的相关研究作为参考指标,最终选定AHNAK、CIDEA、ADIPOQ、AKAP12作为研究对象,它们可能与化疗耐药密切相关,具有预测患者NAC疗效的潜力。
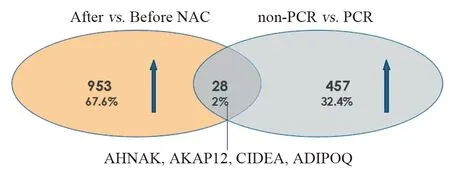
图3 乳腺癌新辅助化疗NAC潜在耐药基因筛选流程Figure 3 Screening of potential drug-resistant genes in breast cancer for NAC
接受NAC后,在37例non-pCR组中,采用非参数威尔科克森W检验(Wilcoxon test)进行评估,结果显示,目标预测基因AHNAK、CIDEA、ADIPOQ、AKAP12在NAC前后表达差异具有统计学意义(P<0.05),见图4。
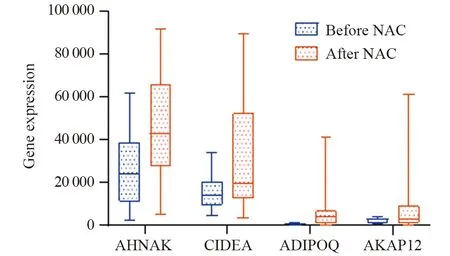
图4 AHNAK、CIDEA、ADIPOQ、AKAP12在乳腺癌新辅助化疗前后表达箱式图Figure 4 Box-plot of AHNAK,CIDEA,ADIPOQ,AKAP12 expression before and after NAC in non-pCR group
2.2.4 目标预测因子在NAC前后及pCR组与nonpCR组的表达 接受NAC前,根据37例non-pCR组与23例pCR组中AHNAK、CIDEA、ADIPOQ、AKAP12的表达中位数、25%分位数、75%分位数绘制箱式图,采用非参数曼-惠特尼U检验(Mann Whitney U test)评估两组数据,结果显示,AHNAK、CIDEA、ADIPOQ、AKAP12基因表达在pCR组与non-pCR组间差异均有统计学意义(P<0.05),见图5。
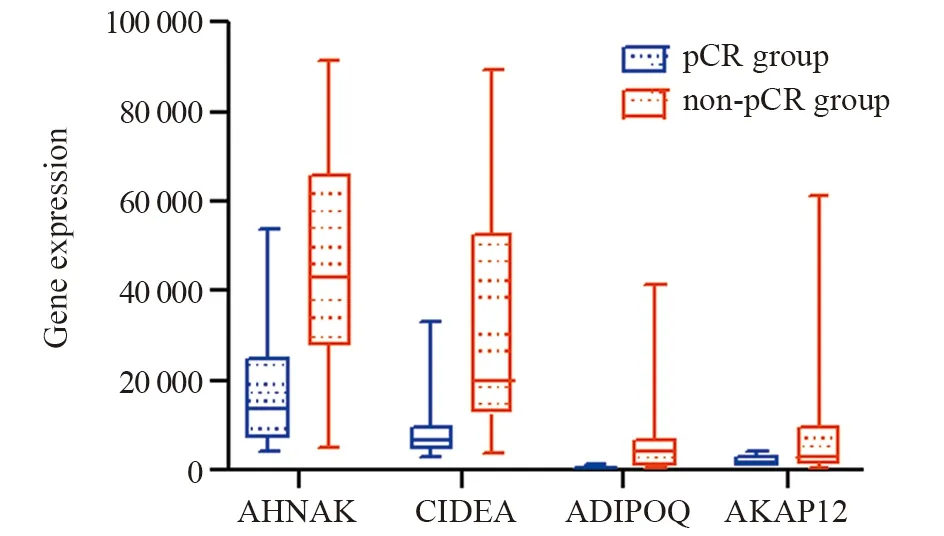
图5 pCR组与non-pCR组中RAHNAK、CIDEA、ADIPOQ、AKAP12在乳腺癌新辅助化疗前表达箱式图Figure 5 Box-plot of AHNAK,CIDEA,ADIPOQ and AKAP12 expression before NAC in pCR and non-pCR group
2.3 目标预测因子与NAC后是否达pCR的Logistic关系
所有临床指标及表达差异显著的基因均列入候选变量,通过单因素分析显示,年龄、T分期、N分期、Ki-67、月经状况与乳腺癌患者接受NAC后是否达到non-pCR无关,而AHNAK、CIDEA、ADIPOQ、AKAP12高表达增加了患者无法达到pCR(non-pCR)的可能性,预测基因的表达差异具有统计学意义(P<0.05)。将单因素分析中有差异的指标AHNAK、CIDEA、ADIPOQ、AKAP12采用进入法纳入多因素模型分析,4个因素均纳入时各因子OR均>1(P<0.05),见表2。因此,AHNAK、CIDEA、ADIPOQ、AKAP12的表达量增高可能是乳腺癌患者NAC疗效不佳(nonpCR)的危险因素。
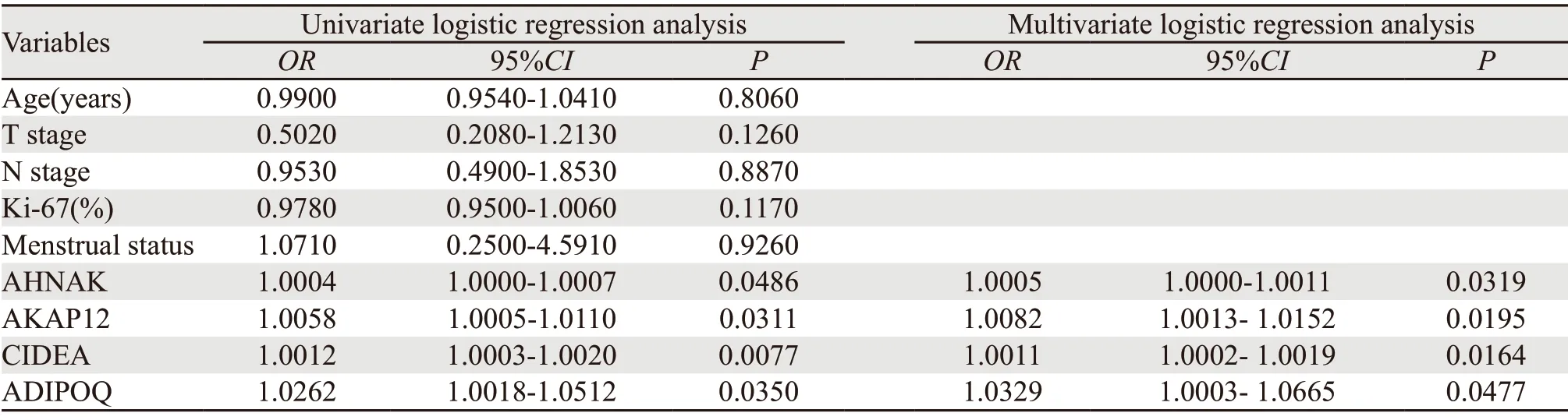
表2 乳腺癌新辅助化疗疗效单因素及多因素分析 (N=60)Table 2 Univariate and multivariate logistic regression analyses for NAC efficacy (N=60)
2.4 构建乳腺癌NAC疗效预测模型并验证
2.4.1 疗效预测模型列线图绘制 将患者AHNAK、CIDEA、ADIPOQ、AKAP12纳入疗效预测模型,采用R软件绘制列线图,AHNAK、CIDEA、ADIPOQ、AKAP12均为连续变量(由于各基因表达量较大,故以10为1个单位),见图6。
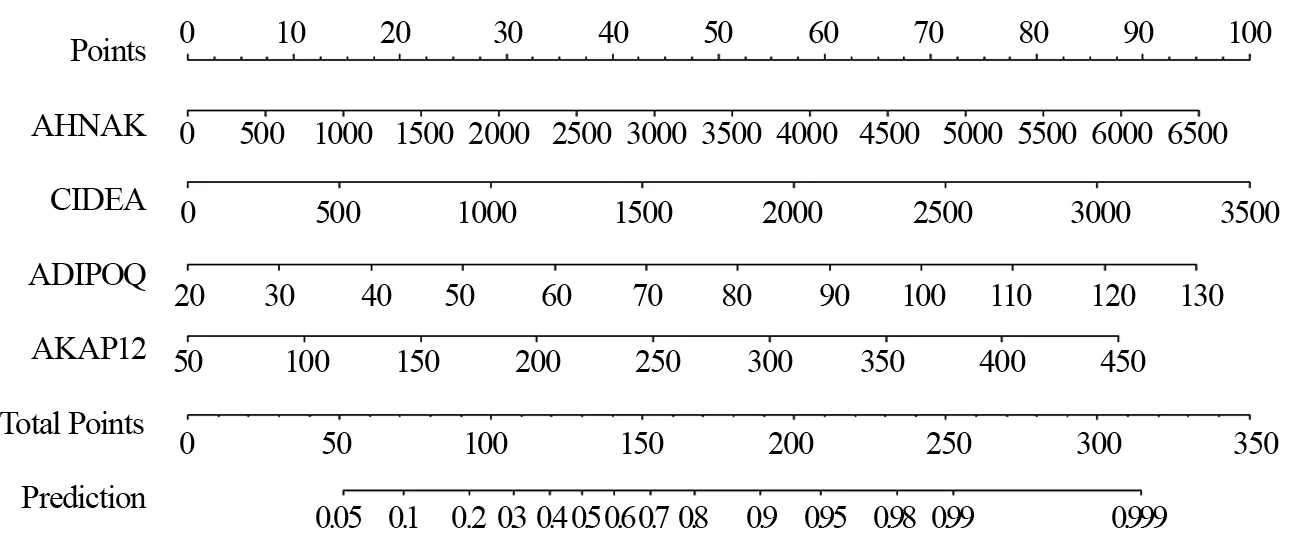
图6 基于AHNAK、CIDEA、ADIPOQ、AKAP12表达构建的乳腺癌NAC疗效预测模型列线图Figure 6 Nomogram for efficacy prediction model of NAC on breast cancer based on expression of AHNAK,CIDEA,ADIPOQ and AKAP12
2.4.2 模型预测能力评价 从模型区分度和校正情况进行模型预测能力评价,首先计算模型的预测值,根据预测值计算AUC为0.8249(95%CI:0.7227~0.9271),见图7A。随后采用bootstrap内部验证,将抽样次数设为1 000次,校正后的AUC为0.7761,见图7B,拟合优度检验(Hosmer-Lemeshow)P=0.4945,说明模型预测概率和实际概率之间差异无统计学意义。可见,将AHNAK、CIDEA、ADIPOQ、AKAP12这4个基因纳入乳腺癌NAC疗效预测模型,具有良好预测价值。
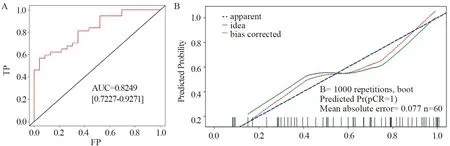
图7 乳腺癌新辅助化疗预测模型AUC(A)及校正曲线(B)Figure 7 AUC(A) and calibration curves(B) of the prediction model of NAC on breast cancer
3 讨论
化疗耐药是乳腺癌治疗失败的最主要原因,临床上仅30%~50%患者接受NAC后能获得pCR。相较于non-pCR的患者,NAC后达到pCR的患者可获得更好的长期预后[5-6]。化疗耐药的产生与基因表达存在密切而复杂的关系,乳腺癌固有的异质性使耐药与基因表达关系更为复杂。一些原本就更倾向发生耐药的亚细胞群,在治疗选择压力下,扩增或出现进化,最后表现出对治疗的抵抗[11]。肿瘤异质性意味着乳腺癌耐药基因的表达存在差异,对化疗的敏感度也存在差异,细化乳腺癌分子分型,针对各种类型进行个性化治疗是极其必要的[12]。
高通量转录组测序(RNA sequencing,RNASeq)能够在单核苷酸水平上对任意物种的所有转录活动进行检测,除量化基因的表达外[13],还可检测到新的转录本、识别选择性剪接基因位点、检测肿瘤异质性[14]、鉴定耐药标志物[15-16]等,通过这些新的生物信息学方法,学者们发现在乳腺癌NAC前,耐药基因已存在,化疗的干预可使耐药基因选择性进化,从而出现耐药表型[17-20]。因此,对乳腺癌NAC前后标本进行检测,可识别出与化疗疗效相关的基因。
通过全基因转录组测序我们定位到4个可能导致乳腺癌一线NAC药物(蒽环和紫杉类)耐药的潜在相关基因。AHNAK是一种蛋白质编码基因,编码AHNAK核蛋白。在肿瘤耐药的相关研究中,Davis等首次报道在乳腺癌细胞系以及荷瘤小鼠模型中AHNAK表达下调抑制了多柔比星诱导的半胱天冬酶蛋白7的表达和细胞周期停滞,而其过表达则相反[21]。AHNAK作为一种巨型支架蛋白(约700 kDa)[22],是乳腺癌细胞迁移的关键蛋白,并且可通过肿瘤微环境中囊泡通讯促进癌症进展,同时,还有研究报道AHNAK的过表达可使乳腺癌细胞系出现多柔比星抗药性。从本研究结果来看,AHNAK的高表达提示了乳腺癌新辅助化疗耐药,AHNAK是潜在的耐药基因,这个结论与既往学者报道基本相符,但本研究只揭示了AHNAK的高表达使乳腺癌NAC出现耐药,具体机制需进一步验证。
AKAP12基因编码A激酶锚蛋白(The A-kinase anchor proteins),该蛋白是与细胞生长相关的蛋白质,在信号转导中用作支架蛋白。在肿瘤耐药研究中,奥西替尼是EGFR突变肺腺癌的靶向药物,而ESR1-AKAP12发生融合可使EGFR突变肺腺癌对奥西替尼产生耐药[23]。另外,AKAP12显著诱导前列腺癌细胞对多西紫杉醇的化学耐药性[24]。本研究鉴定出AKAP12基因的高表达与乳腺癌NAC耐药相关,是乳腺癌NAC是否获得pCR的独立危险因素,研究入组患者使用蒽环类药物序贯紫杉类药物的化疗方案,而既往研究提示AKAP12与癌症紫杉类药物耐药相关。临床上更换化疗药物时再次穿刺取材格外困难,因此我们无法区分出AKAP12的过表达是与乳腺癌紫杉类化疗耐药相关或是与蒽环类及紫杉类同时相关,需继续设计基础实验深入研究。
而CIDEA(cell-death-inducing DNA fragment factor 45-like effector A)和脂联素(Adiponectin,ADIPOQ)均是脂肪代谢、糖代谢的关键因子,与代谢性疾病密切相关[25],有研究表明二者在乳腺癌组织及脂肪组织均高表达,CIDEA和ADIPOQ的过表达可促进癌细胞系凋亡,可能对癌细胞的生长具有负性调节作用,是恶性肿瘤预后良好的指标[26]。但有学者报道CIDEA在脂肪细胞与乳腺癌细胞之间存在信号交互作用,调节乳腺上皮细胞行为,从而出现肿瘤进展[27]。此外,也有研究提示Adipoq-AdipoqR1信号轴可预测转移性肾细胞癌对酪氨酸激酶抑制剂的治疗反应,是潜在的治疗靶点[28]。然而目前CIDEA和ADIPOQ的表达与乳腺癌患者化疗疗效的关系或机制研究尚未见报道,需进一步实验加以验证。
乳腺癌精准治疗已走在其他癌症的前列,目前国际上认可检测BRCA1/2的突变来预测乳腺癌发生风险,用21基因检测、70基因检测评估复发风险[29],尽管最新的报道提示70基因检测也可用来预测乳腺癌患者NAC疗效,但是,该方面的临床资料较为匮乏,尚处于探索阶段。BluePrint是基于I-SPY2研究的一种根据蛋白功能对乳腺癌进行分子分型的80基因检测方法,利用BluePrint方法对MammaPrint风险评估为高风险的乳腺癌患者重新进行分子分型,协助新辅助化疗的选择,提高了乳腺癌新辅助化疗pCR率[30]。I-SPY2研究通过对乳腺癌NAC前后癌组织测序数据进一步分析随访得出结果,而BluePrint则是基于I-SPY2研究筛选出可能与乳腺癌NAC疗效密切相关的基因,构建了具有预测乳腺癌NAC疗效的、相对成熟的基因模型,但BluePrint数据主要来源于欧美人群,符合亚裔人群的数据模型有待进一步开发。我们的研究在有限范围内提供了小样本的数据,可为今后亚裔人群乳腺癌NAC疗效预测模型的构建提供数据支持。
本研究结果提示,AHNAK、AKAP12、CIDEA和ADIPOQ的高表达降低了患者获得pCR的概率,是乳腺癌NAC疗效欠佳的危险因素;将AHNAK、AKAP12、CIDEA和ADIPOQ作为因子构建的化疗疗效预测模型,有望成为挑选适合NAC乳腺癌患者人群的新方法。但本研究样本量有限,具有一定局限性,后续将进一步采集临床样本,通过免疫组织化学、Western blot等方法从蛋白层面去验证这几个基因在临床实践中的可靠性。
