不同新辅助治疗方案对直肠癌患者TRG、手术并发症及LARS的影响
2022-01-06陈功勤张洋郭慧欧阳洋
陈功勤,张洋,郭慧,欧阳洋
0 引言
根据GLOBOCAN 2018年的数据,结直肠癌在全世界范围内是第三致命和第四常见的恶性肿瘤[1],结直肠癌的发病率居恶性肿瘤的第3位,死亡率居第5位[2]。直肠癌约占大肠恶性肿瘤的三分之一。近年来随着直肠癌全肠系膜切除术(total mesorectal excision,TME)、多学科综合治疗(multi-disciplinary treatment,MDT)以及术前新辅助治疗的应用,直肠癌的预后得到了明显改善,保肛率也大大提高,术前新辅助治疗已经成为直肠癌综合治疗的重要组成部分。在直肠癌术后一部分患者出现了不同程度的粪便排泄功能障碍,近年被归纳为“低位前切除综合征[3](LARS)”,严重影响了患者术后的生活质量。术前新辅助治疗方式不同,对LARS的影响也会产生相应的差异,但是差异有没有统计学和临床意义,现在尚未有明确的结论。本研究拟采用LARS量表评价直肠癌术后LARS的发生情况,以期筛选出对直肠癌术后发生低位前切除综合征的影响因素;同时评估不同的新辅助治疗方案对于肿瘤患者近期预后的影响,指导后续需要新辅助治疗的直肠癌患者选择合适的治疗方式,使局部进展期直肠癌的治疗更具有个体化和精准化。
1 资料与方法
1.1 病例收集
收集2018年4月—2020年3月就诊于中南大学湘雅医院的直肠癌患者,纳入标准:(1)18岁≤年龄≤80岁;(2)病理学检查已经明确诊断为直肠癌,经MRI等影像学评估为cT3N+或cT4N+的直肠癌患者;(3)肿瘤下缘距肛缘<12 cm;(4)ECOG≤2;(5)未发现远处转移证据;(6)预计可行腹腔镜手术;(7)预计生存时间>12月;(8)充分告知患者并签署知情同意书。排除标准:(1)同时患有其他的结直肠癌肿瘤,或其他恶性肿瘤;结直肠癌术后复发患者;(2)患者5年内有其他恶性肿瘤史;(3)孕妇或哺乳期妇女;(4)患者已有其他辅助放疗史及手术禁忌证;(5)就诊前已有放化疗记录;(6)进行术前放化疗后过度担忧放化疗并发症,有精神障碍,无法依从研究方案和研究程序的患者;(7)患者已加入其他临床研究,采取干预措施可能影响到本研究结果的;(8)患者术中改变计划行永久造瘘(限LARS研究);(9)术中发现远处转移;(10)随访期间发生吻合口或盆底复发(限LARS研究);(11)预防性造口术后6月仍未还纳(限LARS研究);(12)患者术后3月内死亡;(13)患者既往有肛门手术病史(限LARS研究);(14)随访期间,研究者出于患者利益的考虑认为需行永久造瘘(限LARS研究)或终止随访;(15)随访期间行急诊手术或改行非腹腔镜手术的患者。
1.2 新辅助治疗方案
长程同步放化疗组:长程放疗(IMRT:PTV:总剂量50 Gy,2.0 Gy/25 F+Capecitabine 825 mg/m2一天两次)结束至手术前9~12周间歇期按CapeOX方案行化疗。短程放疗+化疗组:短程放疗(IMRT:6 MV X线:PTV 25 Gy/5 f)结束至手术前9~12周间歇期按CapeOX方案行化疗。化疗组:按CapeOX方案行化疗3~4周期(9~12周)后手术。手术方式均依据腹腔镜结直肠癌根治手术操作指南(2006版)[4]行腹腔镜下直肠癌根治术。
1.3 观察指标
观察治疗前临床分期、放化疗不良反应、手术方式、术后吻合口及肠道相关并发症、手术标本病理分期及退缩情况(依据AJCC肿瘤分期第8版及AJCC/CAP 4级评价标准)及LARS评分(依据2012年欧洲直肠癌术后功能协作组发布的LARS量表)。
1.4 统计学方法
用软件SPSS22.0进行数据分析。统计描述时计数资料采用率、计量资料采用均数和95%CI;两组比较时计量资料采用t检验,计数资料用χ2检验,多因素分析用Logistic回归分析,多组单项有序资料用Ridit分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料分析结果
共纳入研究对象127例,其中男性76例,女性51例,平均年龄(56.28±10.4)岁。按新辅助治疗方式分为3组:长程同步放化疗组(42例)、短程放疗+化疗组(39例)、化疗组(46例)。其中共有94例可纳入LARS研究,男44例,女50例,平均年龄(50.8±9.7)岁,分别为长程同步放化疗组35例、短程放疗+化疗组32例、化疗组27例。
2.2 基础资料对比
三组患者资料对比,年龄、性别、癌胚抗原(carcinoembryonic antigen,CEA)、环形切除边缘(circumferential resection margin,CRM)、壁外静脉侵入(extramural venous invasion,EMVI)、T分期、N分期差异无统计学意义(均P>0.05),见表1。

表1 三组直肠癌患者基础资料对比Table 1 Comparison of basic data among three groups of rectal cancer patients
2.3 肿瘤退缩等级评分情况
使用肿瘤退缩分级标准(tumor regression grade,TRG)对肿瘤新辅助治疗后退缩情况进行分级。术后病理标本中,TRG0共20例(15.75%),TRG1共42例(33.07%),TRG2共46例(36.22%),TRG3共19例(14.96%);在不同的新辅助治疗方式下,三组在TRG0中有明显差异(P<0.05),长程同步放化疗组的TRG0率在三组中最高,而三组在TRG1、TRG2、TRG3中无显著差异(P>0.05),见表2 。使用Ridit分析,我们发现R(长程同步放化疗组)=0.404,R(短程放疗+化疗组)=0.519,R(化疗组)=0.664。Ridit平均值低于R=0.500,表示该种新辅助治疗对于术后标本TRG反应较好。
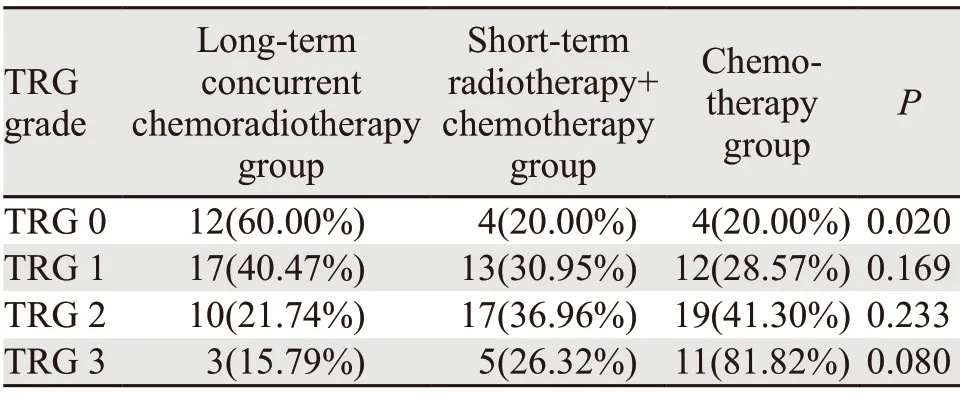
表2 三组直肠癌患者肿瘤退缩情况Table 2 Tumor regression grade (TRG) status of three groups of rectal cancer patients
查阅文献得知术前磁共振T分期和N分期TRG分级是其危险因素[5],将二者一并纳入多因素分析。多因素分析结果显示:新辅助治疗方式是TRG的独立危险因素;长程同步放化疗和短程放疗+化疗之间无统计学意义,但是长程同步放化疗和化疗相比,术后病理分级良好者(TRG0/1)是化疗的5.942倍(OR=5.942,95%CI:1.545~22.850,P<0.05),见表3。

表3 直肠癌术后TRG的多因素分析Table 3 Multivariate analysis of postoperative TRG of rectal cancer
2.4 术后并发症
术后并发症主要为吻合口及吻合口相关并发症和盆腔及肠道相关并发症,具体包括术后肠梗阻、吻合口出血及吻合口瘘、切口及盆腔感染、切口疝、造口出血,由于切口疝及造口出血数据小,未进行分析。三组患者在术后总并发症分析中差异无统计学意义(P=0.394),见表4。
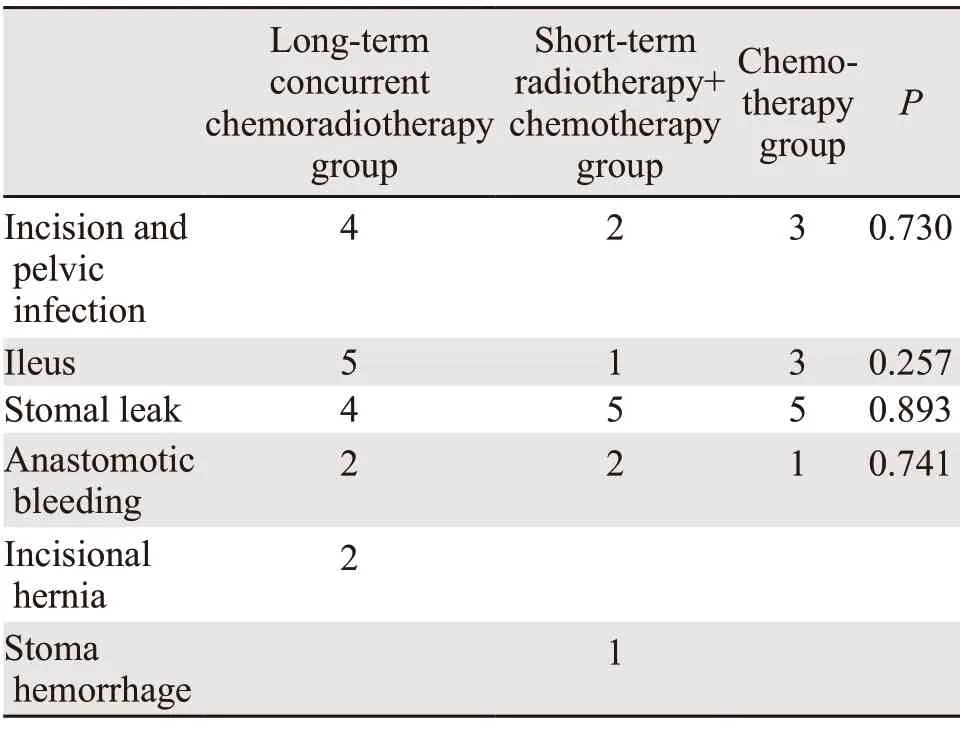
表4 三组直肠癌患者术后并发症Table 4 Postoperative complications of three groups of rectal cancer patients
2.5 术后低位前切除综合征的差异性分析
在术后低位前切除综合征的评判中,最终91例入组使用LARS量表进行评估。在长程同步放化疗组中,无LARS症状者共10例,轻度症状者14例,重度症状者13例;在短程放疗+化疗组中,无LARS症状者20例,轻度症状者10例,重度症状者2例;在化疗组中,无LARS症状者13例,轻度症状者7例,重度症状者2例。使用Ridit统计分析得出如下结果。R长程同步放化疗=0.628,R短程放疗+化疗=0.413,R化疗=0.425。方差分析得出:F=4.947,P=0.011,差异有统计学意义,可以认为在术后LARS评价中,不同的新辅助治疗方式之间存在差异。
文献报道性别及肿瘤与肛缘的距离是LARS的危险因素[6]。调整了性别、肿瘤同肛缘的距离及新辅助治疗方式作为LARS的可能危险因素,将新辅助治疗方式、性别及肿瘤与肛缘的距离纳入多因素的分析提示:新辅助治疗方式是LARS发生的独立危险因素,对于新辅助治疗方式而言,相对于长程同步放化疗而言,短程放疗发生LARS的风险是其0.18倍(95%CI:0.48~0.70,P=0.01);化疗发生LARS的风险是其0.19倍(95%CI:0.05~0.80,P=0.02)。性别及肿瘤同肛缘的距离不是LARS发生的危险因素,见表5。
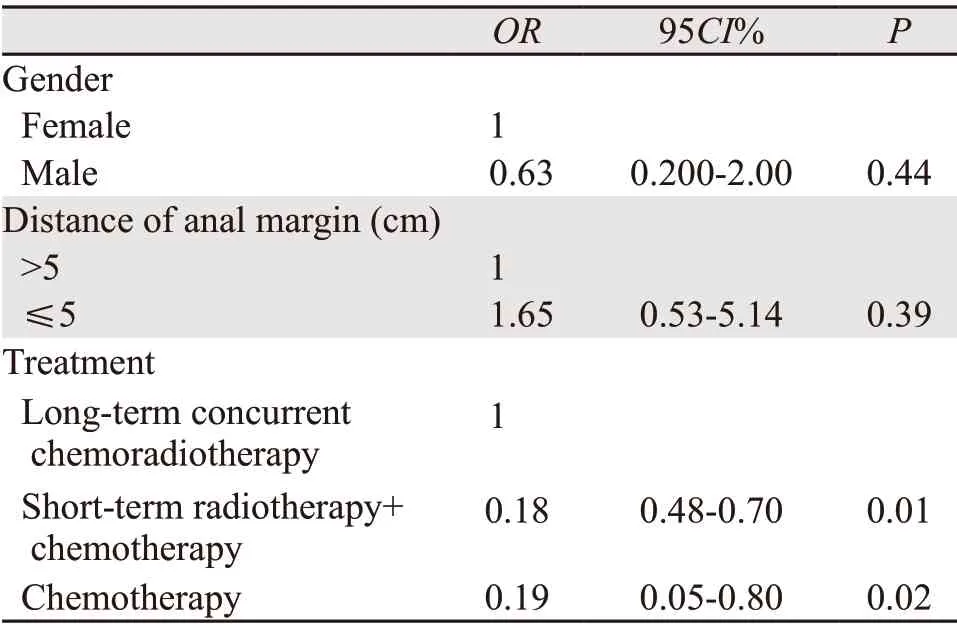
表5 直肠癌患者LARS的多因素logistic回归分析结果Table 5 Multivariate logistic regression analysis results of LARS in rectal cancer patients
3 讨论
术前新辅助治疗(neoadjuvant therapy)联合全直肠系膜切除(total mesorectal excision,TME)已经成为局部进展期直肠癌的首选治疗方式[7],在长程同步放化疗中,患者靶器官所受辐射剂量较大且患者手术间歇期较长,手术间歇期化疗对于全身微转移灶有很好的消灭作用;短程放疗的放射剂量较小,时间短,不能很好地控制复发;由于放疗对机体产生的不可逆性损伤,对患者身心造成巨大不良影响,单纯的新辅助化疗避免了放疗产生不可逆损伤的可能,但其作用相对温和,对肿瘤的杀伤作用降低,总体上的降期效果不如同步放化疗。本研究中,长程同步放化疗组的TRG0率在三组中最高,反映出在术后标本TRG分级中,长程同步放化疗较其他两种新辅助治疗模式存在优势。一项跨越10年的前瞻性数据库研究局部进展期直肠癌在接受了长程放疗(long-course preoperative radiochemotherapy,LCRT)+TME治疗[8],术后肿瘤TRG分级越好,患者5年无复发生存率越高(P<0.05);另一项研究[9]对比接受LCRT+TME的局部进展期直肠癌患者,认为TRG分级越好者,其5年DFS越高。本研究的随访时间较短,无法验证TRG同患者OS、DFS、PFS之间的关系,然而现在越来越多的报告提示TRG分级和直肠癌的预后有着明显的相关性,我们可以认为TRG分级较好的直肠癌患者疗效更佳。
放射性肠炎是腹部或盆腔放疗后产生的肠道并发症,有报道其发生率在6%~78%[10],放疗使靶区肠管血管硬化和肠管壁纤维化,导致肠管黏膜机械屏障和菌群屏障受到损害,影响吻合口愈合和使肠道功能受损。放疗相比于化疗可增加患者吻合口相关并发症的发生[11-12],一项Meta分析[13]认为短程放疗组和长程同步放化疗组的OS及DFS差异无统计学意义且术后并发症的情况基本相似;同样有研究认为直肠癌患者接受LCRT和SCRT间术后并发症并无差异[14-16]。在本研究中,发现三组患者在术后并发症没有统计学意义,可能是放疗患者多行保护性造口,免除了粪便对于吻合口产生的影响,患者由于造口下段肠道缺少粪便的刺激,其蠕动能力也将减弱而产生废用性改变。但是长程同步放化疗出现并发症的比例为40.48%,高于短程放化疗(28.21%)和化疗组(26.08%),提示我们,长程同步放化疗对于机体的损伤更大,需要更为慎重地对待,同时也需要更多病例的研究。
国外有研究表明,直肠癌术后出现排便排气功能障碍者超过80%[17],我国有研究表明术后出现LARS的概率在37%左右[18],东亚地区也有研究数据显示术后发生LARS的概率约为35%左右[19]。本研究数据显示LARS发生率为52.76%,LARS发生率的差异可能和治疗方式有关,欧美国家多推荐使用长程同步放化疗以达到降期效果,而在亚洲,特别是日本则认为可以通过侧方淋巴结清扫达到和欧美放疗同样的根治效果,这就减少和避免患者接受放疗的可能。本研究发现,术前放疗特别是长程放疗会对直肠癌术后肛门排便排气功能产生严重不良影响,术后出现LARS的症状相对较多,这和国内外研究基本一致。可能是放射治疗后,肠管局部纤维化严重,其顺应性降低,周围神经组织受损而造成;与此同时,放疗增加的手术难度和术后并发症严重影响了患者术后的生活质量,这是现阶段直肠癌综合治疗中“去放疗”观点的重要原因。在LARS的影响因素中,既往有研究表明肿瘤位置是影响患者术后肛门功能的重要因素之一,由于患者肿瘤位置偏低,肿瘤下缘更靠近肛门括约肌,特别对于T分期较晚者,外生性强,且骨盆下端手术操作空间更小,对肛门括约肌及神经产生损伤的可能性更大。本研究未发现肿瘤位置对术后患者排便排气产生明显影响,可能是由于位置过低的肿瘤多行Miles术,患者术后不存在出现低位前切除综合症状的可能而造成数据偏倚。
本研究随访周期过短,无法获得TRG分级和直肠癌远期生存率的关系,需要后续进一步研究。我们也需要进一步了解肿瘤的基因状态和微卫星状态,与TRG分级和远期预后等多因素共同建立预测模型,对直肠癌的预后进行预测。LARS症状改善的时间有长有短,术后是否需要医学干预现在尚且有争议,本研究随访时间短,如何筛选出术后会出现持久LARS症状的患者需进一步的研究。本研究是单中心回顾性分析,未来将会增加样本量及多中心研究以此增加研究的可靠性;尽管所有病例由经验丰富的同一组医生完成,能够保证TME完成一致性,但由于受肿瘤分期影响,对不同肿瘤进行分期研究仍将是未来的研究方向。
三种新辅助治疗方案手术安全性一致;长程同步放化疗和短程放疗+化疗在肿瘤退缩方面均有优势,但长程同步放化疗更容易引起LARS症状,影响患者生活质量,在临床治疗方案选择上需要综合考虑。
