超声联合DSA引导下单切口经腋静脉输液港植入术的临床应用
2022-01-06刘伟夫张孔志余文昌陈示光王小珑
刘伟夫,张孔志,余文昌,陈示光,王小珑
0 引言
完全植入式静脉输液港(totally implantable venous access port,TIVAP)因其隐蔽性好、并发症少、日常维护需求低等优点,在临床上,尤其是在恶性肿瘤患者的治疗过程中得到广泛应用,明显提高了患者的生活质量[1-2]。TIVAP植入可以通过不同的静脉途径完成,其中经颈内静脉(internal jugular vein,IJV)及锁骨下静脉(subclavian vein,SCV)入路植入TIVAP在临床应用中最为广泛[3]。然而,经上述两种静脉入路均存在潜在并发症,包括气胸、血气胸、乳糜漏等早期并发症及经IJV入路可能存在的颈部切口影响美观、皮下隧道感染、颈部牵扯不适和经SCV入路特有的夹闭综合征(pinch-off syndrome,POS)等远期并发症[4-5]。为了弥补TIVAP植入过程中上述两种静脉入路的不足,近年来越来越多的学者关注到腋静脉(axillary vein,AV)解剖,并开展以此入路植入TIVAP的相关临床研究。福建省肿瘤医院自2019年起采用超声联合数字减影血管造影技术(digital subtraction angiography,DSA)引导下行单切口经AV入路植入TIVAP,现对其可行性及安全性进行评价,并将临床应用结果报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2019年12月—2021年1月在福建省肿瘤医院就诊并接受超声联合DSA引导下行单切口经AV入路TIVAP植入术的240例患者临床资料。其中男60例,女180例,平均年龄50.84±11.35岁(13~78岁),平均身体质量指数(body mass index,BMI)22.95±3.01 kg/m2(16.90~32.88 kg/m2),正常BMI范围为18.5~23.9 kg/m2,平均身高160.33±7.73 cm(145~187 cm),平均体重59.14±9.78 kg(40~92 kg)。所有患者均为恶性肿瘤患者,其恶性肿瘤类型,见表1。植入TIVAP的目的在于为患者行全身化疗或肠外营养支持。

表1 240例患者的恶性肿瘤类型Table 1 Types of malignancies in 240 patients
1.2 输液港套件和导引设备
采用M.R.ITMLOW-Profile Implantable Port(美国Bard医疗公司),由输液座(高10.0 mm,直径24.6 mm,隔膜直径10.8 mm)、6.6F单腔导管(2.2 mm OD,1.0 mm ID,75 cm Length)、7F导入器(3.1 mm OD,2.5 mm ID,10 cm Length)、“J”型头导丝(0.64 mm OD×60 cm)、18G穿刺针(1.3 mm OD,1.0 mm ID,70 cm Length)、22G无损伤针(0.7 mm OD×25 cm)和皮下隧道工具组成。引导设备为:DSA成像系统(荷兰Philips公司,UNIQ FD20),便携式彩色多普勒超声系统(深圳迈瑞生物医疗)。手术材料包括无菌巾包、器械包、无菌手套、碘伏消毒剂、肝素钠、利多卡因、缝线缝针等。
1.3 手术方法
所有患者术前均明确有植入TIVAP的适应证,无禁忌证,且均签署知情同意书。所有患者均为同一名介入科医师施行TIVAP植入术。若无禁忌证,优先选择右侧AV穿刺入路;若有制约因素(如PICC置管史、乳腺癌、局部淋巴结转移、局部皮肤感染及患者意愿等),则选择左侧AV穿刺入路;若一侧AV穿刺失败(穿刺次数超过3次、穿刺时间超过5 min或误穿动脉),即改为同侧IJV穿刺植入输液港。
具体手术流程:患者取仰卧位,肩部垫薄枕头,头后仰并转向对侧,穿刺侧手臂稍外展,彩色超声于锁骨下区探查腋静脉、腋动脉位置,明确相互毗邻关系以及腋静脉内有无血栓形成,并探查头静脉汇入腋静脉处及其延续至锁骨下静脉点,取该段腋静脉作为穿刺对象,测量其静脉宽度,并于体表标记该段腋静脉走行及定位穿刺点、导管走行及港体留置位置。常规消毒、铺巾及局麻后,于体表标记的穿刺点进针,并在二维超声实时引导下进行腋静脉穿刺,清晰显示针尖进入腋静脉并成功抽回血后,经穿刺针送入导丝约20~25 cm,再行DSA透视确认导丝进入上腔静脉,若导丝误入非目标血管,则于DSA实时透视下调整导丝进入上腔静脉。于体表导丝穿刺处向内侧做一横行皮肤切口,长约2~3 cm,制作皮下囊袋,大小以恰好可埋入港体为宜。经导丝交换入可撕脱导管鞘,并将导管经导管鞘内送入血管,导管送入长度估算为右侧18~20 cm、左侧20~23 cm,去除可撕脱鞘,再于DSA透视确认导管末端位于上腔静脉与右心房交界处(若有偏差,可适当调整导管进入深度),若DSA透视提示导管误入非目标血管,则于DSA实时透视下调整导管进入上腔静脉。剪去体外多余导管并与港体连接,在港体上插入无损伤针,并用100 IU/ml肝素盐水抽吸及推注,检查输液港通畅且无渗漏后,将港体埋入囊袋内,常规缝合切口,并以无菌纱布覆盖切口。最后DSA透视核实港体位置、导管走行及导管末端位置,留存最终影像资料,见图1。确定无异常后经体表留置无损伤针,以100 IU/ml的肝素盐水10 ml正压封管。术后每3天更换一次敷料,术前及术后无需使用抗生素,若伤口无明显异常,术后第10天拆除伤口缝线。
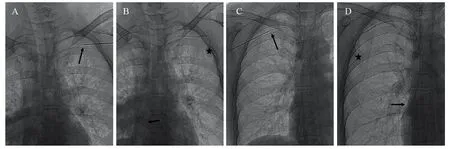
图1 单切口AV入路植入输液港影像资料Figure 1 Image of single-incision technique via AV access in implantation of TIVAP
1.4 观察指标
观察记录手术相关信息,如AV宽度、AV穿刺成功率、植入成功率、超声引导穿刺时间、手术时间及术中、术后并发症(误穿动脉,血气胸,心律失常,切口/囊袋感染,切口愈合不良,导管相关血流感染,纤维蛋白鞘形成,静脉血栓形成,导管功能障碍,导管断裂/移位,夹闭综合征等)。超声引导穿刺时间定义为:超声引导穿刺开始至AV穿刺成功所需时间。手术时间定义为:超声引导穿刺开始至缝合皮肤切口结束所需时间。随访截至2021年3月31日。
1.5 统计学方法
采用SPSS 22.0统计分析软件进行数据处理和统计分析。计量资料以(±s)表示,组间比较采用t检验;计数资料以((n)%)表示,组间比较采用χ2检验。患者各项参数与腋静脉宽度之间相关性分析采用多元线性回归分析(逐步)。P<0.05为差异有统计学意义。
2 结果
2.1 手术相关情况
240例患者均成功植入TIVAP,植入成功率100%。229例(95.42%,229/240)于超声联合DSA引导下行单切口经AV穿刺成功植入TIVAP,其中经右AV入路135例(56.25%,135/240),经左AV入路94例(39.17%,94/240);11例(4.58%,11/240)因AV穿刺失败(其中2例误穿动脉致局部血肿、9例穿刺次数超过3次或时间超过5 min),改超声联合DSA引导下经同侧IJV穿刺植入TIVAP,其中经右IJV入路8例,经左IJV入路3例。240例患者术前超声探查定位下测得拟穿刺段AV平均宽度为(7.56±1.26)mm(5.6~10.5 mm),其中AV 1次穿刺成功195例(81.25%,195/240),2次穿刺成功26例(10.83%,26/240),3次穿刺成功8例(3.34%,8/240);超声引导下穿刺平均时间为(0.85±0.52)min(0.25~4.5 min);平均手术时间(25.9±4.8)min(18~35 min)。术中并发症发生率为1.67%(4/240);其中误穿腋动脉2例,给与局部压迫10 min后成功止血;导丝、导管诱发心律失常(表现为室上速)2例,予调整导丝、导管位置,并嘱患者行Valsalva动作后均快速缓解;术中未发生血胸、血气胸及严重致死性并发症。术中DSA透视发现导丝、导管误入非目标血管共9例,均为经AV入路时发现,其中导丝误入同侧IJV 5例,导管误入同侧IJV 3例、误入对侧头臂静脉 1例,见图2;均于DSA实时透视下调整后进入上腔静脉。
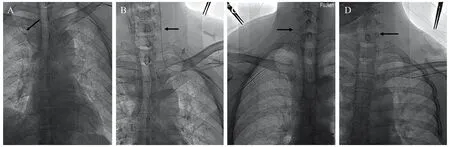
图2 AV入路导丝、导管误入非目标血管影像资料Figure 2 Image of guide wire and catheter mistakenly entering non-target vessels via AV approach
2.2 AV不同穿刺次数成功的一般资料比较
AV 1次穿刺成功患者的平均AV宽度(7.75±1.27)mm明显宽于非1次穿刺成功患者的平均AV宽度(6.74±0.80)mm,差异有统计学意义(P<0.01)。而在性别、年龄、身高、体重、BMI等临床特征方面,两者差异均无统计学意义(均P>0.05),见表2。
表2 AV不同穿刺次数成功的一般资料比较 (±s)Table 2 General information of patients with different times of successful axillary vein puncture (±s)
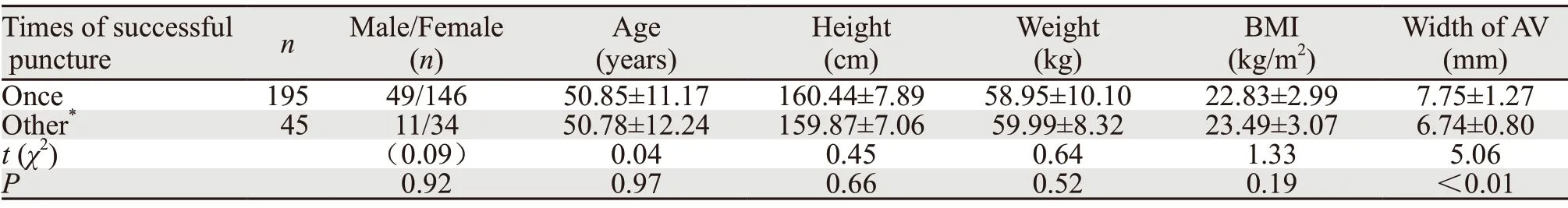
表2 AV不同穿刺次数成功的一般资料比较 (±s)Table 2 General information of patients with different times of successful axillary vein puncture (±s)
Note:*:included twice,three times of successful puncture and failure of AV puncture.
2.3 术前AV宽度与患者一般资料间的相关性
男性AV平均宽度为(7.91±1.27)mm,女性为(7.38±1.08)mm,差异有统计学意义(P=0.002);患者年龄、身高、体重及BMI对不同个体AV宽度的差异均无统计学意义(均P>0.05),见表3。
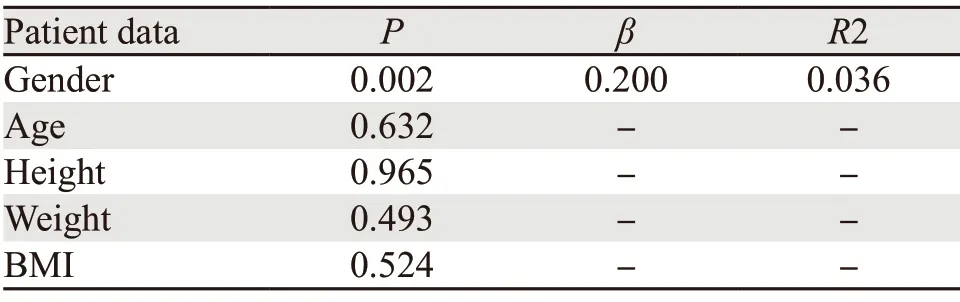
表3 患者一般资料与腋静脉宽度之间相关性分析Table 3 Correlation between general date of patients and width of axillary vein
2.4 术后随访情况
截至2021年3月31日,240例患者均获随访,TIVAP留置时间69~484 d,平均留置时间(228.0±134.2)d。TIVAP留置期间相关并发症发生率为2.92%(7/240)。其中术后早期(30天内)发生植入侧手臂肿胀3例(1.25%)、囊袋血肿1例(0.42%)、切口感染1例(0.42%);术后远期(30天后)发现港体翻转1例(0.42%)、导管纤维蛋白鞘形成1例(0.42%);未见导管相关血流感染、导管相关静脉血栓、导管断裂/移位、夹闭综合征、药物外渗等并发症发生。3例患者植入侧手臂肿胀,均为经AV入路植入TIVAP后当天发生,超声检查排除急性静脉血栓形成,均考虑与2~3次AV穿刺成功后局部小血肿形成并压迫AV、影响上肢静脉回流有关,通过植入侧手臂行间断性握拳及穿刺处24小时内局部冷敷后,于术后第2天肿胀均自行消退,后期随访未再有植入侧手臂肿胀情况发生;余囊袋血肿、切口感染、港体翻转及导管纤维蛋白鞘形成等并发症均通过恰当的处理后恢复。23例(9.58%)患者随访期内已取出TIVAP,原因包括上述1例切口感染提前取港及22例化疗等治疗结束而取港;217例(90.42%)患者目前仍保留TIVAP并正常使用。
3 讨论
目前临床上主要采用经IJV及SCV入路植入TIVAP。有研究显示[6],在评估充分的情况下,采用超声引导经IJV或SCV入路植入TIVAP,其成功率无差异,几乎达到100%;在早期并发症如气胸、血气胸、误穿动脉等发生率上无可比性,因为这些并发症主要和术者所擅长的穿刺路径、熟练程度等临床操作经验密切相关。然而在远期并发症发生上,经IJV及经SCV入路均存在其局限性。经IJV入路植入TIVAP,需要颈部及胸壁两个皮肤切口,并于颈部皮下建立导管隧道,存在颈部切口影响美观、皮肤隧道感染、颈部牵扯不适及锁骨表面导管断裂等远期并发症[7];同时在头颈部恶性肿瘤患者中,由于患者颈部恶性病变压迫、侵犯临近IJV,或既往接受以及即将接受颈清及放疗等多种原因,难以经IJV入路植入TIVAP[8]。而经SCV入路,虽无需两个切口或皮下隧道,避免了颈部牵扯不适,提高了美观效果及患者舒适度,但在导管异位、导管功能障碍等远期并发症发生率上,高于经IJV入路[4],同时部分患者还可发生经SCV入路特有的夹闭综合征(pinch-off syndrome,POS),进而影响了患者TIVAP的使用率。
鉴于上述两种静脉入路的局限性,越来越多的学者开始关注于经腋静脉(axillary vein,AV)入路植入TIVAP的研究。AV由上臂的肱静脉延续而成,至锁骨外侧缘以外续于锁骨下静脉,整体走行于胸廓外,并且以胸小肌为标志,分为近侧段、中间段、远侧段3部分;因其独特的解剖位置及毗邻关系,有学者提出经AV入路植入TIVAP存在以下优点:(1)经AV入路时,导管在穿过锁骨与第一肋骨之间的间隙前已进入血管,故不构成挤压,可避免POS发生[9];(2)AV近侧段处动静脉距离较远,误穿动脉概率低,且即使误穿腋动脉,因无骨性结构遮挡,可及时予有效的压迫止血[10];(3)AV整体走行于胸廓外,穿刺时后方有第一肋骨平台保护,穿刺针误入胸腔、误穿胸腔内脏器的可能性低,不易引起气胸、血气胸等并发症[11]。既往AV穿刺多依赖于其走行体表投影定位或依赖于X线下骨性结构标记定位进行,但因人体解剖变异的存在,依靠体表投影定位穿刺常难以奏效,有研究报道其穿刺成功率仅85%左右[12];而X线透视尤其是静脉造影等方法,患者需额外接受长时间X线暴露,这是国内外指南所不推荐的。然而超声技术的出现改变了这一现状。2003年Galloway等[13]通过超声评估AV远中近三段的解剖结构发现AV近侧段直径最大、与胸壁的距离最近,且与动脉、臂丛分支无紧密伴行,提示AV近侧段为超声引导下理想的穿刺点。1年后Sharma等[14]报道了实时超声引导下经AV近侧段穿刺置管,其置管成功率达到96%,且提示仅1.5%的误穿动脉发生率;随后超声引导AV穿刺技术不断发展;近年来,国外有研究报道[15-16]超声引导下经AV近侧段穿刺置管成功率最高可达99.5%,1次穿刺成功率可达94%,并提示较超声引导下经IJV或SCV穿刺置管有更低的气胸、误穿动脉及血肿等发生率(AVvs.IJV:0.7%vs.4.9%,AVvs.SCV:1.9%vs.4.1%),且未见POS发生。而国内亦有研究报道提示超声引导下穿刺AV置管较体表标记法有更高的成功率和安全性[17-18]。
本研究采用超声引导下穿刺AV近侧段植入TIVAP,其AV穿刺成功率95.42%(229/240),略低于上述文献报道,可能与早期学习曲线有关,主要表现在11例AV穿刺失败均发生在研究开展早期;其中AV 1次穿刺成功率81.25%(195/240),低于国外报道[15],但达到国内同类研究水平[17-19]。本研究对所记录的近侧段AV宽度与穿刺次数进行统计分析,提示近侧段AV宽度越宽,穿刺成功率越高;同时本研究还发现男性近侧段AV宽度宽于女性,差异有统计学意义(P<0.05),这与Kim等[20]的研究结果相仿,提示针对男性有更高的AV穿刺成功率。还有学者研究表明,植入侧上肢外展及肘关节屈曲90°的方法,可增加AV回流阻力,使AV增宽,提高了AV穿刺置管成功率[21-22];当然,AV穿刺成功率也与操作者的经验密切相关。本研究术中穿刺导致的并发症发生率为0.83%(2/240),均为误穿动脉并且均引起局部血肿,未有气胸、血气胸、乳糜漏等并发症发生,与上述文献报道的并发症发生率相仿,验证了超声引导穿刺AV的安全性。
虽然超声引导穿刺AV植入TIVAP可以提高穿刺成功率、降低穿刺并发症,但单纯依靠超声恐无法保证TIVAP植入术中导管准确进入上腔静脉,即有导管异位的可能。有研究报告TIVAP术中导管异位发生率在0.3%~6%[23],而不同静脉入路的导管异位发生率也有差异,其中Li等[24]研究提示SCV组术中导管异位率(5.4%)高于IJV组(2.9%);而AV入路导管走行与SCV入路相仿,亦提示一个相对较高的术中导管异位发生率;若术中未及时发现导管异位,术后则可能出现相对较高的导管功能障碍、导管相关血栓形成等并发症发生率[25]。此外TIVAP植入术中导管末端的准确定位尤其重要。国内外指南对于导管末端应定位于上腔静脉与右心房连接处(cavoatrial junction,CAJ)均做出明确推荐[3,26],以期最大程度降低血栓、导管功能障碍发生率。若缺乏有效设备引导定位,则仅靠体表测量,其误差率可达50%[27]。本研究术中采用DSA透视,发现导丝、导管异位率3.75%(9/240),与既往研究报道水平相仿,后及时于DSA实时透视下调整导丝、导管的走行,确保所有病例的导管无异位,并明确定位导管末端于CAJ,未有二次手术调整情况发生;此后的术后随访期间,仅发现1例导管纤维蛋白鞘形成,未见导管相关性血栓、导管机械性功能障碍等并发症发生;除此之外,本研究术中发生2例心律失常,DSA透视下均明确为导丝、导管过长深入右心引起,予调整导丝、导管位置,并对症处理后均迅速缓解,后随访期内未再有心律失常发生;以上均提示TIVAP植入术中采用DSA引导可提高手术精度,降低后期相关并发症的发生率。
手术时长亦是评价TIVAP植入术式可行性及安全性的重要指标;而如何提高手术效率,缩短手术时长,我们认为,在排除术者操作经验后,手术时间与不同静脉入路、静脉穿刺时长以及切口设计密切相关。已有研究证实超声引导可以缩短深静脉穿刺时间,并提示超声引导下IJV穿刺耗时明显短于SCV/AV组[28-29];但亦有研究提示SCV/AV组的手术时长要短于IJV组[7];分析其可能原因有SCV/AV组可采用单切口,无需建立皮下隧道,且与IJV组相比,SCV/AV组手术过程中患者体位摆放较简单,患者更能配合。本研究采用超声引导下行AV穿刺,穿刺平均时长仅1 min左右,提高了静脉穿刺效率;同时采用单切口,将手术时长缩短至平均26 min左右,明显低于国外研究所报道的置港时间控制(<40 min)[30];同时本研究术后仅出现1例感染,感染发生率低于文献报道的1.2%~2.6%[31],与本研究中手术时长较短有关;最后单切口还为患者提供了更私密、更美观以及更舒适的需求。
本研究有如下局限性:(1)本研究为回顾性研究,未设置同期对照;(2)样本量偏少、随访时间短,存在数据不完整、晚期并发症发生率被低估等缺陷;(3)未调查患者满意度;亟待后续大样本随机对照研究来将该技术与常规技术进行有效性及安全性的比较。
综上,超声联合DSA引导下行单切口经AV植入TIVAP术是一种可行且安全的植入方式,具有较高的技术成功率、较短的手术时长和较低的并发症,可作为TIVAP植入方式的另一种选择,值得临床进一步推广应用。
猜你喜欢
——导丝概述及导丝通过病变技巧
