乳酸菌在肠道定植的影响因素及研究方法
2022-01-06秦文飞夏永军艾连中王光强
秦文飞,宋 馨,夏永军,艾连中,王光强
(上海理工大学健康科学与工程学院,上海食品微生物工程技术研究中心,上海 200093)
联合国粮食及农业组织和世界卫生组织联合专家将益生菌定义为:当给予宿主足够数量的活微生物时,对宿主的健康有益[1]。乳酸菌是以发酵碳水化合物产生大量乳酸的细菌的总称,其作为益生菌家族中最重要的菌株之一,在参与调节肠道菌群平衡、参与免疫应答和抑制肠道病原菌的生长繁殖等多种益生功能中发挥重要的作用[2-3]。而在人体内乳酸菌数量和种类最丰富的地方是消化道,并且乳酸菌的种类和数量也因消化道部位不同而有较大差异[4],其中在胃中的乳酸菌数量较少,主要是由于胃酸能将部分乳酸菌杀死,而在盲肠和结肠中乳酸菌的数量最多,能达到106~1010CFU/g。
在通常情况下,乳酸菌经口服进入体内后大部分将随着胃肠道的蠕动排出体外,只有少部分定植于肠道中[5]。而定植于肠道中是乳酸菌持续发挥其益生作用的前提,但是乳酸菌的定植能力会因种类的不同而存在差异,一般来说,对乳酸菌体内定植能力的评价通常是从定植于体内的数量和位点两方面进行,首先要求乳酸菌对胃酸、胆盐有一定的耐受能力,保证菌株到达定植位点时有较高活性和增殖能力。并且乳酸菌只有在定植位点达到一定的数量,才可能成为局部优势菌且在局部微环境起到调节肠道菌群作用并发挥其功能[6-7]。另外,乳酸菌在宿主肠道中的定植丰度也会影响到宿主的健康水平[8]。
乳酸菌肠道定植带给宿主的诸多有益作用(如缓解便秘[9]、降低胆固醇[10]、减轻性结肠炎[11]及降低血糖[12]等)吸引众多研究学者对其在肠道定植的机制进行探究,旨在更加透彻地梳理其在宿主肠道内进行定植的过程,阐明乳酸菌在肠道定植的机制,辅助乳酸菌在实际应用中更好地在肠道中定植,进而持续发挥其特殊的益生功能。但是到目前为止,对乳酸菌在肠道定植的机制鲜有详尽的阐述,其主要原因可能是复杂的肠道环境中存在较多的干扰因素,并且评估乳酸菌在肠道定植能力的方法还存在一定的局限性,难以精确地反映其与肠道之间发生的相互作用。本文综述近年来报道的乳酸菌肠道定植的影响因素,并针对肠道菌群的复杂多样性总结多种乳酸菌肠道定植的研究方法、定植模型及评估方法一系列关键技术,为进一步阐明乳酸菌的肠道定植机制提供参考。
1 乳酸菌定植的影响因素
乳酸菌在宿主肠道中持久发挥生理功能的前提是必须能在宿主肠黏膜上皮细胞中发生黏附并进一步定植,在肠道中某个部位逐渐能形成稳定的菌群。但是在复杂的肠道中,影响乳酸菌在宿主肠道定植的因素并不少,概括起来包括内因和外因。内因主要指菌体自身的一些理化特性,比如菌株黏附能力、自身的运动性、乳酸的分泌以及自身的增殖能力等。外因主要指环境状态,比如宿主基因及体征因素、肠道菌群、胃酸和胆盐的耐受性、饮食等。
1.1 黏附能力
乳酸菌的各种表面成分介导了乳酸菌与其环境的接触和相互作用,形成各菌株独特的表面特性,对其在肠道生存有着至关重要的作用[13]。而乳酸菌对肠道上皮细胞的黏附是其表面成分介导形成的一种物理表观现象,有助于其在肠道定植、增强乳酸菌与肠道细胞之间的信号交流、抑制病原菌在肠道的定植和提高机体的免疫力等作用[14-15]。黏附通常认为是定植的关键步骤[16]。目前的研究发现,与黏附作用相关的主要是黏附素(如脂磷壁酸、S-层蛋白、脂多糖、肽聚糖等)的分泌及其与黏附素受体结合,而这些与乳酸菌自身表面的疏水性、自聚性、共聚性以及环境中的温度、pH值和离子浓度等因素密切相关。
表面疏水性是一个理化概念,特指表面具有非极性成分的细菌在具有极性性质的水中所表现出的非稳态,从而引起非稳态体系中的热能和分子的重新排列。乳酸菌表面疏水性作为其细胞表面的一种普遍特性,是与宿主细胞之间的非特异性相互作用,是影响菌株黏附性的内在因素,近年来被用来作为评价乳酸菌黏附性能的一个重要参数[13]。Todorov等[17]在评估乳酸菌益生特性的实验中,得出鼠李糖乳杆菌GG疏水性约为55%,约32%的菌株可以黏附于HT-29细胞;而戊糖乳杆菌ST712BZ疏水性较低(38%),但却有63%的菌株能黏附在HT-29细胞上。实验结果表明,菌株表面疏水性与HT-29细胞的黏附率呈负相关。但杨振泉等[18]的研究结果却表明,戊糖片球菌的表面疏水性与Caco-2细胞黏附率呈显著正相关。实验结果的不同可能与乳酸菌菌株种类、黏附细胞种类以及实验方法等因素有关。另外,菌株疏水性受乳酸菌表面蛋白、脂磷壁酸等因子的调节。并且表面疏水性作为间接评价黏附性的方法,只起到辅助判断的作用,应结合其他模型同时使用[19]。
乳酸菌的聚集能力(自聚性和共聚性)作为促进其益生效应的方式之一,Gupta等[20]认为一株良好的益生菌的自聚集比例最小约为40%。也有研究表明益生菌的自聚性能可能影响其对肠上皮细胞和黏膜表面的黏附能力[21]。Kumar等[22]将乳酸片球菌NCDC 252在不同条件(温度、重悬液)下检测其自聚性,结果均表现出90%以上的聚集,在黏附实验中,乳酸片球菌NCDC 252对猪肠道上皮细胞有较强的黏附能力,表明该菌株的自聚性与黏附性存在正相关性,并预测其在人和动物肠道可能存在定植潜能。这一结论与宋雨心等[23]的研究结果一致,即自聚集能力强的乳酸菌往往与肠道上皮细胞有较强的黏附性,并且他们认为乳酸菌自聚集能力可以作为筛选其黏附特性的首要指标。另一方面,乳酸菌的自聚作用不仅可以形成生物膜屏障,还可以阻止致病菌的侵入和感染。在乳酸菌共聚性方面,许文杰等[24]认为乳酸菌与致病菌的共聚性能力越高,与细胞的黏附率就越高。其对10 株乳杆菌与致病菌的共聚性以及与Caco-2细胞的黏附率进行测定,结果发现菌株C88与金黄色葡萄球菌和沙门氏菌有很高的共聚力(40.03%和34.09%),与Caco-2细胞的黏附率也达到约500个细菌/100个细胞,并且菌株C88的共聚力和自聚力存在一定的相关性。这在García-Cayuela等[25]的研究中得到证实,他们发现乳酸菌的自聚性和共聚性存在正相关性。另外,具有与其他细菌(如病原体)共聚的能力可能使其比非共聚性生物体具有定植优势,因为后者更容易从肠道环境中清除。
另外,pH值和钙离子浓度也影响着乳酸菌在宿主肠道中的黏附。外部环境pH值的变化对乳酸菌的黏附存在较大的影响,在酸性环境更有利于乳酸菌的黏附[26]。Bergonzelli等[27]研究发现,乳酸菌在pH 5.0时与Caco-2细胞有较强的黏附能力,但是在pH 7.0时几乎不发生黏附,表明乳酸菌的黏附存在pH值依赖性。另外,Larsena等[28]向乳酸的生长环境菌中添加钙离子,结果显示,植物乳杆菌Q47、约氏乳杆菌NCC533和罗伊氏乳杆菌DSM12246等黏附能力明显提升,钙离子能促进黏附可能是因为激活了钙离子介导的信号通路,从而促进细菌与细胞表面受体间的特异性结合[4]。另外,蒋建军等[29]通过改变钙离子浓度发现,钙离子浓度为2 mmol/L时猪小肠黏膜上皮细胞黏附乳酸杆菌数量最多,表明钙离子浓度也影响乳酸杆菌对猪小肠黏膜上皮细胞的黏附率。
1.2 乳酸菌的运动性
乳酸菌在自然界中种类很多,分布极广。但是绝大多数的乳酸菌并不具备运动的能力[30]。而宿主是通过胃肠道的蠕动输送物质,在这种环境下,乳酸菌在胃肠道的时间以及菌株本身的运动性会影响乳酸菌在肠道中的滞留时间。Kajikawa等[31]从鸡粪便中分离得到一株敏捷乳杆菌BKN88,通过对motB基因的突变构建了一株有鞭毛但不能运动的敏捷乳杆菌BKN134,在无菌小鼠模型中,野生型BKN88和突变型BKN134在粪便标本中的数量均稳定维持在1010CFU/g,二者并没有差异;但是在小肠局部取样计数时,发现回肠黏膜中野生型BKN88数量比突变型BKN134高出约10 倍。另外,在体外实验中,具有运动性的菌株BKN88易与黏蛋白发生黏连,模拟黏液层穿透实验表明,运动的菌株更易穿透黏液层,表明具有运动性的敏捷乳杆菌更容易在黏液层占据生态位,有利于自身进一步增殖,并在肠道中滞留时间会有延长。任世英等[32]从泡菜中筛选出一株具有运动性的鼠李糖乳杆菌属A5,该菌株有较广的抑菌谱,对酸有良好的耐受性,表明该菌株可能在肠道中有较好的定植潜能。
1.3 乳酸的分泌
乳酸是一种弱有机酸,是乳酸菌自身的一种代谢产物,在生长繁殖过程中,它可将90%的代谢糖转化为乳酸,对自身周围的微环境产生影响[33]。Wu Chongde等[34]通过在培养基中添加乳酸改变培养基中的pH值,在初始pH值为6.5时,干酪乳杆菌Zhang(CGMCC No. 1697)及其耐酸性突变菌株(CCTCC No. M2010292)的生物量并没有差异,但是随着pH值降低到4.3时,野生型菌株的生长受到严重的抑制,比突变型菌株的生物量少了57%。当pH值调整到3.3时,7 h后,只有不到0.01%的野生型菌株存活,而突变体的存活率超过10%。但是也有研究表明,可以通过添加血红素和醌类物质使乳酸菌进行有氧呼吸,改变代谢途径,减少乳酸的积累[35-36]。乳酸菌通过利用外源血红素进行有氧呼吸,其在有氧条件下生物量提高,产酸量减少,菌体活力显著提高。另外,Hall[37]、Mao Ning[38]等的研究表明乳酸菌产生的乳酸能够改变小鼠肠道中的pH值,从而显著抑制霍乱弧菌在肠道中的定植。
1.4 与肠道菌群的作用
乳酸菌能同肠道病原菌争夺营养物质,从而让病原菌因缺营养而无法生长;另外,乳酸菌还与肠道中的细菌协同作用,促进其在肠道中的定植;它还能通过分泌细菌素、双乙酰、乳酸等物质对部分细菌的生长繁殖产生抑制作用,促使肠道菌群达到平衡,也对致病菌的生长和毒素的黏附具有一定的拮抗作用[39]。Kingamkono等[40]利用植物乳杆菌299 V对米粥进行发酵,让健康儿童以每天1 次、一周3 次的频率食用,并在第7天、第13天等时间点分别对实验组和对照组宿主肠道里的病原菌进行检测,发现与对照组相比,食用发酵米粥的儿童肠道中总致病菌明显减少。Lash等[41]对植物乳杆菌ATCC801进行了研究,发现该菌株可以抑制大多数革兰氏阳性菌和革兰氏阴性菌的生长,该植物乳杆菌分泌的细胞素对金黄色葡萄球菌、绿脓杆菌和大肠杆菌的生长具有抑制作用。舒中玉等[42]研究也发现罗伊氏乳杆菌能够提高肠道菌群丰度,改变肠道菌群结构。但是肠道微生物群非常复杂,个体之间差异很大,想要完全了解肠道菌群与乳酸菌之间的作用并不是很容易,还需要更加深入的探究。
1.5 宿主基因与体征因素
宿主基因型和体征因素(性别、年龄、疾病与健康等)会影响乳酸菌在肠道中的定植。郭飞翔等[43]通过不同培养基对巴马人群来源的乳酸菌菌群数量进行分离比较,发现分离的杆菌数要多于球菌数,女性肠道乳酸菌总数略高于男性,青少年组的肠道中乳酸菌数量最多,随着年龄的增长,乳酸菌的数量逐渐减少,但是长寿组中的乳酸菌数量还保持在一个很高的水平。另外,徐凤等[44]对2 月龄断奶羔羊、8 月龄和2 岁山羊瘤胃及回肠黏膜刮取物中的乳酸菌进行了分离,随着山羊年龄的增加,分离到的乳酸菌种类逐渐增多。
另外,在没有大的干扰的情况下,宿主肠道内的菌群在一段时间内大多是稳定的。但抗生素等药物的服用以及食物不耐受、吸收不良和泻药等引起的腹泻已被证明能迅速(但通常是短暂的)降低宿主肠道菌群丰富度[45-46]。Tropini等[46]以6~12 周龄的小鼠为模型宿主,通过在饮用水中添加体积分数15%聚乙二醇诱发小鼠产生轻度渗透性腹泻,结果表明,聚乙二醇处理会导致小鼠肠道菌群多样性下降,显著地改变微生物群落。Cabral等[47]采用4 周龄雌性C57BL/6J小鼠为宿主模型,用阿莫西林、环丙沙星或盐酸多西环素添加至饮用水中,与对照组相比,阿莫西林显著降低除拟杆菌门等之外的几乎所有物种的相对丰度。相反,盐酸多西环素和环丙沙星都降低了几种拟杆菌门的相对丰度,同时增加了厚壁菌门相对丰度。以上研究中虽并没有在目科属水平上进行进一步的丰度测定,但是乳酸菌广泛存在于宿主肠道中,且其属于厚壁菌门,在抗生素服用以及腹泻的条件下可能会影响其在肠道中的定植。
1.6 胃酸和胆盐的耐受性
乳酸菌在肠道中定植的首要条件是对胃酸和小肠胆盐具有一定的耐受性,因为人体胃酸环境(pH 3)和小肠高胆盐环境(胆盐质量分数0.1%~0.3%)[48]会杀死部分的乳酸菌或对其活性产生抑制作用,乳酸菌以较高数量和活性到达小肠中有利于其在肠道中的黏附定植。然而乳酸菌的个体差异性对酸和胆盐的耐受性存在差异。Liong等[49]对比了11 株乳酸菌对酸、胆盐的耐受性,在耐酸实验中嗜酸乳杆菌ATCC 4962、干酪乳杆菌ASCC290和干酪乳杆菌ASCC292在pH 2.0下培养2 h后其数量超过107CFU/mL,表现出较强的耐酸能力。而干酪乳杆菌ASCC1520、干酪乳杆菌ASCC1521、干酪乳杆菌 ASCC279、干酪乳杆菌ATCC 15820、干酪乳杆菌 CSCC2607对酸较敏感,培养2 h后数量仅存104CFU/mL。在胆盐实验中,嗜酸乳杆菌ATCC 4356在有胆盐(牛胆汁和胆酸)和无胆盐的情况下生长没有表现出显著差异,而干酪乳杆菌ASCC 290在有牛胆汁的情况下生长受到抑制。
目前,通过包埋的方式有望解决这些影响菌株在肠道成功定植的问题。Anselmo等[50]通过采用壳聚糖和海藻酸钠对菌株进行逐层包封,使其菌株在通过胃肠道时减少损伤,同时包埋材料的使用也会影响菌株对肠道的黏附。Ding等[51]将鼠李乳杆菌、长双歧杆菌、唾液乳杆菌、植物乳杆菌、嗜酸乳杆菌、副干酪乳杆菌、乳酸乳杆菌型Bl-O4和Bi-07型乳酸乳杆菌8 种益生菌采用藻酸盐进行微胶囊化处理。结果表明,微胶囊化提高了菌株在酸性条件、胆盐作用下的存活率。另外,Watson等[52]通过生物技术手段在乳酸菌中克隆和表达Bile基因,在质量分数1%猪胆汁的耐受性实验中,工程乳酸菌比野生型菌株的生物量高出约316 倍,在小鼠胃肠道中的存活率(在粪便测定)也显著得到提高。
1.7 饮食
饮食被认为是能调节胃肠道菌群组成和代谢活动重要的环境因素之一,是影响肠道菌群的主要因素。Shepherd等[53]将卵形拟杆菌NB001以细菌菌落总数约为108CFU喂食小鼠,平衡7 d后喂食紫菜多糖。NB001菌株在肠道中的丰度得到显著增长(4~6个数量级),并可通过调节紫菜多糖的含量调节菌株在小鼠肠道中的丰度。另外,Sonnenburg等[54]在饲粮中添加菊粉后喂食老鼠,在饲粮变化前后,粪便总细菌密度并没有显著差异,在改变以菊粉为基础的饲粮后,多形拟杆菌的相对丰度从第6天的(74±3)%增加到第21天的(84±5)%,表明菊粉能够促进拟杆菌在肠道中增殖。
2 乳酸菌肠道定植的研究方法
乳酸菌的益生功效通常是特定菌株产生的,而很大程度上肠道定植能力决定了其益生功效的高低。因此,在非常复杂的肠道微生物群中追踪单一菌株非常重要,必须采用特定的方法在菌株水平进行识别,以便检测胃肠道中特定乳酸菌的定植和丰度,这对于菌株整体功能性的评价、筛选以及工业应用具有重要的意义。目前,对乳酸菌菌株在肠道定植能力的评估,一般采用体外模拟实验和体内实验(图1)。
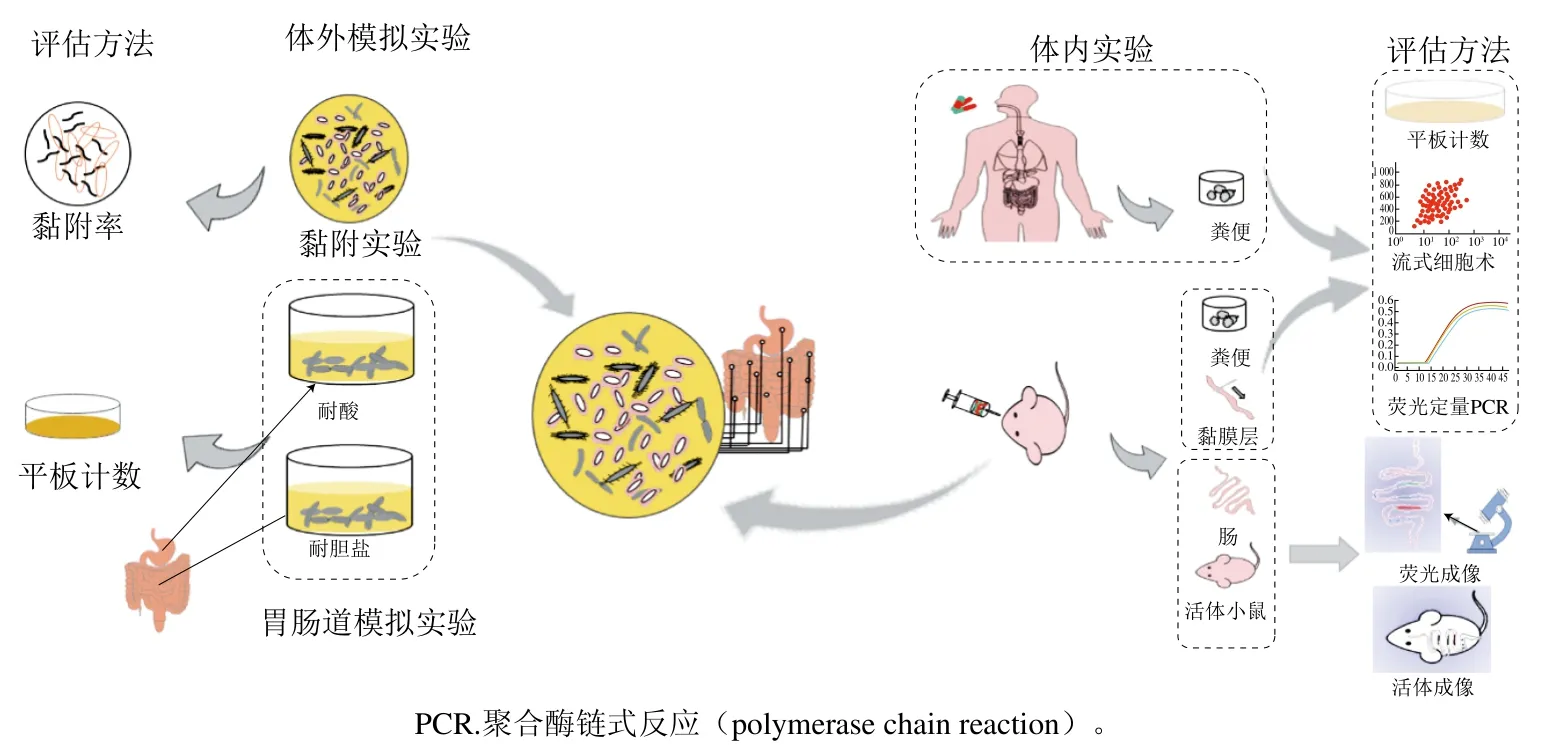
图1 乳酸菌定植能力评估流程Fig. 1 Flowchart for the evaluation of LAB colonization ability
在体外模型选择中主要是考虑乳酸菌的黏附能力,因为黏附通常被认为是定植的关键一步[16],近年来很多研究者将其作为评估其菌肠道定植的一个关键指标,常用的有Caco-2、HT-29及HT-29 MXT细胞等细胞系建立的模型[55-57],可以模拟宿主细胞与微生物的直接接触,并对其黏附率进行测定。大量的研究证实,体外细胞模型能够简单、快速、直观有效地检测益生菌的黏附能力[58-59]。而活体实验主要是以小鼠、人体等作为实验对象。对人体主要是采用收集粪便的方式进行分析,而对小鼠可采用取粪便、活体成像以及对活体肠道黏液层取样分析进行判定。但是,体外模型通常没有考虑活体宿主的先天免疫反应和肠道微生物群落[60]。因此,体外模型并不能可靠地预测菌株在复杂的活体内的真实情况[61];并且对于其肠道黏附能力的检测尚未建立精确、经济高效、省时省力的理想模型。而活体实验虽能更能体现菌株在宿主肠道中的定植情况,但是如何能精确地判定乳酸菌在宿主中的定植情况,还存在很大的挑战,需要开发更加快速方法且可靠的工具来鉴别和量化[62],并由此来对乳酸菌进入宿主肠道后的定植情况进行评估。
2.1 平板计数法
平板计数作为传统对肠道分离物或粪便进行培养计数的方法,一般采用两种方式。一是通过不同的培养基进行微生物的分离选择;二是通过在培养基中添加抗生素对特定的菌株进行选择性培养。Lee等[63]将拟杆菌引入无菌小鼠,并通过平板计数法评估其在肠道中的定植能力。Kajikawa等[31]对野生型和突变菌株经抗生素(链霉素)处理后在雌性Balb/c小鼠的定植进行了评估。实验通过收集小肠和盲肠的标本,采用粗略分批灌洗法对小肠局部黏液层进行冲洗并对乳杆菌进行计数。但此方法获得的实验结果常常准确性并不高,而且操作繁琐。但它仍然是用来了解肠道微生态菌群组成与作用最重要的方法。
平板计数技术是衡量细胞生存能力的标准方法,但并不能实时获得检测结果。对于肠道菌群构成复杂性和样本在处理过程中较多的干扰因素,有些肠道微生物不能在体外进行培养,且平板计数的实验结果重现性差,因此选择能替代平板计数法且特异性好、准确性较高的检测方法显得尤为重要。
2.2 荧光标记法
荧光标记依靠荧光物物质对菌株进行标记或者通过将荧光基因导入菌株基因中,使其在宿主中表达荧光物质,有利于实现对菌株在肠道中定植位点和繁殖速度进行监测,并采用流式细胞仪、荧光成像仪或荧光显微镜等仪器进行分析。
2.2.1 荧光物质标记
目前,大多数的细菌还不能进行基因操作,无法实现基因标记,而荧光物质标记因操作相对简单而被用于细菌标记。羟基荧光素二醋酸盐琥珀酰亚胺脂(carboxyfluorescein diacetate, succinimidyl ester,cFDA-SE)是一种对活细胞进行荧光标记的细胞染色试剂,它可以透过细胞膜,进入细胞后可以偶发性地并不可逆地和细胞内蛋白的赖氨酸残基或其他氨基发生结合反应,并标记这些蛋白,由于cFDA-SE标记细胞的荧光非常均匀和稳定,每分裂一次,子代细胞的荧光会减弱一半,因此可以通过检测其荧光强度对菌株的传代速度进行实时监测分析[64-65]。Lee等[66]以BALB/c老鼠为实验对象,采用细胞增殖示踪荧光探针cFDA-SE对干酪乳杆菌在小肠的定植潜力进行探究,并用流式细胞仪对干酪乳杆菌在肠道不同部位的倍增时间进行测定。Fogliano等[67]将可可中不溶于水的组分体外消化酶解后添加到体外结肠模型中,并采用荧光原位杂交技术对模型中的细菌进行计数,结果乳酸杆菌数量显著增加。刘倩等[68]采用异硫氰酸荧光素标记鼠李糖乳杆菌P15和干酪乳杆菌,并刮取牙鲆的胃、盲囊和前肠的黏液进行实验,在荧光显微镜下用血球计数板计数黏附的乳酸菌个数,发现在盲囊和肠道中干酪乳杆菌的黏附率显著高于鼠李糖乳杆菌P15,但两者对胃的黏附差异无显著性。采用荧光物质标记的不足之处是标记效率并不高,还可能会改变细菌的表面性质,从而影响到其他性质测定的准确性[19]。
2.2.2 荧光基因标记
尽管荧光染料的种类繁多,但采用荧光物质标记常常会出现光信号丢失,造成假阴性的结果,且成像效果易受体内生物分子的影响,所用的荧光物质存在一定的安全隐患。因此开发其他的标记方法就显得更加重要了。van Zyl等[69]通过同源重组将编码红色荧光蛋白的mCherry基因整合到植物乳杆菌423基因组的非功能区。mCherry基因的表达并没有改变植物乳杆菌423的生长速度,对细菌素的产生也没有影响,通过动物实验在体外对小鼠肠道进行荧光活体成像,确定植物乳杆菌423在小鼠的盲肠和结肠中发生定植。北婷婷[70]利用红色荧光蛋白dsred2(具有荧光强度高、检测方便等优点)标记鼠李糖乳杆菌05-28,然后将其灌胃小鼠,取小鼠各肠道制作石蜡切片,利用荧光显微镜观察重组菌株在小鼠肠道黏附情况。发现在3 h后小鼠肠道各部位均能检测到重组菌株,4 d后达到定植的高峰,第15天小鼠各肠道均未检测到重组菌株,表明该菌株在肠道中的定植偏好顺序依次为回肠、结肠、空肠、十二指肠。另外,董浩等[71]以绿色荧光蛋白为报告基因应用于示踪重组乳酸乳球菌在小鼠体内的位点,采用荧光显微镜镜检发现小鼠胃肠道都存在一定数量的重组乳酸乳球菌。
为解决同源菌种在肠道定植问题,Whitaker等[72]将绿色荧光基因和红色荧光基因(对照)导入拟杆菌VPI-5482中,并将其灌喂小鼠,进行荧光成像分析。当同时定植时,对近端结肠的管腔和隐窝的成像结果显示,两株菌在两个位置的丰度大致相同,然而,当先对小鼠进行7 d灌喂表达红色荧光基因的拟杆菌VPI-5482后,再对其引入表达绿色荧光基因的拟杆菌VPI-5482,仅在24 h后管腔内表达绿色荧光基因的拟杆菌VPI-5482的水平就显著降低,而且这种变化在官腔隐窝处的定植中更为显著。Shephsed等[53]利用带有红色荧光基因的野生型多形拟杆菌对小鼠进行喂食,7 d后,用绿色荧光蛋白标记并携带有21个利用海藻多糖基因的多形拟杆菌进行喂食,当饮食中不加入海藻多糖,带绿色荧光基因的菌株不能够成功定植;加入海藻多糖后,带绿色荧光基因菌株能够定植在结肠。
2.3 聚合酶链式反应
在复杂的肠道菌群中,采用荧光物质和荧光标记菌株的效果会受到荧光信号强弱、荧光稳定性以及是否需要外源激发光等的影响。而采用PCR和实时荧光定量PCR(real-time quantitative PCR,qPCR)能对其进行定量分析,并且具有耗时短、结果准确性高等特点。但这两种方法对于实验菌株中存在的特异性DNA片段的选择要求较严格,并且需要通过对该片段进行引物设计,才能在菌株水平上对其进行准确的定性定量分析。Nation等[73]利用qPCR技术,通过特异性基因(tuf)引物对婴儿粪便中的罗伊氏乳杆菌进行定量分析。这种方法在陆文伟等[74]的研究中也得到了应用,他们将副干酪乳杆菌LC01灌胃老鼠,采用副干酪乳杆菌种属特异性引物对老鼠粪便进行qPCR,结果发现菌株并不能长期定植在小鼠肠道中,但可在一段时间内调节肠道菌群,从而改善小鼠肠道健康。在Treven等[75]的实验中则是从14 对加氏乳杆菌K7分泌的加氏细菌素K7 A和K7 B决定基因簇的特异性引物中筛选出一对针对K7 A和K7 B总基因簇具有特异性的引物,并以人为实验对象,收集粪便,采用qPCR对人粪便标本中的加氏乳杆菌K7进行定量分析。
另外,在乳酸菌鉴定和对多态性分析中随机扩增多态DNA(random amplified polymorphic DNA,RAPD)的应用较广泛,能在菌株水平对乳酸菌进行鉴别。Fujimoto等[76]以人体为实验对象,利用RAPD分析得到干酪乳杆菌特异性引物,并采用qPCR和4’,6-二氨基-2-苯基吲哚染色对人体粪便中干酪乳杆菌进行鉴定和量化,由此对干酪乳杆菌被摄入后在人体肠道中的增殖能力进行探究。重复序列PCR(repetitive sequence-based PCR,rep-PCR)能将乳酸菌鉴定到种和菌株的水平。黄丽丽等[77]初步采用16S rRNA基因序列确定冷水鱼肠道中乳酸菌的系统发育关系,并通过rep-PCR指纹图谱技术进一步区分高度同源性菌株。随着下一代测序技术的出现和基因组数据量的增加,对于生物信息学工具的开发需求日益增长,目前有很多工具可以进行泛基因组分析[78],如PGAP(pan-genome analysis pipeline)、Pan-seq(pan-genome sequence analysis program)以及PGAT(prokaryotic genome analysis tool)等工具能实现对同一种或属的各种生物信息进行比较,能高效且准确地筛选出目的菌株特有的DNA片段,可以用于乳酸菌在肠道或粪便中进行检测和定量分析。
2.4 新型纳米材料
近年来,纳米材料发光技术越来越多地应用到益生菌在活体体内的示踪上,主要包括长余辉纳米材料和上转换纳米材料等,其具有较强的组织穿透性,在生物组织中的吸收也较少且伤害较小,在体内成像应用中备受青睐[79-80]。Liu Yaoyao等[81]将Cr3+掺杂的锌镓锗长余辉纳米材料用革兰氏阳性菌LTA抗体进行功能化,然后对罗伊氏乳杆菌进行标记,以监测其在口服后进入胃肠道的“行踪”,体内动物成像证明,经过纳米材料标记的罗伊氏乳杆菌经口服给药后能够实时、无损地检测罗伊氏乳杆菌在小鼠体内的分布。Martín等[82]报道了一种用氧化铁纳米粒子标记乳酸杆菌的方法,并且磁性在细菌分裂后还存在。与磁性细菌不同的是,这种人工磁化的细菌可以通过调整细菌培养条件和磁性纳米粒子的数量来调节细菌的磁性,磁性可进行量化,操作便捷。基于新型纳米材料对益生菌体内分布进行示踪的生物光学成像技术具有高度选择性、敏感性和非侵入性等优点,已广泛应用于生物医学领域[83]。
3 结 语
目前,对乳酸菌在肠道定植的探究已经做了很多研究工作,其定植的机制仍还未完全探明。尽管已有的体外黏附模型有助于乳酸菌在肠道定植机制的研究,但现有的体外模型还无法可靠地反映乳酸菌在肠道环境中真实的定植效果,因此,选择建立一个合适的体外定植能力的评估模型尤为重要。另外,复杂肠道环境中各种因素的干扰给乳酸菌在示踪和定量上带来很大的挑战。未来研究的重点可以针对这些环境干扰因素开发各类示踪技术和定量方法以及通过与其他组学结合进行研究,旨在追踪乳酸菌在复杂的肠道环境中定植位点以及精确评估定植时间和数量。另外,还需要与其他学科结合,如利用新型纳米材料、软件分析技术等对乳酸菌肠道定植机理进行更精确、更大规模、更加深入的研究。
