人工模拟胃肠道模型在食源性致病菌异质性研究中的应用进展
2022-01-06王扬眉潘迎捷刘海泉
赵 伟,王扬眉,潘迎捷,2,3,赵 勇,2,3,*,刘海泉,2,3,4,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业农村部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306;4.上海海洋大学食品热加工工程技术研究中心,上海 201306)
食源性致病微生物是影响人类健康及生命安全的一大因素[1]。据世界卫生组织报告显示,全球每年发生的6亿多起食品安全事件导致约42万 人死亡,其中40%的食源性疾病患者为5 岁以下儿童,每年约有12.5万 例儿童患者死亡[2]。食源性致病微生物带来的食品安全问题已成为全球关注的热点和难点问题[3]。在日常生活中,人类误食携带食源性致病微生物的食品后,会产生腹泻、呕吐、发烧等临床症状,更严重者会出现反应性关节炎、心脏病等疾病。
面对食源性致病菌的巨大危害,研究人员通过建立风险评估体系来预防和降低其影响,但在此过程中,发现某些食源性致病菌在同样的处理条件下所产生的差异性会对已经建立的风险评估体系造成一定的影响。Murphy等[4]在1998年最早提出菌株异质性的概念,他们指出菌株异质性能真实地反映种群的差异性,且微生物异质性的概念也在后续的研究中得到逐渐完善,一般是指同一微生物即使在实验室中通过单克隆培养后,最终群体中的每个细胞间都可能在遗传、生理和生长行为等方面表现出广泛的差异性[2,5]。食源性致病菌表现出的异质性(耐药异质性、耐受异质性、毒力异质性等)会造成风险评估的不确定性和变异性,尤其会增加在工业生产中杀菌以及临床治疗的难度,最终对危害特征描述甚至微生物风险评估过程的准确性产生影响[6],直接影响到人类的健康。
目前国内关于食源性致病菌异质性的研究相对较少,能够运用于研究异质性而建立的模型更是少之又少。因此,建立相应的模型来研究异质性迫在眉睫,而在人体胃肠道中探究其耐受、耐药异质性,有助于直接揭示食源性致病菌异质性对风险评估的影响以及其致病机理。为尽早预测这种异质性以及为应对异质性挑战提前做准备,本文详细总结了使用人工模拟胃肠道模型来研究食源性致病菌异质性的应用进展,以期能够更好地利用其仿生消化系统以及能够连续取样和监测、成本低、效率高、重复性好且无体内实验涉及到的伦理限制等优点来探究食源性致病菌在人体胃肠道内的异质性及其致病机理,为解决食源性致病菌引发的食品安全问题提供科学依据,并从源头上有效控制食源性致病菌的致病风险。
1 模拟胃肠道模型
1.1 动物感染模型
人体胃肠道是一个相对复杂的内部结构,包括胃、小肠以及大肠,且人体胃肠道微生物种类繁多、数量巨大[7-9](图1)。人类胃肠道的疾病机制十分复杂,在理想情况下,食源性致病菌研究应该结合临床实验开展,然而由于消化道结构与功能的复杂性以及临床研究重复性差、成本高、周期长、工作量大等原因,临床经验的积累在时间和空间上都存在很大的局限性,且许多实验在伦理上也受到限制;同时由于人类肠道微生物的复杂性,许多微生物功能方面的问题也急需解决,因此结合临床实验开展食源性致病菌的研究进展缓慢[10]。基于上述情况,动物感染模型应运而生,目前动物生理学、动物病理学和动物治疗学等研究领域广泛应用了动物模型。在自然条件下,研究人员主要利用动物模型进行间接研究,有目的地筛选不易排除的因素,从而更加准确地观察实验的结果,并与实际的人类胃肠道疾病比较,准确地了解人类疾病的病理机制。一般情况下,动物模型可以分为灵长类动物、雪貂、猫、犬、啮齿类动物、猪等几类[11],可广泛应用于探究食源性致病微生物在人体胃肠道的感染机理。在众多的食源性致病菌中,革兰氏阴性微需氧菌幽门螺杆菌(Helicobacter pylori)是常见的存在于人类胃肠道中的食源性致病菌[12],它在胃内定植可引起人体不同的病理改变,包括胃炎、消化性溃疡、黏膜相关淋巴组织淋巴瘤、癌前病变和胃腺癌[9]。自1983年发现幽门螺杆菌以来,研究人员一直致力于在动物体内模拟其感染人致病的过程、分析肠道菌群的变化及进行开发疫苗的研究[11-13],也将多种动物模型应用于其致病机理的探究。其中,Suganya等[13]利用幽门螺杆菌悉尼菌株在胃内的定植构建了幽门螺杆菌感染小鼠模型,以探究一种热灭活全细胞疫苗治疗幽门螺杆菌的可能性;Miszczyk等[14]构建了一个慢性幽门螺旋杆菌感染大鼠模型,用于探究胃微循环变化以及植物产品对慢性胃炎的治疗效果;Memariani等[15]利用幽门螺杆菌悉尼菌株在胃中定植建立了一种大鼠幽门螺杆菌感染模型,用于研究大西洋黄连木精油对消化性溃疡的治疗效果;Rong Qian等[16]通过构建猪模型,发现青牛胆在体内和体外对幽门螺杆菌均有较强的抑杀作用;Mathur等[17]将人源化小肠上皮细胞的小鼠模型首次应用于沙门氏菌疫苗研制的研究中;Lu Shuaiyao等[18]选用了非人灵长类动物2个家族(旧大陆猴和新大陆猴)中的3个常用品种(恒河猴、食蟹猴和狨猴)进行SARS-CoV-2的感染,比较了3个品种非人灵长类动物在感染SARS-CoV-2后的临床症状、病毒在体内的复制和分布以及宿主对病毒感染的反应。
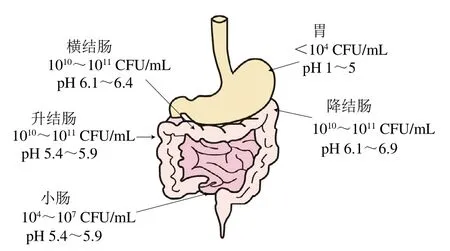
图1 人体胃肠道模型及肠道菌群密度分布示意图[7,17-18]Fig. 1 Schematic diagram of the human gastro-intestinal tract model with the density distribution of intestinal flora[7,17-18]
虽然过去很多学者将动物感染模型广泛应用于食源性致病菌以及流行病毒的研究中,但是动物感染模型仍然存在很大的局限性。理想的动物模型应该和人类具有相同的感染途径、发病率、死亡率、肠道菌群等,感染性动物模型毕竟是利用动物通过人工感染方式进行模拟研究,尤其是通过人源性病原体感染动物往往不会得到和人完全相同的病程,这也是感染动物模型最大的应用局限性;因此,通过实验动物模型得到的研究结果必须经过慎重地对比才能类推到人类。动物模型的局限性一般包括以下几个方面:1)动物和人体存在较大差异,可能使同一病原体在不同的机体中表现不同。人类在遗传背景、生理基础、生活环境等方面和动物都有一定的区别,选择进化树和人类接近的动物,可能更能表现出疾病的类似性;2)动物种类和等级的限制等因素影响动物模型,不同的动物遗传和生物学特性不同,对病原和致病菌感染会有不同的表现,不同种属、品种、品系动物存在的个体差异也会影响模型的一致性;3)微生物的生物学特性会对模型产生极大的影响。总之,运用动物模型研究食源性致病菌虽然可以避免伦理问题,但是无法真实地显示饮食、基因型或环境因素对人体胃肠道微生物组成的影响,而且物种间存在差异性,通过动物模型所得到的实验结果多数与临床结果不一致,其并不完全具备典型性;因此从普通动物模型中得到的结论不能直接类推到人体,无法准确反映人体肠道菌群的真实情况,这也成为未来需要解决的一个重要科学问题。
1.2 人工模拟胃肠道模型
人工模拟胃肠道模型是在实验室的条件下,通过模拟人体消化过程中化学和物理的变化及生物的作用,分析食源性致病菌的耐受异质性及致病机理,为后期研发疫苗提供实验基础[19]。
1.2.1 静态胃肠道模型
静态胃肠道模型在食源性致病菌的研究中应用广泛,主要通过模拟胃肠道环境来探究食源性致病菌在人体消化过程中的耐受性和异质性。Jiang Lingli等[20]利用体外模拟胃肠道模型研究了单核细胞增生李斯特菌在胃液中的存活情况,结果发现单核细胞增生李斯特菌无法在pH值为2.5和3.0的胃液中存活。Vaz等[21]研究了在模拟胃肠道条件下(在有食物的情况下)葡萄酒对蜡状芽孢杆菌存活性的影响,发现除了合成胃液的作用外,葡萄酒会大大减少蜡状芽孢杆菌活菌的数量。关小莺等[22]以干酪乳杆菌发酵荔枝汁为研究对象,在人工胃液、肠液环境下对干酪乳杆菌的存活情况进行研究,结果发现干酪乳杆菌在人工肠胃液中具有较强的耐受能力。Wijnands等[23]使用体外静态模型对沙门氏菌在模拟胃液中的存活情况进行了研究。André等[24]利用体外胃肠道模型模拟食物在胃中的消化过程并创建了新的消化方法(INFOGEST 2.0)。Roussel等[25]运用体外静态模型对成年人及儿童胃肠道环境进行模拟,探究食源性致病菌在不同年龄段人群胃肠道中耐受性的差异。静态模型是目前体外模型中应用最为广泛的消化模型,主要适用于局部消化的研究,其操作比较简单,但是静态模型不能模拟胃肠道的蠕动以及观察食源性致病菌在人体胃肠道发生的物理化学和生物变化[26]。
1.2.2 动态胃肠道模型
动态模型是在静态模型的基础上发展而来,目前主要开发出3 种动态模型。动态模型的优势在于不仅能模拟胃肠道中物理和化学变化过程,而且可以显示不同消化时间下发生的变化,也可以用于研究食源性致病菌的致病机理。
动态胃模型(dynamic gastric model,DGM)是目前使用较多的模拟胃内部消化的单室动态模型[27]。DGM由2个连续的隔室组成,第一阶段主要模拟食品样品在胃中的剪切、混合等物理过程,然后将处理好的食物经过特异性胃排空到第二阶段的胃窦中[28],此部分是胃消化过程中的关键“加工站”,但它无法准确地模拟消化过程中胃部的动态蠕动;而人体胃模拟器(human gastric simulator,HGS)是一种用于研究食物消化的体外胃模型,它能够模拟胃壁的连续蠕动,具有与体内胃肠道相似的收缩力和频率[29],此外还结合了胃液分泌、排空系统和温度控制,可以准确模拟动态消化过程,详细分析摄入食品的物理和化学性质的变化[30],其最大的优势在于胃壁的蠕动收缩力和收缩频率均可灵活调节,且与体内数据近似[31]。
DGM和HGS虽然非常适合胃部体外消化研究,但相对于整个消化系统而言,仅提供了局部胃处理过程的实验结果,无法完全模拟整个消化过程中的连续变化,为了克服这个缺点,双室和多室动态模型应运而生。由荷兰国家应用科学研究院(The Netherlands Organization for Applied Scientific Research,TNO)开发的TNO胃肠道模型1(TNO gastro-intestinal model 1,TIM1)是目前最接近真实人体胃肠道消化的体外动态双室模型,主要分为5个部分,包括消化道的胃、十二指肠、空肠、回肠和结肠,每一部分均用柔性膜来模拟对应的消化道场所[32]。TIM1系统能够模拟人体胃肠道中的大多数参数,如胃排空、人体温度、胃肠液的pH值变化、胃肠的消化时间等。TNO胃肠道模型2(TNO gastro-intestinal model 2,TIM2)在TIM1的基础上发展演变而来,增加了模拟肠道微生物的功能[33],可以模拟人体不同代谢阶段的消化情况。
肠道微生物模拟系统[34](simulated human intestinal microbial ecosystem,SHIME)是一个模拟人类胃肠道微生物生态系统的五级反应器,利用两级“填充和拉伸”系统模拟小肠,利用三级反应系统来模拟大肠,并通过监测发酵通量以及产物情况来验证整个系统,分析体内胃肠道微生物群落的多样性和活性。
体外动态胃肠道模型普遍具有操作简单、重复性良好、可实时监控且可根据实验目的改变实验条件等优点,但同时存在设备价格昂贵、系统内部不易清洁以及无法切实模拟消化过程中激素分泌和反馈调节等缺点。因此,想要人工模拟胃肠道模型能够达到完全模拟人体消化过程仍然是一个挑战,需要更先进的科学技术加以辅助与验证。表1详细比较了不同胃肠道模型的优劣势。
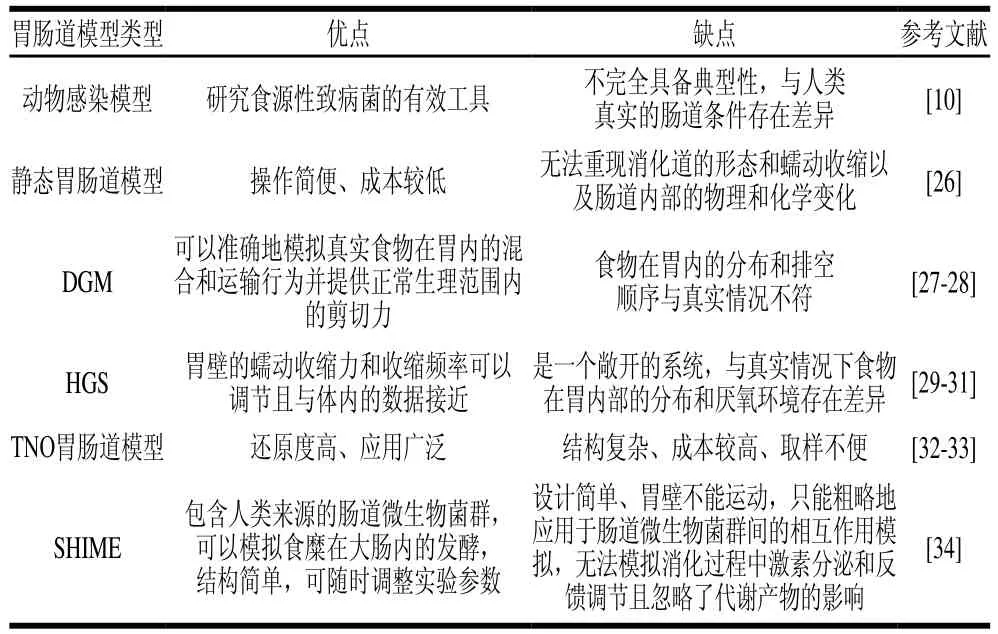
表1 不同的胃肠道模型的比较Table 1 Comparison of different gastrointestinal tract models
2 应用人工模拟胃肠道模型探究食源性致病菌的异质性
异质性是微生物在复杂多变环境中生存的一种策略,在表型和遗传等方面表现出差异,使微生物能够在一定的生存环境中选择特定的生存方式(与生存环境的变化协调一致),从而表现出该微生物的多样性。通常来说,生长行为表现出的差异性被称为生长异质性[35-36];不同环境和食品中分离的微生物,其耐药性、生理特性等具有显著的差异,属于典型的表型异质性。而同一菌株的不同单细胞,其毒力和致病性亦存在差异,且具有多样性,在不同环境条件下表现出不同的生长速率、生物被膜的形成能力以及耐药性等,这种广度的异质性使得菌株对环境产生不同的适应性和抗性[37-39]。目前,国内的大部分报道主要集中于在体外研究单因素(不同温度、盐度、pH值等)条件下食源性致病菌表现出的异质性,而聚焦于人体胃肠道环境下进行食源性致病菌异质性的研究相对较少。因此,应用人工模拟胃肠道模型来探究食源性致病菌的异质性具有重大的科学意义。
2.1 应用人工模拟胃肠道模型探究食源性致病菌耐受异质性
2.1.1 应用人工模拟胃肠道模型探究大肠杆菌耐受异质性
微生物的培养生长一般可分为4个时期:延滞期、对数生长期、稳定期及衰亡期。食源性致病菌的生长异质性可能会出现在任何一个生长时期,其产生的主要原因是致病菌不管是在延滞期的适应过程、对数生长期的生长过程、稳定期的动态平衡过程还是在衰亡期的负生长过程,都会因为生长环境的胁迫在生长速率、传代时间、耐受性及生长极限等方面表现出较大的差异性[40]。由TNO构建的TNO肠道模型TIM最初用于药物活性的动态测试,是一种计算机多单元控制的体外消化模拟系统,现如今广泛应用于探究食源性致病菌生长异质性。Miszczycha等[41]将大肠杆菌O26:H11和大肠杆菌O157:H7接种于生牛乳,并将其发酵制作为奶酪,随后用TIM1系统研究奶酪中的大肠杆菌在模拟消化过程中的存活率变化,结果发现在通过人工胃和十二指肠的过程中,大肠杆菌存活水平降低;在胃隔室150 min后大肠杆菌O157:H7、大肠杆菌O26:H11的回收率分别为0.2%和1.8%,在回肠隔室中发现大肠杆菌O26:H11的存活率是大肠杆菌O157:H7的13 倍。由实验结果可知,同种属菌株间对模拟消化液的耐受性存在很大的差异性,表明同菌株间生长特性存在异质性,这种异质性的存在丰富了对菌株的研究内容,同时为研究食源性致病菌在胃肠道中的耐受异质性提供了理论基础。不同年龄层次的人群对菌株的耐受异质性同样存在差异。Roussel等[25]利用TIM研究大肠杆菌O157:H7在成人和儿童胃肠道消化条件下的存活率及毒力变化,结果发现大肠杆菌O157:H7的生长异质性及致病能力在成人和儿童的胃肠道中有较大差异,大肠杆菌O157:H7在儿童胃肠道中的致病能力以及存活率显著高于成年人胃肠道。
2.1.2 应用人工模拟胃肠道模型探究副溶血性弧菌耐受异质性
外部环境(温度、盐度、pH值)和内在因素(不同毒力基因型)对食源性致病菌的异质性都有一定的影响。王思琦[42]利用人工静态模拟消化模型对上海市不同来源的副溶血性弧菌在人体模拟消化过程中的存活率、形态变化、异质性及基因表达变化进行了验证性研究,结果发现在人体消化过程中,唾液对副溶血性弧菌无明显影响,不具备杀菌作用;副溶血性弧菌在胃液中存活率低,细胞的微观结构受到严重破坏,胃是人体对副溶血性弧菌最有效的杀菌部位,致病性(trh+trh+、trh+tdh-、tdh-trh+)和非致病性(trh-tdh-)菌株的存活率存在显著差异(致病性菌株的存活率显著高于非致病性菌株)。Wang Yangmei等[43]首先通过模拟人体胃液探究50 株副溶血性弧菌在37 ℃下的生长异质性,其次研究了致病性和非致病性副溶血性弧菌在模拟人体胃液条件下的变异系数,结果表明,模拟人体胃液处理显著提高了致病菌株的最大生长速率,缩短了延滞期的时间;而非致病菌株的最大生长速率降低,延滞期时间延长。同时致病基因型(tlh+/tdh+/trh-)菌株的变异系数明显升高,说明致病基因型(tlh+/tdh+/trh-)的菌株对模拟胃液有较强的适应性,结果表明副溶血性弧菌对模拟胃液表现出明显不同的耐受性和生长异质性。王思琦等[44]将浓度为107CFU/g的副溶血性弧菌接种于三文鱼和南美白对虾中,运用体外人胃仿生原位消化系统进行消化模拟,在食物消化120 min进入肠道后,副溶血性弧菌并没有完全被胃酸杀灭,这表明副溶血性弧菌可随食物基质的消化分解通过胃排空进入肠道,从而避免胃酸的杀灭并导致人体患病,初步揭示了副溶血性弧菌在人体消化道中的耐受性及致病机理。副溶血性弧菌的存活异质性受胃肠道的影响很大,江明伦等[45]等探究了3 株副溶血性弧菌在经酸处理后在模拟胃肠道环境中的存活情况,结果发现3 株菌表现出不同的耐受性,其中两株副溶血性弧菌的存活率较高,另一株没有显著变化。
2.2 食源性致病菌耐药异质性的探究方法
致病菌对抗生素产生耐药性是对人类健康的全球性威胁。近几年的一些研究表明,致病菌的耐药异质性发生率很高,并且最终会导致临床抗感染治疗的失败。虽然有很多检测致病菌耐药异质性的方法,如菌谱型分析法、琼脂稀释法、微量肉汤稀释法、分子检测法、群体-曲线下面积法及药敏纸片扩散法等,但是致病菌的耐药异质性如何在肠道中导致治疗失败的原因并没有得到详细的研究[46]。菌株耐药异质性主要可以分为对不同种类抗生素的耐药性(即单一抗生素耐药性或多重抗生素耐药性)以及对同种抗生素耐药剂量的差异[47],若食源性致病菌产生耐药异质性,则会导致原来的抗生素以及抗生素用量无法产生效用,致使临床治疗失败。目前,只有少数的动物感染模型被应用于探究致病菌耐药异质性和临床治疗失败之间的关系。Band等[48]利用小鼠模型研究了阴沟肠杆菌耐药亚群介导的抗生素失效,在小鼠感染但没有黏菌素治疗的情况下,小鼠的先天性免疫防御系统导致耐药亚群的数量增加,使得分离菌株产生耐药性,导致随后的黏菌素治疗失效,同时在黏菌素治疗期间,耐药亚群的数量也上升了。Band等[49]在另一项研究中发现小鼠在感染对黏菌素敏感的菌株(肺炎克雷伯氏菌GA65146)后未经黏菌素治疗会死亡,通过黏菌素治疗后能够存活。但感染了任何一种耐药异质性菌株(肺炎克雷伯氏菌Mu9或Mu156)的小鼠即使在黏菌素治疗的情况下也无法存活。这两项研究都是利用小鼠模型证明了菌株的耐药异质性会导致黏菌素临床治疗失败,且表明小频率(10-6~10-2之间)耐药亚群的持续存在会导致治疗失败。除了小鼠模型之外,其他动物感染模型和人工模拟胃肠道模型也被用来研究菌株的耐药异质性,例如Nicoloff等[50]用兔心内膜炎模型证明了万古霉素治疗失败与两种异质性万古霉素中介金黄色葡萄球菌分离株有关。Pierre等[51]使用大鼠模型,在其皮下植入耐甲氧西林的金黄色葡萄球菌MRGR3,经2 mg/L的替考拉宁或范康霉素作用约12 h后,大鼠模型中没有出现明显的糖肽抗性亚群,但未经抗生素治疗的大鼠模型3 周后出现了糖肽抗性亚群,表明在一定的人体胃肠道条件下可能会提高糖肽抗性亚群出现的频率。Yun等[52]利用人体胃肠道消化模型探究胃肠道的消化环境对抗生素浓度的影响以及金黄色葡萄球菌RN4220经人体外消化后对四环素、氧氟沙星和青霉素3 种抗生素耐药性的变化,结果发现经人体消化后金黄色葡萄球菌RN4220对3 种抗生素的耐药性增强。除了动物模型的研究,药效学模型也可以预测耐药异质性可能导致治疗失败。在一项研究中,研究人员通过构建4 种不同推荐剂量方案的体外药动学-药效学模型,观察24 h后两株耐药异质性鲍曼不动杆菌菌株对黏菌素耐药性的变化,黏菌素干预初期两株耐药异质性鲍曼不动杆菌大量死亡,6 h后这两种菌株开始迅速生长[53]。
3 结 语
食源性致病菌是影响食品安全的主要因素之一,而其异质性会对风险评估的准确性产生极大的影响,但目前对异质性的研究不够重视,因此迫切需要研究食源性致病菌的异质性并完善微生物风险评估体系。通过对动物模型和体外人工模拟胃肠道模型进行比较,发现人工模拟胃肠道模型可以针对不同年龄、不同患病情况的病人进行独立实验设计,其操作相对简便,属于机械性的体外模拟。已有学者将动态模型运用于探究副溶血性弧菌和大肠杆菌的耐受异质性从而构建更加全面系统的食品安全风险精准评估体系。但目前人工模拟胃肠道模型在食源性致病菌异质性研究的应用仍存在许多不足,今后人工模拟胃肠道模型的研发方向和应用范畴应关注以下问题:1)开发更加接近人体实际情况的体外胃肠道模型并不断完善人工模拟胃肠道模型的标准。体外胃肠道模型最大的优点在于不涉及伦理道德问题,可以根据实验目标模拟胃肠道的条件,具有操作简单、重复性好、可以实时监控等优势。但是目前已经开发的人工模拟胃肠道模型和人体的真实胃肠道还是存在很大的差异,导致一部分的实验结果不具有代表性,而且模拟胃肠道模型缺乏统一的标准,很多实验参数存在很大的差异性,所得到的实验结果不能进行系统性分析。因此,在后续的研究中,应不断完善人工模拟胃肠道模型,使其不断接近人体胃肠道的真实状态,同时不断完善人工模拟胃肠道模型的标准。2)综合运用新兴的科学技术构建新型的人工模拟胃肠道模型。未来,人工智能将作为相关医学研究的常规工具[54]。在后续的研究中可将仿生学和人工智能结合来研究食源性致病菌的异质性。3)建立特异性人工模拟胃肠道模型研究食源性致病菌。在目前存在的人工模拟胃肠道模型中,多数是针对健康的成年人设计的,而人体胃肠道动力以及生化环境会受到年龄以及性别等因素的影响,面对这样的情况,应该设计和构建符合特异性人群的胃肠道模型来研究食源性致病菌的异质性。
