‘平阳黄汤’对高脂饮食大鼠肠道屏障和肠道菌群的影响
2022-01-06欧阳建李秀平卢丹敏黄建安曾呈理谢前途钟维标刘仲华
欧阳建,李秀平,周 方,卢丹敏,黄建安,曾呈理,谢前途,钟维标,刘仲华,*
(1.国家植物功能成分利用工程技术研究中心,湖南农业大学 茶学教育部重点实验室,植物功能成分利用省部共建协同创新中心,湖南 长沙 410128;2.浙江省平阳县农业农村局,浙江 平阳 325400;3.浙江子久文化股份有限公司,浙江 平阳 325400)
肥胖是指可损害健康或增加死亡率的过量脂肪累积,与高血脂、糖尿病和非酒精性脂肪肝等代谢性疾病的发展密切相关[1]。随着人们饮食习惯的改变和生活水平的提高,高脂食物摄入的增加已成为肥胖及非酒精性脂肪肝等代谢性疾病发生的主要原因。长期高脂饮食诱导肥胖与肠道菌群关系密切,高脂饮食干预可降低肠道菌群的丰富度和多样性,改变机体的氧化还原状态,损伤肠道黏膜屏障功能,最终诱导肥胖的发生[2]。
茶作为一种天然植物健康饮料,与肠道菌群和肠道屏障有着复杂的相互作用,能有效调节肥胖和相关代谢紊乱。微生物能将茶叶中的多酚和多糖等物质分解为短链脂肪酸和酚酸等代谢物,增强肠道屏障作用,有效发挥抗肥胖功能;同时,茶叶中的代谢物能够调节肠道微生物的结构和功能,间接参与宿主的能量吸收与生理代谢,从而有效调控肥胖[3-5]。然而,茶叶调节肠道菌群和肠道屏障与预防肥胖的机制目前仍不清楚。
黄茶是我国特有的茶类,其独特的闷黄工艺形成了干茶金黄、汤色杏黄、叶底嫩黄的“三黄”品质[6]。目前有研究表明,君山银针和黄大茶等在调节血脂和改善肝组织损伤等方面具有良好效果[7-8],却鲜有研究涉及黄茶调节肥胖与肠道屏障和菌群之间的关系。‘平阳黄汤’作为黄茶中的代表性名茶,对其健康功效研究较少,其调节肥胖的效果目前更是鲜有研究。因此,本实验拟选取有代表性的‘平阳黄汤’为材料,建立肥胖模型,评估‘平阳黄汤’调控高脂饮食大鼠肥胖的效果及与肠道屏障和菌群的关系。
1 材料与方法
1.1 动物、材料与试剂
SPF级4~5 周龄雄性SD大鼠40 只,体质量(180±10)g,由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号:SCXK(湘)2019-0004。所用脂肪质量分数60%高脂饲料(编号23300,供能21.32 kJ/g)和脂肪质量分数10%正常饲料(编号23302,供能15.05 kJ/g)购自江苏南通特洛菲饲料有限公司,主要成分包括玉米淀粉、豆油、蔗糖、纤维素等。
茶样‘平阳黄汤’由平阳县农业农村局提供。
甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)检测试剂盒 南京建成生物工程研究所有限公司;瘦素(leptin,LEP)、脂联素(adiponectin,ADP)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin 6,IL-6)、脂多糖(lipopolysaccharide,LPS)酶联免疫吸附测试试剂盒 武汉华美生物工程有限公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗原修复液、CY3-TSA、自发荧光猝灭剂等武汉塞维尔公司;21733-1-AP闭锁小带蛋白1(zonula occludens 1,ZO-1)抗体 美工Proteintech公司;闭锁蛋白(ab216327)抗体 美国Abcam公司;其他常规试剂均为国产分析纯。
1.2 仪器与设备
Varioskan Flash多功能酶标仪、Modulyod-230冷冻干燥机 美国Thermo公司、DHP-500电热恒温培养箱北京市永光明医疗仪器有限公司;H1650R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;MIKRO 22R冷冻离心机 德国Hettich公司;UV-2550紫外分光光度计 日本岛津公司;Eclipse C1正置荧光显微镜日本尼康公司。
1.3 方法
1.3.1 茶样干粉制备
取适量‘平阳黄汤’茶样,按照茶水比1∶10在沸水浴中浸提20 min,直接过滤,冷却后于-20 ℃冰箱中预冻12 h后真空冷冻干燥48 h。收集茶粉,密封包装,-20 ℃备用。
1.3.2 ‘平阳黄汤’感官评价和理化成分测定
参照GB/T 23776—2018《茶叶感官审评方法》对茶样进行感官审评,对茶叶的外形、汤色、香气和滋味等感官品质进行特征描述;水浸出物质量分数按GB/T 8305—2002《茶 水浸出物测定》测定;茶多酚质量分数按GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》测定;游离氨基酸质量分数按GB/T 8314—2013《茶 游离氨基酸总量的测定》测定;可溶性糖质量分数按蒽酮-硫酸比色法测定。
1.3.3 动物实验设计
所有动物实验方案经湖南农业大学动物实验中心批准并符合动物伦理规范。将40 只SPF级SD大鼠在(25±2)℃条件下适应性饲养1 周后,称体质量,随机分为5 组:正常饮食(ND)组、高脂模型(HFD)组、‘平阳黄汤’低剂量(HFD-L)组、‘平阳黄汤’中剂量(HFD-M)组、‘平阳黄汤’高剂量(HFD-H)组,每组8 只。参照实验室前期研究[9],将制备所得茶粉按高、中、低剂量分别为300、150、75 mg/kgmb进行灌胃处理。大鼠在笼内自由饮水进食,每日固定时间对ND组大鼠灌胃超纯水,饲喂正常饲料;HFD组灌胃超纯水,饲喂高脂饲料;‘平阳黄汤’组灌胃用超纯水溶解相应剂量的‘平阳黄汤’水提物,饲喂高脂饲料,每周称体质量,并记录体质量和摄食量,建立肥胖预防模型。
‘平阳黄汤’持续灌胃8 周后,将待取样的大鼠放置于干净、铺有无菌滤纸的笼内,待其排便后立即收集粪便样本,置于无菌EP管内,-80 ℃冰箱保存用于后续的微生物分析。取样完毕后大鼠禁食12 h,每只大鼠注射1%戊巴比妥钠麻醉,主动脉取血。收集各组大鼠脂肪、肝脏和肠道,-80 ℃保存,备用。
1.3.4 大鼠身体指标和进食量测定
大鼠体质量每周称量1 次,另外每日给各组大鼠添加新鲜饲料,并于第2天同一时间称取剩余饲料量,计算每日摄食量,并按式(1)计算能量转化率。

用4 ℃生理盐水冲洗大鼠附睾脂肪和肾周脂肪表面血渍,滤纸吸干表面水分后称质量,按公式(2)计算脂肪指数。

1.3.5 血清生化指标测定
主动脉取血于EP管中,在4 ℃下3 500 r/min离心10 min,收集上层血清,放置于-80 ℃冰箱中保存。按照试剂盒说明书测定血清中TG、TC、GSH、LEP、ADP、TNF-α、IL-6水平以及SOD、CAT、LPS的活力。
1.3.6 大鼠肝脏TG和TC水平测定
准确称取肝脏组织质量,加入9 倍体积的无水乙醇于冰水浴条件下机械研磨,3 000 r/min离心后取上清液测定肝脏匀浆TG和TC含量,结果以每克蛋白计。
1.3.7 大鼠肝脏和结肠组织切片病理学观察
取大鼠肝脏和结肠的相同部位于4%多聚甲醛溶液中固定,然后对肝脏进行苏木精-伊红(hematoxylineosin,HE)和油红O染色,对结肠进行HE和过碘酸雪夫染色(periodic acid-Schiff,PAS)染色,显微镜下观察组织病理学变化并拍照[10]。
1.3.8 免疫荧光法检测结肠组织紧密连接蛋白的表达水平
将石蜡包埋的结肠组织切片脱蜡、水化,置于EDTA修复缓冲液中抗原修复,封闭内源性CAT,甩干磷酸盐缓冲液(phosphate buffered saline,PBS),胎牛血清封闭30 min,加入第1种一抗4 ℃孵育过夜,玻片于PBS中洗涤(5 min、3 次),加入对应的辣根过氧化物酶标记的二抗,室温孵育50 min,玻片于PBS中洗涤(5 min、3 次),加CY3-TSA孵育10 min后,玻片于PBS中洗涤(5 min、3 次),进行微波处理除去已结合到组织上的一抗、二抗;然后加入第2种一抗于湿盒内4 ℃孵育过夜,玻片于PBS中洗涤(5 min、3 次),甩干后在圈内滴加与一抗相应种属的荧光二抗覆盖组织,避光室温孵育50 min,4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)复染细胞核,自发荧光猝灭,封片,同一背景视野下镜检拍照。用Image-pro Plus 6.0软件测定阳性区域的平均积分光密度(integral optical density,IOD)。
1.3.9 粪便微生物菌群分析
将收集的大鼠粪便进行液氮处理后,采用十二烷基硫酸钠方法对样本的基因组DNA进行提取,并检测其浓度和纯度,然后使用稀释后的基因组DNA为模板,以细菌正向引物(341F:CCTACGGGNGGCWGCAG)和反向引物(805R:GACTACHVGGGTATCTAATCC)对细菌16S rRNA基因V3~V4区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,扩增产物经2%琼脂糖凝胶进行电泳检测,然后使用Illumina平台测序(天根生化科技(北京)有限公司),所得序列使用Uclust v1.2.22软件进行聚类得到操作分类单元(operational taxonomic units,OTU)[11]。在菌群OTU水平上计算Shannon指数和Simpson指数评估菌群多样性,同时对物种丰度进行偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)及分类注释。
1.4 数据处理与分析
采用SPSS 22统计软件对数据进行分析处理,结果以平均值±标准差表示;采用方差分析和最小显著性差异法检验进行差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 ‘平阳黄汤’感官评价和理化成分分析结果
本实验所选用‘平阳黄汤’样品色泽黄褐较润,有清香,汤色浅黄、明亮,滋味醇爽,叶底黄亮;其水浸出物、茶多酚、游离氨基酸和可溶性糖质量分数分别为42.29%、19.40%、5.27%和9.44%,基本符合黄茶的主要品质化学特征[12]。
2.2 ‘平阳黄汤’对高脂饮食大鼠体质量、进食量和脂肪质量的影响
由图1A、B可知,大鼠经过8 周饲养后,HFD组大鼠体质量及其增长量极显著高于ND组大鼠(P<0.01),表明长期高脂饮食易使体质量增加;与HFD组相比,‘平阳黄汤’干预后,HFD-L、HFD-M和HFD-H组大鼠体质量增长量均极显著降低(P<0.01),其中HFD-M组与ND组接近,HFD-H组甚至低于ND组。
由图1C、D可知,‘平阳黄汤’水提物对高脂饮食大鼠的日常食物摄入量和能量转化率均有不同程度的抑制作用,随着剂量的增加,其抑制作用增强。HFD-M和HFD-H组的日摄食量极显著低于HFD组(P<0.01)。
高脂饮食引起的肥胖往往伴随脂肪组织的堆积,为此研究‘平阳黄汤’对高脂饮食大鼠脂肪组织的影响。由图1E~H可知,与ND组相比,HFD组大鼠附睾、肾周脂肪的质量及脂肪指数均极显著升高(P<0.01);与HFD组相比,‘平阳黄汤’水提物干预后,高脂饮食大鼠脂肪质量和脂肪系数均出现不同程度的下降,其中HFD-L、HFD-M和HFD-H组附睾和肾周脂肪质量以及HFD-H组附睾和肾周脂肪指数均极显著降低(P<0.01)。
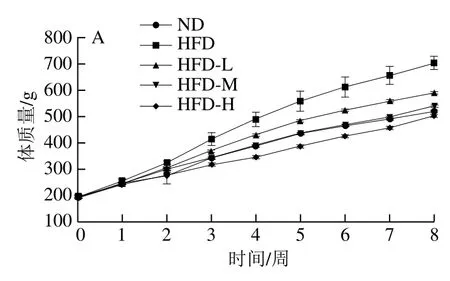
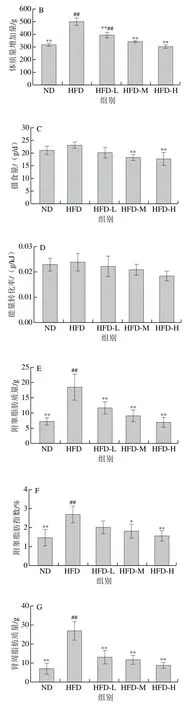
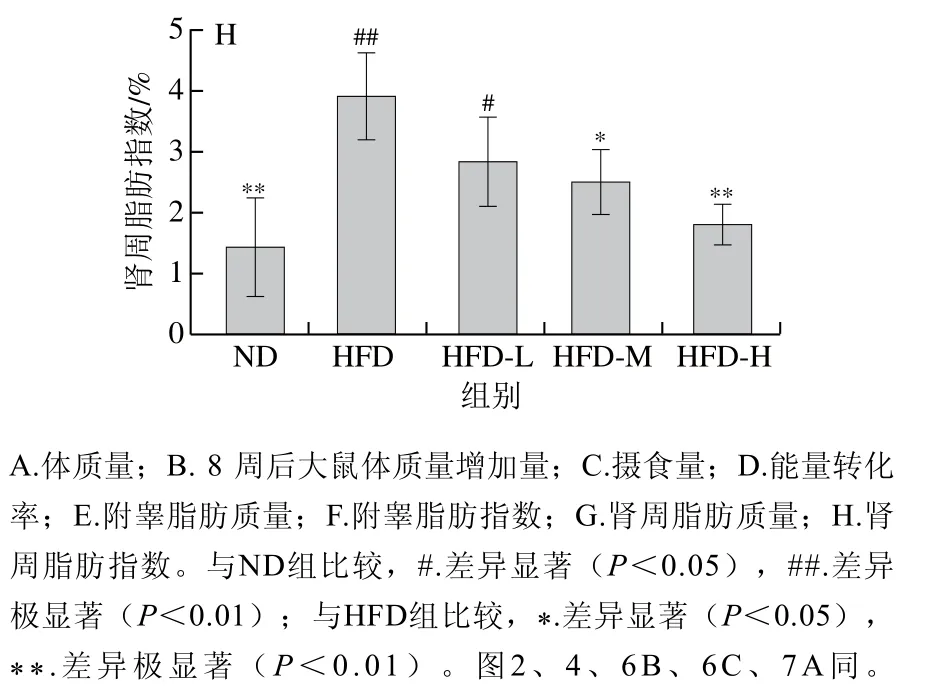
图1 ‘平阳黄汤’对高脂饮食大鼠体质量、摄食量和脂肪组织的影响Fig. 1 Effect of Pingyang yellow tea on body weights, food intake and adipose tissues in rats
2.3 ‘平阳黄汤’对高脂饮食大鼠血脂和肝脏脂质的影响
由图2可知,与ND组相比,HFD组大鼠血清和肝脏TG、TC水平均极显著升高(P<0.01);与HFD组相比,‘平阳黄汤’干预后,大鼠血清和肝脏TG、TC水平出现不同程度下降,其中HFD-H组大鼠血脂和肝脏脂质指标均极显著下降(P<0.01)。说明‘平阳黄汤’能有效调控高脂饮食引起的血脂水平紊乱和肝脏脂肪积累。
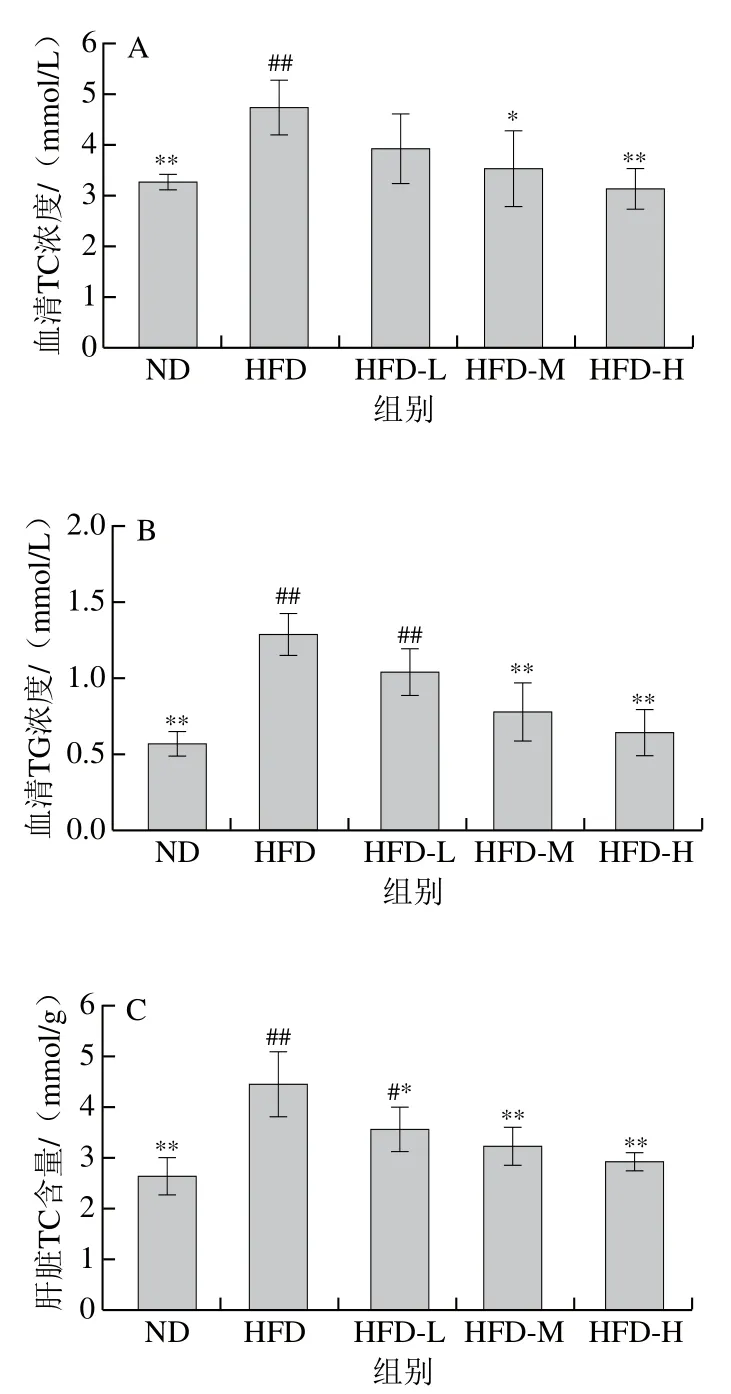

图2 ‘平阳黄汤’对高脂饮食大鼠血脂和肝脏脂质的影响Fig. 2 Effect of Pingyang yellow tea on serum and liver lipids in HFD-fed rats
2.4 ‘平阳黄汤’对高脂饮食大鼠肝脏组织形态结构的影响
如图3所示,与ND组相比,HFD组大鼠肝脏细胞排列紊乱,胞质空泡化,炎性细胞浸润;肝脏内有大量脂质聚集。与HFD组相比,‘平阳黄汤’干预后,大鼠肝脏脂滴明显减少,肝细胞脂肪变性程度和炎症减弱,细胞排列较整齐,其中HFD-H组肝细胞排列整齐,没有炎症细胞浸润,胞浆均匀。说明‘平阳黄汤’能有效调控高脂饮食引起的肝脏病变和脂质代谢紊乱。

图3 各组大鼠肝脏HE和油红O染色切片(×100)Fig. 3 HE-stained and oil red-stained sections of rat liver tissues from each treatment group (× 100)
2.5 ‘平阳黄汤’对高脂饮食大鼠血清脂肪因子、炎症因子和氧化应激水平的影响
由图4A、B可知,与ND组相比,HFD组大鼠血清LEP和ADP质量浓度均极显著升高(P<0.01);与HFD组相比,‘平阳黄汤’干预后大鼠血清LEP质量浓度有不同程度的下降,其中HFD-L和HFD-M组LEP质量浓度有下降趋势,但无显著性变化(P>0.05),HFD-H组LEP质量浓度极显著下降(P<0.01);与HFD组相比,‘平阳黄汤’各干预组ADP质量浓度均极显著下降(P<0.01),且与ND组接近。这表明‘平阳黄汤’能有效缓解高脂饮食引起的血清脂肪因子水平升高。
由图4C~H可知,与ND组相比,HFD组大鼠血清TNF-α、IL-6和LPS水平均极显著升高(P<0.01),血清SOD、CAT和GSH水平极显著降低(P<0.01),这表明高脂饮食易诱发大鼠全身性炎症和氧化应激。与HFD组相比,‘平阳黄汤’干预后,大鼠血清TNF-α、IL-6和LPS水平呈不同程度的下降,其中HFD-M和HFD-H组的血清TNF-α、IL-6和LPS水平极显著下降(P<0.01)。与HFD组相比,‘平阳黄汤’干预后,大鼠血清SOD、CAT和GSH水平呈不同程度的升高,其中HFD-H组极显著升高(P<0.01)。这表明‘平阳黄汤’水提物能有效缓解高脂饮食诱发的全身性炎症和氧化应激。


图4 ‘平阳黄汤’对高脂饮食大鼠血清脂肪因子、炎症因子和氧化应激水平的影响Fig. 4 Effect of Pingyang yellow tea on serum adipocytokines,inflammatory cytokines and oxidative stress levels in rats
2.6 ‘平阳黄汤’对高脂饮食大鼠结肠形态结构的影响
如图5所示,与ND组相比,HFD组大鼠肠道细胞排列紊乱,绒毛破裂且存在大量炎性细胞浸润;与HFD组相比,‘平阳黄汤’干预组大鼠结肠形态得到不同程度的改善,其中HFD-L组细胞排列较整齐,绒毛脱落减少,绒毛完整性高,基本没有炎症细胞浸润。大鼠肠道PAS染色切片显示,与ND组相比,HFD组肠道杯状细胞明显减少且分布不均;与HFD组相比,‘平阳黄汤’干预组结肠杯状细胞数量均有不同程度的恢复,其中HFD-H组恢复效果明显。这表明‘平阳黄汤’能有效改善高脂饮食大鼠的肠道形态结构。
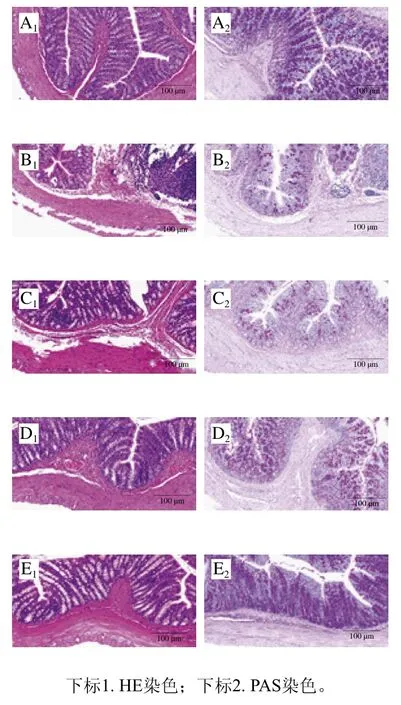
图5 大鼠结肠组织HE和PAS染色切片(×100)Fig. 5 HE-stained and PAS-stained sections of colon tissues from rats (× 100)
2.7 ‘平阳黄汤’对高脂饮食大鼠结肠组织肠道屏障的影响
肠道紧密连接蛋白主要位于肠道上皮细胞,是维持肠道完整性的重要部分。由图6可知,与ND组相比,HFD组大鼠ZO-1和闭锁蛋白的表达均极显著下降(P<0.01);与HFD组相比,‘平阳黄汤’干预后,3 组高脂饮食大鼠ZO-1蛋白表达水平均极显著增加(P<0.01),HFD-M和HFD-H组大鼠闭锁蛋白表达极显著增加(P<0.01)。这表明‘平阳黄汤’能有效修复高脂饮食引起的肠道屏障损伤。

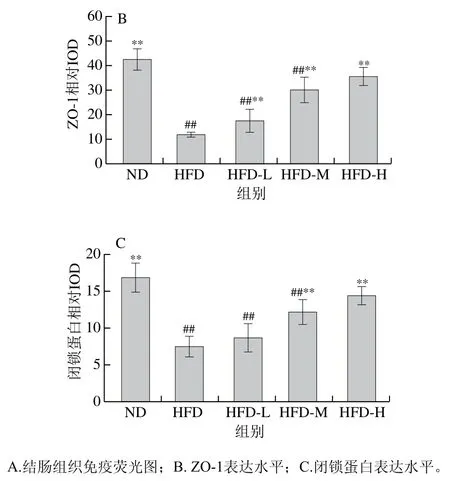
图6 ‘平阳黄汤’对大鼠紧密连接蛋白表达的影响Fig. 6 Effect of Pingyang yellow tea on the expression of tight junction proteins
2.8 ‘平阳黄汤’对高脂饮食大鼠肠道菌群的影响
2.8.1 ‘平阳黄汤’对高脂饮食大鼠肠道微生物菌群结构的影响
大鼠粪便微生物基因组16S rDNA的V3~V4区进行PCR扩增后测序。如图7A、B所示,与ND组相比,HFD组大鼠Shannon指数显著下降(P<0.05),Simpson指数下降但无显著性变化(P>0.05);与HFD组相比,‘平阳黄汤’干预组Shannon指数和Simpson指数都有不同程度改善,但改善效果不显著(P>0.05)。
对大鼠肠道微生物门水平的物种丰度进行PLS-DA分析,结果图7C所示,ND组与HFD组离散程度较大但显著分离,‘平阳黄汤’各干预组与HFD组分离趋势较明显。门水平的分类学结果(图7D、E)表明,大鼠肠道菌群的优势菌门为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)。与ND组相比,HFD组的厚壁菌门相对丰度降低;与HFD组相比,‘平阳黄汤’干预后,HFD-L、HFD-M和HFD-H组厚壁菌门相对丰度降低,拟杆菌门相对丰度升高。此外,与ND组相比,HFD组F/B比值(厚壁菌门/拟杆菌门相对丰度比值)增加(P>0.05);与HFD组相比,HFD-M和HFD-H组F/B比值下降(P>0.05)。如图7F所示,阿克曼菌属(Akkermansia)、Blautia、颤螺菌属(Oscillospira)、拟杆菌属(Bacteroides)、梭菌属(Clostridium)、瘤胃球菌属(Ruminococcus)、多尔氏菌属(Dorea)为大鼠肠道微生物属水平的优势菌属。以上结果表明‘平阳黄汤’可以改善肥胖导致的肠道菌群变化,有效调节组间肠道菌群的变化,这与线性判别分析(linear discriminant analysis,LDA)所示的肠道菌群优势菌得分结果趋势(图7G)一致。
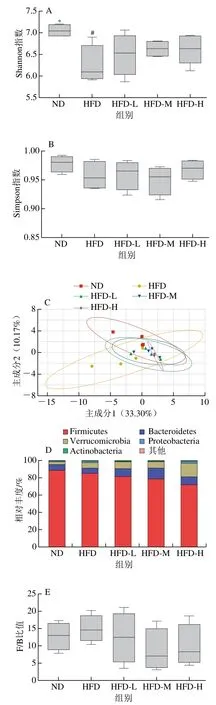
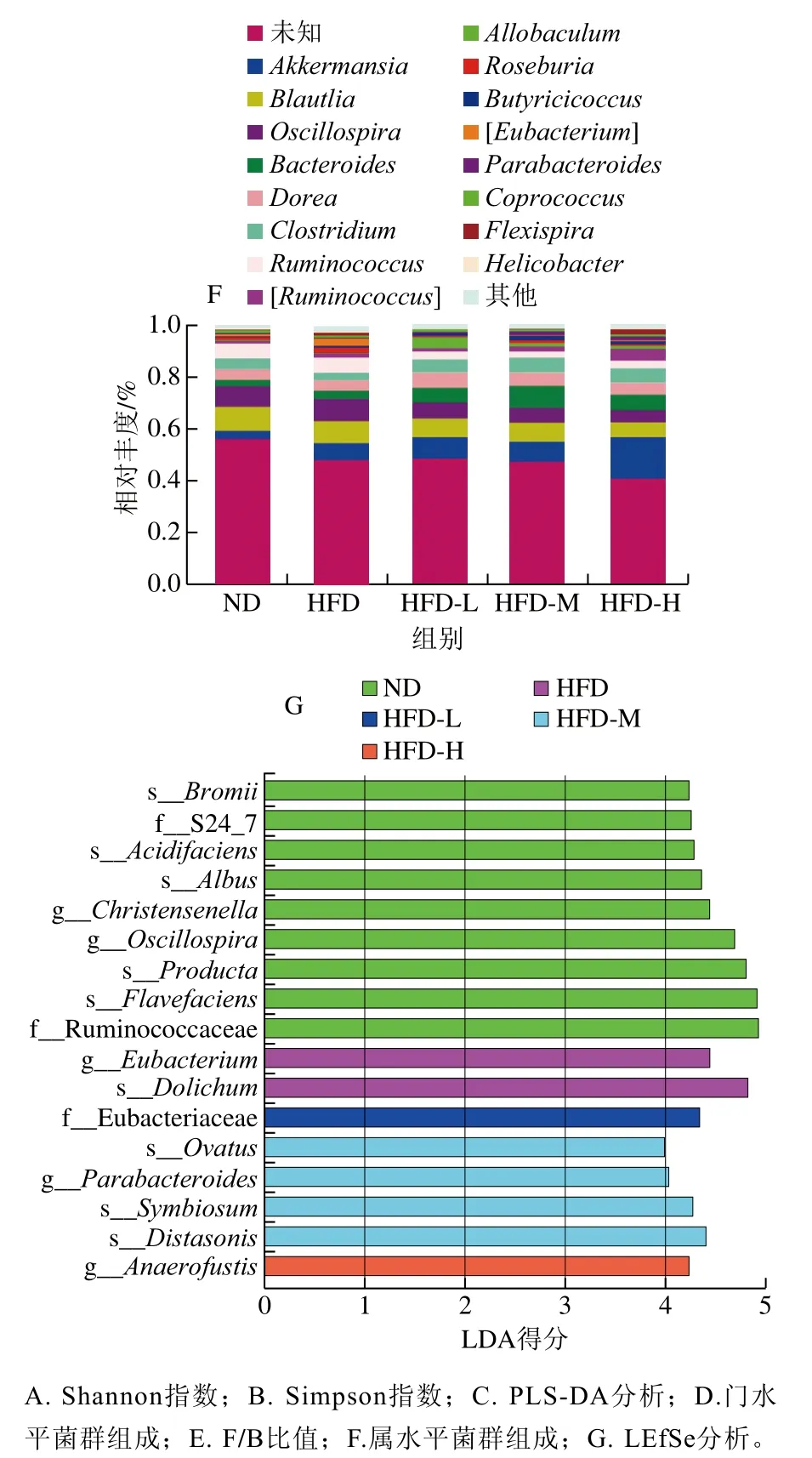
图7 ‘平阳黄汤’对高脂饮食大鼠肠道微生物的影响Fig. 7 Effect of Pingyang yellow tea on intestinal microbiome in rats
2.8.2 大鼠肠道中特定微生物变化与机体指标的相关性
为进一步分析高脂饮食和‘平阳黄汤’对大鼠肠道菌群的影响,选取相对丰度排名前85的OTU,分析‘平阳黄汤’干预后高脂饮食大鼠肠道菌群OTU的变化。结合图8A和表1可知,OTU0009、OTU0004、OTU0003和OTU0005的相对丰度变化表明,‘平阳黄汤’能有效逆转高脂饮食引起的肠道菌群变化。与肠道屏障功能相关的部分肠道微生物与机体指标的Spearman相关性分析结果(图8B)表明,梭菌属相对丰度与体质量、附睾脂肪质量、血清TG浓度、血清TC浓度和血清IL-6浓度呈显著负相关(P<0.05);F/B比值与体质量、附睾脂肪质量、肾周脂肪质量、血清TG和TNF-α水平呈正相关(P>0.05);阿克曼菌属相对丰度与体质量、血清TG浓度、TC浓度、血清TNF-α和IL-6质量浓度呈负相关;毛螺旋菌科(Lachnospiraceae)相对丰度与体质量、附睾脂肪质量、血清TC浓度、血清LPS水平和IL-6质量浓度呈负相关(P>0.05)。

表1 各组大鼠肠道微生物中相对丰度排名前85的OTU对应的细菌分类学信息Table 1 Taxonomic information of top 85 most abundant bacterial OTUs in rat gut microbiota
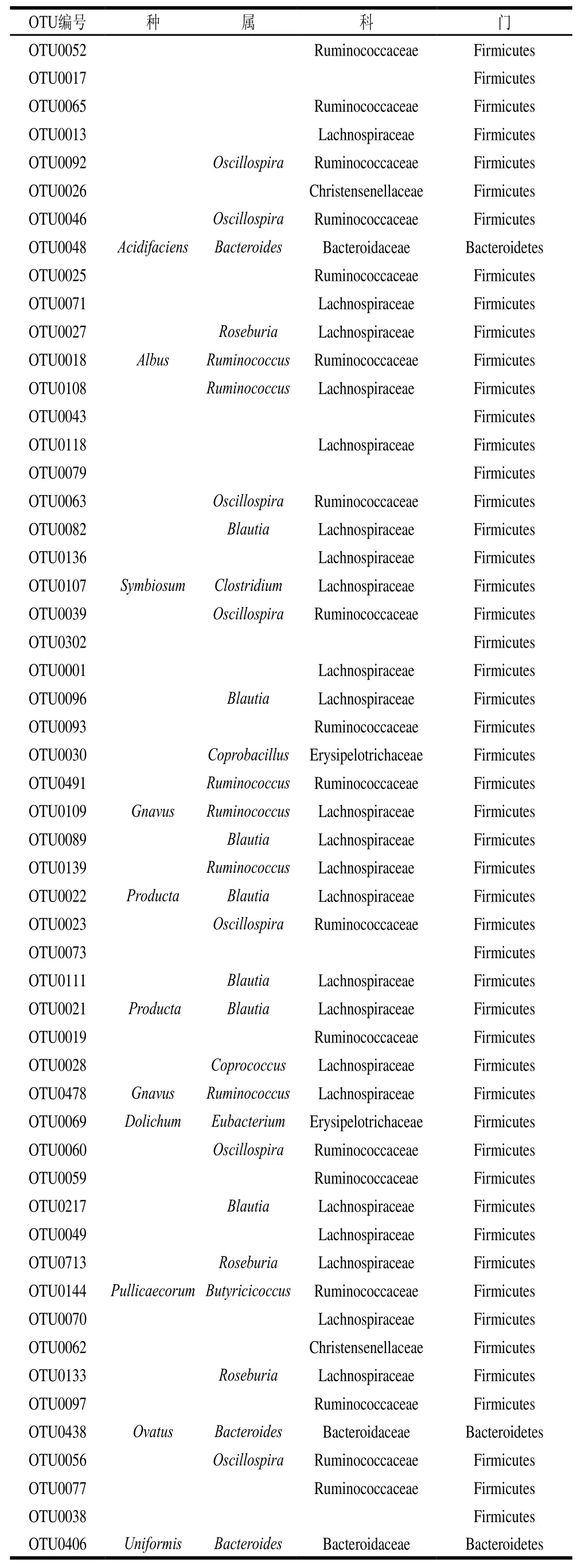
续表1


图8 大鼠肠道微生物相对丰度及与机体指标的相关性Fig. 8 Changes of intestinal microorganisms in rats and correlation with body indexes
3 讨 论
世界范围内肥胖发病率越来越高,肥胖已成为全球性的健康问题[13]。肥胖一旦形成就很难控制,然而目前市场上常用的减肥药物和节食措施副作用较大,因此寻求健康有效的植物资源用于防治肥胖是当前的研究热点[14]。大量动物实验及研究表明,多种黄茶能显著抑制高脂饮食诱导的脂肪沉积和体质量增加,有效调控高脂饮食诱导的肥胖。然而,目前鲜有研究证实‘平阳黄汤’对高脂饮食大鼠的预防肥胖作用。
高脂饮食诱导肥胖形成的过程中往往伴随着体内能量代谢失衡和脂质代谢紊乱[15]。本研究发现,‘平阳黄汤’能显著抑制高脂饮食大鼠的体质量增长和白色脂肪(附睾脂肪和肾周脂肪)增加,降低脂肪指数和能量转化率,改善血脂和血清脂肪因子水平,降低血清炎症和氧化应激因子水平,减少肝脏的脂质堆积和损伤。这些结果表明‘平阳黄汤’能有效改善高脂饮食诱导的肥胖形成和代谢紊乱。
肠道屏障是指肠道上皮能够防止肠腔内的有害物质穿过肠黏膜进入人体其他部位的结构和功能的总和[16]。肠道屏障完整性的破坏与代谢紊乱密切相关,其中由于肠道屏障完整性受损而引起的代谢性内毒素血症被认为是导致胰岛素抵抗和肥胖的主要原因。肠道上皮层受损会降低肠道的紧密连接性,增加肠道通透性,致使肠道内革兰阴性杆菌产生的LPS通过肠道上皮进入血液进行全身循环,LPS与Toll样受体结合后导致促炎细胞因子的表达增加,引发机体全身炎症,最终导致肥胖的发生[17-18]。因此,维持肠道屏障的完整性和紧密性是预防肥胖的重要方向。肠道组织病理切片显示,‘平阳黄汤’可有效调节高脂饮食大鼠肠道黏膜形态,改善肠道炎症和黏膜完整性。肠道紧密连接主要由跨膜蛋白、连接复合蛋白和肌动蛋白构成,其中ZO-1和闭锁蛋白是紧密连接蛋白中的重要蛋白,可作为肠道物理屏障的标志物[19-20]。免疫荧光分析结果表明,‘平阳黄汤’可显著恢复高脂饮食大鼠的ZO-1和闭锁蛋白表达,增强肠道的紧密连接和物理屏障功能。同时,‘平阳黄汤’可有效缓解高脂饮食诱导的肠道杯状细胞数量减少。杯状细胞分泌的黏蛋白可以在肠黏膜上形成一层致密和渗透性强的黏液,构成肠道化学屏障,防止微生物和有毒物质的侵入[21]。此外,‘平阳黄汤’干预后,大鼠血清中LPS、TNF-α和IL-6水平显著降低,表明‘平阳黄汤’能有效减少肠道内LPS溢出,抑制代谢性内毒性和系统性炎症,这可能是由于黄茶中的儿茶素物质有效改善了肠道炎症和肠道屏障,抑制全身系统性炎症的进一步发展[3]。以上结果表明,‘平阳黄汤’可以通过增加杯状细胞的数量,提高紧密连接蛋白的表达,维护肠道屏障的完整性,有效预防高脂饮食引起的代谢性内毒素和系统性炎症。
肠道菌群一直被认为与肥胖密切相关[22-23]。无菌动物和微生物移植实验表明肠道菌群是肥胖和肥胖相关代谢紊乱形成和发展的重要起因[24]。本实验探究了‘平阳黄汤’在预防高脂饮食大鼠肥胖过程中对肠道菌群的影响。通常肥胖的形成往往伴随着肠道菌群多样性的改变[25]。基于多样性指数和PLS-DA分析表明,高脂饮食大鼠肠道微生物的多样性与ND组相比显著下降,‘平阳黄汤’干预后其肠道微生物群落多样性得到有效改善,群落组成改变,说明肠道菌群的组成与肥胖的形成密切相关。在门水平上,高脂饮食诱导微生物厚壁菌门相对丰度增加,拟杆菌门相对丰度下降,导致F/B比值升高,中、高剂量的‘平阳黄汤’可以有效降低F/B比值,从而缓解F/B比例升高导致的能量吸收增加[26]。
LDA得分和属水平分类学的分析结果表明,‘平阳黄汤’能促进与肥胖预防相关有益菌的增殖,抑制有害菌的生长。阿克曼菌属作为一种降解黏蛋白的细菌,可有效增强脂肪组织代谢和肠黏膜屏障作用,缓解代谢性内毒素血症,改善高脂饮食引起的肥胖[27]。本实验中,‘平阳黄汤’能明显提高高脂饮食大鼠肠道阿克曼菌属相对丰度,相关性分析结果显示阿克曼菌属相对丰度与体质量、血清TC浓度、血清TNF-α和IL-6质量浓度呈负相关。拟杆菌属相对丰度在‘平阳黄汤’干预后明显上升,其可以将肠道内未消化的碳水化合物发酵产生短链脂肪酸,从而给肠上皮细胞提供能量,调节肠道菌群,这可能跟黄茶中茶多糖的调节作用有关[28-30]。梭菌属作为厚壁菌门中非常重要的一类菌,是导致机体能量摄入过度的主要原因,而本研究结果表明‘平阳黄汤’干预后其相对丰度提高,相关性分析结果显示其与血清中的炎症因子水平呈负相关,这可能与梭菌属能促进肠道中LPS的吸收有关[31]。这些结果表明‘平阳黄汤’能有效调节高脂饮食大鼠的肠道菌群紊乱。
综上所述,研究表明‘平阳黄汤’可以显著降低高脂饮食大鼠的脂肪累积和血脂水平,改善肝组织脂肪性损伤,有效缓解全身慢性炎症和氧化应激水平,提高肠道紧密连接蛋白的表达,增强肠道屏障作用,调节肠道菌群紊乱,促进与肥胖预防相关有益菌的增殖,抑制有害菌的生长,从而有效预防肥胖。
