EGCG通过激活AMPK、抑制PPARγ调控3T3-L1脂肪细胞中脂滴蓄积
2022-01-06管巧丽吴晓云
管巧丽,吴晓云,李 芳,*,盛 军
(1.云南农业大学 普洱茶学教育部重点实验室,云南 昆明 650201;2.云南农业大学食品科学技术学院,云南 昆明 650201;3.云南农业大学理学院,云南 昆明 650201)
肥胖是近年来世界范围内的主要健康问题之一,通常是由于食物摄入与能量消耗不平衡,脂肪细胞肥大和增生而导致的脂肪量过多和脂肪组织扩张[1]。早在2013年肥胖被美国医学协会(American Medical Association)认定为一种疾病之前,肥胖的发生率一直在稳步增长[2]。截至2016年的全球统计数据显示,13%(6.5亿)的成年人肥胖,19亿人超重,据估计,2025年全球60%的死亡将由肥胖相关疾病引起[3]。在遗传易感性个体中,高热量饮食和缺乏体力活动等环境因素可能会引发肥胖。作为一种慢性疾病,抗肥胖治疗依赖于生活方式的改变、手术和药物治疗[4-6]。相对于使用手术和药物减轻体质量,运动或者通过饮食干预更容易被人们接受。
茶是一种被人们广泛接受的饮料。绿茶已被证明具有许多潜在的健康益处[7],包括抗氧化、抗癌和保护心脏活性,并可能影响能量平衡的多个方面[8-9],绿茶对健康的好处主要是由于其高浓度的多酚,这些多酚统称为儿茶素。绿茶多酚被广泛报道可以改善人类和动物模型的肥胖和代谢综合征[10-11]。有研究表明绿茶提取物和表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)可显著提高脂质活性并降低脂肪组织质量[12-13]。在探究绿茶多酚对减轻体质量作用的研究中,报道了几种多酚可以刺激腺苷一磷酸(adenosine monophosphate,AMP)活化蛋白激酶(AMP-activated protein kinase,AMPK)的活性[14-16]。激活AMPK会降低糖异生和脂肪酸合成,增加分解代谢[17-19],有研究者提出“AMPK假说”,AMPK在介导EGCG对脂肪酸合成和分解代谢的作用中起重要作用[6]。他们提出了EGCG促进减轻体质量的两个主要机制:1)减少肠道内脂质和蛋白质的吸收,从而减少热量摄入;2)AMPK在肝脏、骨骼肌和白色脂肪组织中的激活。激活AMPK途径可能为肥胖、胰岛素抵抗、内分泌和心血管疾病的治疗提供新的靶点[20]。Moreno等在EGCG影响高脂饮食诱导肥胖模型的研究中发现,EGCG可以降低小鼠肥胖和附睾白色脂肪组织质量,并且部分是通过激活AMPK实现的[21]。也有文献指出EGCG可以抑制脂肪细胞的分化[6],但EGCG减轻体质量和脂肪组织质量的具体机制不清楚,也鲜有文献报道EGCG改善细胞中脂滴蓄积的具体机制。因此,本研究以EGCG为实验原料,通过体外诱导分化培养3T3-L1前脂肪细胞,研究EGCG对3T3-L1脂肪细胞中脂滴蓄积的影响,为改善肥胖症的分子机制提供理论参考。
1 材料与方法
1.1 材料与试剂
3T3-L1前脂肪细胞 中国科学院昆明动物研究所;EGCG(纯度大于98%) 成都生物净化植物化工有限公司;Dublecco改良Eagle培养基(Dulbecco’s modified Eagle medium,DMEM)和高糖培养基 美国HyClone公司;二喹啉甲酸(bicinchoninic acid,BCA)试剂盒上海碧云天生物技术有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Amresco公司;质量分数30%聚丙烯酰胺贮液 中国Bio-RAD公司;0.5 mol/L Tris-HCl 缓冲液(pH 6.8)、1.5 mol/L Tris-HCl缓冲液(pH 6.8)、四甲基乙二胺、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methyl-7H-xanthine,IBMX) 美国Sigma公司;噻唑蓝(thiazolyl blue tetrazolium bromide,MTT) 博美生物有限公司;抗兔免疫球蛋白、抗鼠免疫球蛋白 美国R&D公司;无水乙醇、油红O 天津市风船化学试剂科技有限公司;异丙醇 四川西陇化工有限公司;TransZol Up 北京全式金生物技术有限公司;三氯甲烷(氯仿) 重庆川东化工集团有限公司;质量分数4%多聚甲醛济南百博生物技术有限公司;马来酸罗格列酮中国盖德化工厂;胰岛素 江苏万邦生物医药股份有限公司;PrimeScript RT reagent kit with gDNA试剂盒日本Takara公司;去污剂、裂解液、三羟甲基氨基甲烷、十二烷基硫酸钠、硫酸铵、甘氨酸、甘油、β-巯基乙醇、溴酚蓝、考马斯亮蓝G250、牛血清白蛋白、青链霉素混合液、10×磷酸盐缓冲液(phosphate-buffered saline,PBS,pH 7.4) 北京索莱宝生物科技有限公司;脱脂奶粉 美国BD公司。
1.2 仪器与设备
C150型CO2气体培养箱 德国Binder公司;DM-1L LED倒置显微镜 德国Leica公司;CKX41倒置荧光显微镜 日本Olympus公司;U-2910紫外分光光度计日本日立公司;7900HT型荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国应用生物系统公司;Z36HK型高速台式冷冻离心机 德国Hermle Labortechnik GmbH公司;VORTES QL-902型漩涡仪 海门市其林贝尔仪器制造有限公司;掌上离心机日本TOMY公司;DHG-9240A电热鼓风干燥箱 上海一恒科学仪器有限公司;FST-III-80纯水机 普力菲尔纯净水有限公司;96 孔板 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 3T3-L1前脂肪细胞的分化及EGCG处理细胞
细胞复苏:取冻存的3T3-L1前脂肪细胞,将其置于37 ℃流水下快速融化,融化后加入含体积分数10%胎牛血清、体积分数1%青链霉素的DMEM高糖培养基10 mL,混匀后离心(1500 r/min、3 min),吸弃离心后的上清液,加入10 mL含体积分数10%胎牛血清、体积分数1%青链霉素的DMEM高糖培养基吹打细胞并混匀,将含细胞的培养基转移至培养皿中,在37 ℃、5% CO2培养箱中培养。待细胞长满至80%~90%,融合4~5 d观察细胞状态稳定后,吸除培养皿中的培养液,加入37 ℃预热的PBS清洗细胞,吸除PBS,加入诱导培养基(含10%胎牛血清、1%青链霉素、10 μg/mL胰岛素、0.5 μmol/L 3-异丁基-1-甲基黄嘌呤、1 μmol/L罗格列酮、1 μmol/L地塞米松的DMEM高糖培养基)。培养3 d后再换胰岛素诱导培养基(含10%胎牛血清、1%双抗、10 μg/mL胰岛素的DMEM高糖培养基)培养3 d,最后换含有10%胎牛血清、1%青链霉素的高糖DMEM培养基培养2 d,诱导分化10 d左右,显微镜下观察3T3-L1细胞90%表现为成熟脂肪细胞表型(油红O染色鉴定),即可用于实验。EGCG处理细胞时使用pH 6.5的DMEM酸性培养基,作用质量浓度分别为25、50 μg/mL,以不含EGCG的培养基为对照组(即0 μg/mL的EGCG,后同),孵育时间分别为72 h和144 h。
1.3.2 细胞存活率测定
将处于对数生长期的3T3-L1细胞接种于96 孔板(2×104个/孔),加入含有体积分数10%胎牛血清、1%青链霉素的DMEM培养基(200 μL/孔),37 ℃孵育24 h后吸弃培养液,更换为含有不同质量浓度EGCG(0、25、50 μg/mL)的DMEM培养基(200 μL/孔),每组设置3个平行,在37 ℃、5% CO2培养箱中培养72 h后,每孔加20 μL 5 mg/mL MTT储备液,避光,继续孵育培养4 h,吸去孔内培养上清液,每孔加入150 μL DMSO,摇床上振荡10 min,使结晶物充分溶解。在酶标仪上设置492 nm波长,检测各孔光密度值并按下式计算细胞存活率。
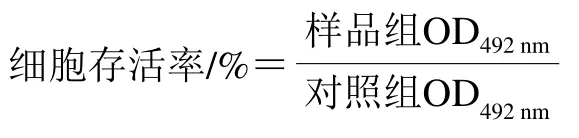
1.3.3 3T3-L1脂肪细胞的鉴定(油红O染色鉴定)和甘油三酯相对含量的测定
取1.3.1节不同质量浓度EGCG(0、25、50 μg/mL)处理144 h后的3T3-L1细胞培养板,PBS清洗两次;4%多聚甲醛(4 ℃冰箱存放)固定30 min后,使用PBS清洗两次;使用异丙醇配制0.5%油红O储液,再按油红O储液与蒸馏水体积比3∶2配制油红O工作液,混匀静置10 min;取500 μL油红O工作液覆盖培养板,染色10 min左右;PBS清洗一次,弃上清液;在倒置显微镜下调整物镜、目镜,在相同倍数下观察并拍照保存图片。
甘油三酯相对含量的测定:取1.3.1节不同质量浓度EGCG(0、25、50 μg/mL)处理72、144 h后的3T3-L1细胞,参考甘油三酯试剂盒说明书测定甘油三酯的相对含量。
1.3.4 AMPK抑制剂Dorsomorphin处理3T3-L1脂肪细胞的方法
按1.3.1节方法诱导3T3-L1脂肪细胞以及EGCG(0、50 μg/mL)处理,孵育3T3-L1细胞144 h:加入含有EGCG(50 μg/mL)和AMPK抑制剂Dorsomorphin(40 μmol/L)的DMEM培养基共同孵育3T3-L1细胞144 h,即Dorsomorphin抑制组;只含40 μmol/L Dorsomorphin的DMEM培养基孵育3T3-L1细胞144 h,即单独抑制剂组。
1.3.5 蛋白质免疫印迹法测定蛋白表达水平
取1.3.1节不同质量浓度EGCG(0、25、50 μg/mL)处理72、144 h后的3T3-L1细胞以及1.3.4节中Dorsomorphin抑制组和单独抑制剂组细胞,使用含体积分数1%苯甲基磺酰氟的裂解液提取总蛋白,采用BCA定量法测定蛋白质量浓度。在每孔加入蛋白溶液(含60 μg蛋白),用质量分数8%的十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳,然后转移至聚偏二氟乙烯膜,将膜用质量分数5%脱脂奶粉试剂封闭1 h,在4 ℃下与一抗Bax、cleaved-Caspase 3、β-actin、磷酸化-AMPK(phospho-AMPK,p-AMPK)、AMPK、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARγ)、Tubulin、PGC-1α(1∶1 000)孵育12 h以上,然后与4 μL相应的二抗(抗兔免疫球蛋白和抗鼠免疫球蛋白,1∶5 000)室温摇床孵育1 h。采用Western blotting图像用超灵敏增强型化学发光底物试剂盒成像,通过FluorChem E系统获得结果图像,使用AlphaView软件对相应的条带进行量化。
1.3.6 实时定量聚合酶链式反应测定基因表达水平
取1.3.1节不同质量浓度EGCG(0、25、50 μg/mL)处理72、144 h后的3T3-L1细胞,使用TRIzol提取总RNA,采用TaKaRa PrimeScript®RT reagent Kit With gDNA Eraser试剂盒进行反转录,采用SYBR Green I reaction system进行PCR,基因表达水平采用2-ΔΔCt法计算。引物序列见表1。

表1 实时定量PCR基因引物序列Table 1 Sequences of primers for real time quantitative polymerase chain reaction used in this study
1.4 数据处理与分析
实验数据采用SPSS 17.0软件和GraphPad Prism 6软件进行统计学分析,结果以平均值±标准差表示。采用单因素方差分析和最小显著差异(least significant difference,LSD)检验进行显著性分析,其中P<0.05表示差异显著,P<0.01表示差异极显著性,P<0.001为差异高度显著。
2 结果与分析
2.1 EGCG对3T3-L1脂肪细胞活性及脂代谢的影响
2.1.1 EGCG处理对3T3-L1脂肪细胞活性的影响
为了检测EGCG对3T3-L1前脂肪细胞的影响,使用EGCG不同质量浓度处理3T3-L1前脂肪细胞72 h,与对照组相比,细胞活性显著增强(图1A),然后对细胞凋亡相关的蛋白表达水平进行蛋白免疫印迹分析。结果显示,不同质量浓度的EGCG对细胞凋亡促进蛋白Bax的表达没有影响(图1B、C),而细胞凋亡过程中最主要的Cleaved-caspase 3的表达水平在使用50 μg/mL EGCG 处理72 h后显著降低(图1B)。以上研究结果表明,EGCG可能不会引起3T3-L1成熟脂肪细胞的凋亡。
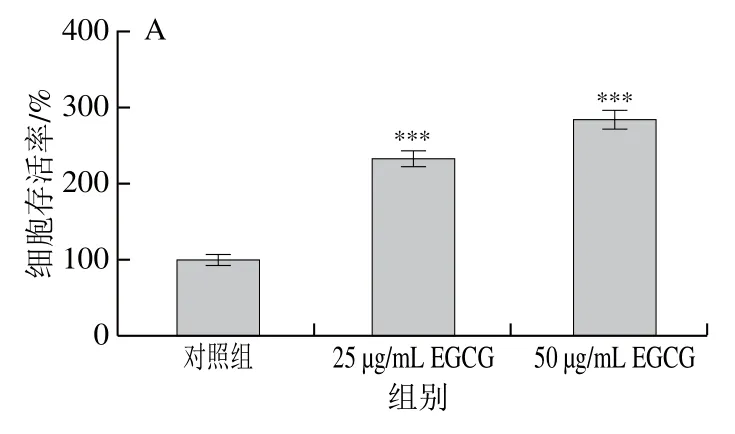

图1 EGCG处理对3T3-L1成熟脂肪细胞增殖、凋亡相关蛋白Bax、Cleaved-caspase 3表达水平的影响Fig. 1 Effect of EGCG treatment on cell viability and the expression of Bax and Cleaved-caspase 3 related to apoptosis in mature 3T3-L1 adipocytes
2.1.2 EGCG对成熟3T3-L1脂肪细胞脂滴蓄积的影响
脂肪细胞的数量和大小决定了人体的胖瘦程度。以脂滴体积增大为特征的脂肪细胞肥大已被证实是导致肥胖者脂肪组织扩张的主要机制。脂滴是一种分布广泛、进化高度保守的细胞器,由磷脂单分子层、中性脂核和大量脂滴相关蛋白组成[22-23]。因此在3T3-L1前脂肪细胞诱导分化成为成熟的脂肪细胞后,检测了EGCG对3T3-L1成熟脂肪细胞脂滴大小的影响。在EGCG处理时间相同的条件下,随着EGCG处理质量浓度的增加,3T3-L1成熟脂肪细胞脂滴数量以及大小减小,当EGCG处理质量浓度为50 μg/mL时,脂滴变小得最为明显(图2A)。而在EGCG处理质量浓度相同的条件下,随着处理时间的延长,3T3-L1成熟脂肪细胞脂滴数量以及大小也减小(结果未显示),当EGCG处理时间为144 h时,脂滴变小得最明显(图2A)。分析EGCG处理72、144 h后3T3-L1成熟脂肪细胞中的甘油三酯相对含量,可发现EGCG处理减少了脂肪细胞中甘油三酯的相对含量(图2B)。以上结果表明,EGCG的处理可以减小成熟3T3-L1脂肪细胞脂滴的大小并减少甘油三酯的相对含量。

图2 EGCG处理3T3-L1细胞油红O染色结果及甘油三酯相对含量的变化Fig. 2 Oil red O staining and relative content of total triglycerides in 3T3-L1 cells treated with EGCG
2.1.3 EGCG对成熟3T3-L1细胞脂代谢相关因子mRNA表达水平的影响
为了探讨EGCG降低3T3-L1成熟脂肪细胞脂滴大小的具体机制,对3T3-L1成熟脂肪细胞中脂代谢相关基因的mRNA表达水平进行了检测(图3)。EGCG分别处理3T3-L1成熟脂肪细胞72 h和144 h后发现,脂肪合成相关基因(acc1、srebp1c、fas、scd-1、pparγ、dgat1、elovl6)的mRNA水平的表达整体上显著下降(图3A、E)。参与脂肪酸转运的相关基因(mttp、cd36、fatp1、fatp4)的mRNA水平的表达显著下降(图3B、F);与脂滴形成相关的基因cgi 58的mRNA水平的表达显著下降(图3C、G);与脂肪分解相关的基因atglmRNA水平的表达显著下降(图3D、H)。EGCG处理质量浓度为50 μg/mL比25 μg/mL下各基因mRNA表达水平下降得更加明显,结果表明,EGCG抑制了脂肪合成、脂肪分解、脂肪吸收以及脂滴形成这些脂代谢相关基因的mRNA水平的表达,且50 μg/mL的EGCG处理抑制效果更加显著。结果表明EGCG处理使脂滴大小变小可能与EGCG抑制脂代谢相关基因的表达有关。
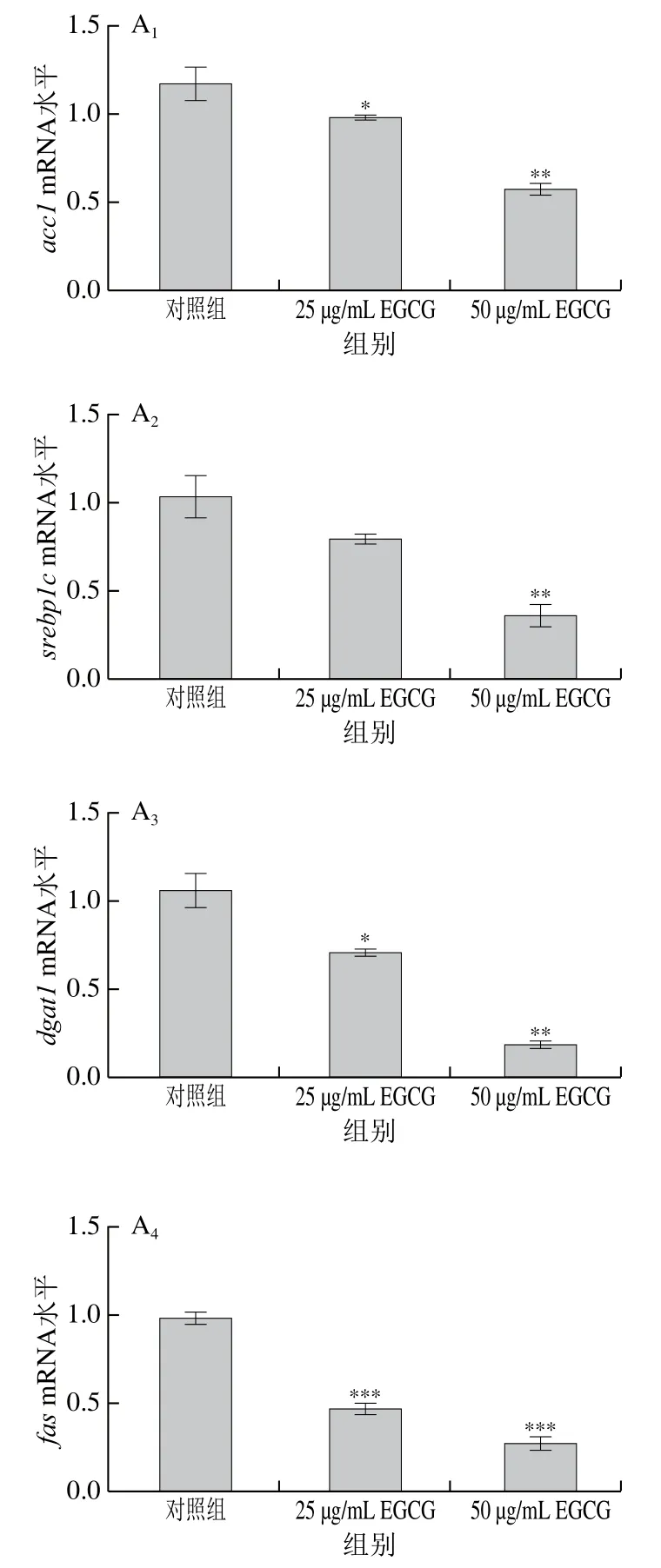
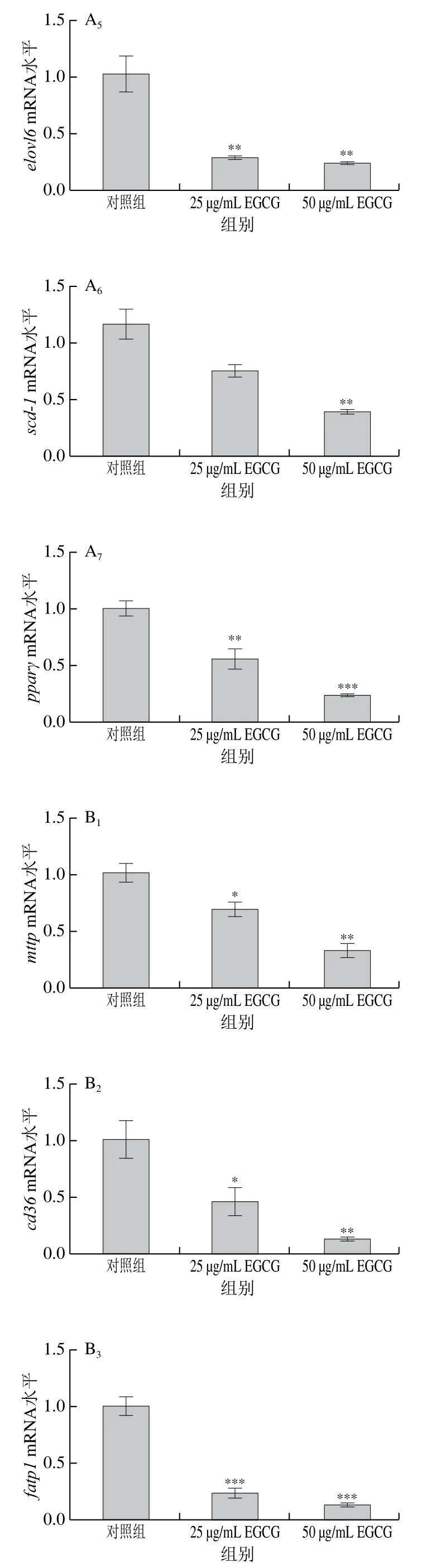

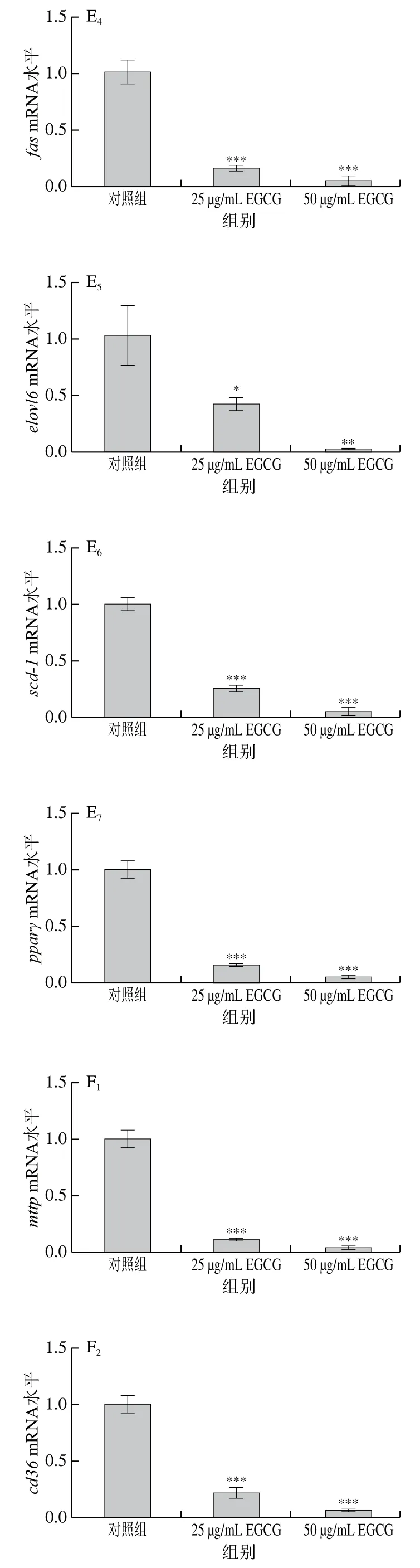
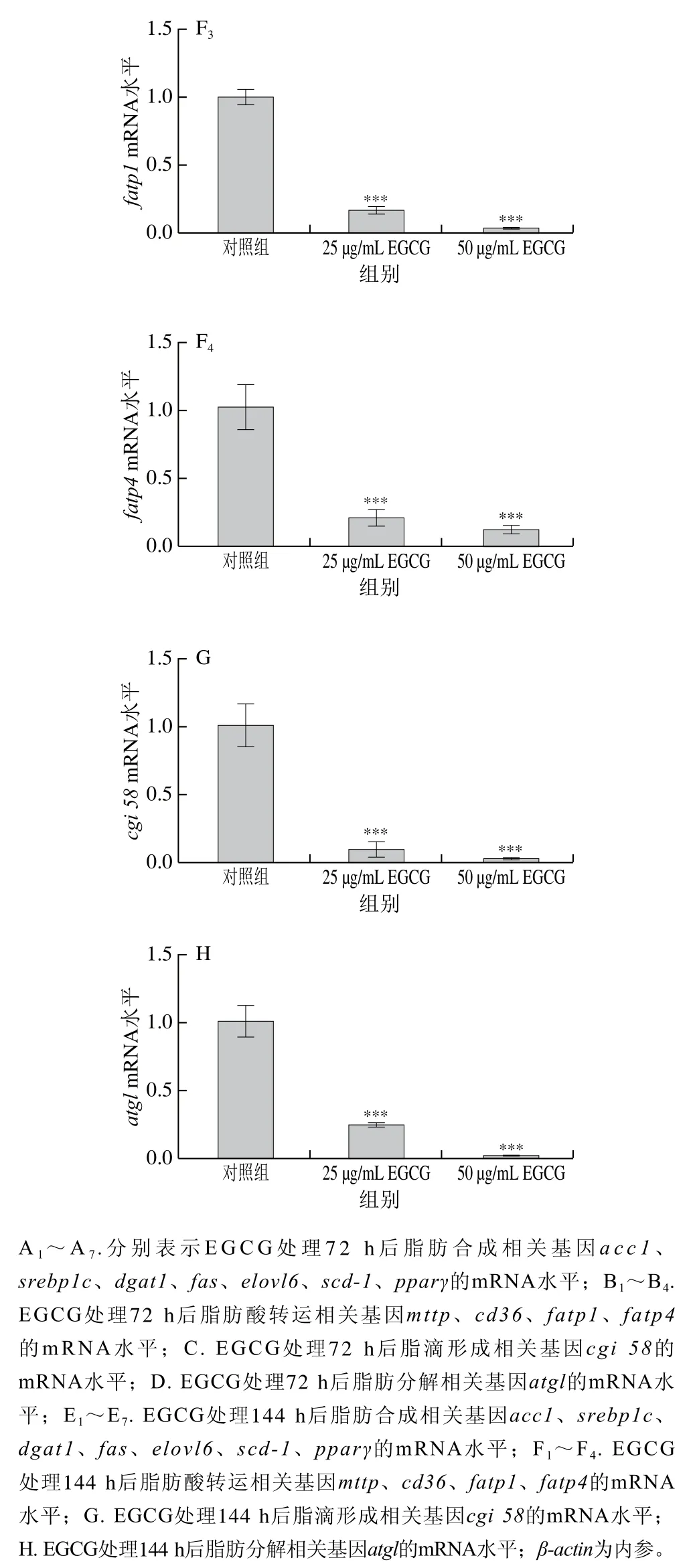
图3 EGCG对3T3-L1细胞脂代谢相关基因mRNA水平的影响Fig. 3 Effect of EGCG on mRNA expression levels of genes related to lipid metabolism in 3T3-L1 cells
2.2 EGCG通过激活AMPK抑制成熟3T3-L1脂肪细胞PPARγ的表达
EGCG可以抑制脂代谢相关基因的表达,但机制并不清楚。Yang等提出AMPK在介导EGCG对脂肪酸合成和分解代谢的作用中发挥主要作用[6]。因此,在使用EGCG处理3T3-L1成熟脂肪细胞144 h后通过免疫印迹法检测AMPK的蛋白表达,结果显示EGCG能显著激活AMPK的表达(图4A)。有文献报道,AMPK可以通过抑制PPARγ调控脂肪的合成及储存[6]。通过检测PPARγ和其辅活化因子PGC-1α的表达情况发现,EGCG能明显降低3T3-L1成熟脂肪细胞中PPARγ和PGC-1α的蛋白表达水平(图4A、B)。另外,PPARγ的蛋白表达水平也随着EGCG处理质量浓度的提高而显著下降(图4B)。这些研究结果表明,EGCG可能通过抑制PPARγ的表达来调控成熟脂肪细胞中脂滴蓄积。


图4 EGCG对3T3-L1细胞p-AMPK、AMPK、PPARγ蛋白表达水平的影响Fig. 4 Effect of EGCG on the expression levels of phospho-AMPK,AMPK and PPARγ in 3T3-L1 cells
为了验证EGCG是否通过激活AMPK来抑制PPARγ的表达,使用AMPK的抑制剂Dorsomorphin处理3T3-L1成熟脂肪细胞。Dorsomorphin处理3T3-L1成熟脂肪细胞后,显著抑制了p-AMPK的表达(图4A);而当EGCG和Dorsomorphin同时存在时,EGCG能显著增加p-AMPK的表达(图4A)。与对照组相比,Dorsomorphin处理以后,PPARγ的表达显著增加,而在Dorsomorphin存在下,加入EGCG可以使PPARγ的表达降低(图4A)。以上结果表明,EGCG可以使AMPK活化,并降低PPARγ的表达,且通过活化的AMPK来抑制PPARγ的表达。
3 讨 论
绿茶能够预防肥胖,并调节脂肪合成和脂肪氧化途径。绿茶和具有类似性质的分子可能成为寻找能量平衡和健康的新靶标[24]。茶叶都有降脂减肥作用,直到近几十年才发现是茶叶中单体成分EGCG起着重要的作用[25]。EGCG影响脂代谢的机制仍然是一个有趣的研究领域。本研究的目的是确定EGCG是否可以减少3T3-L1成熟脂肪细胞中的脂滴蓄积并探讨其机制。本实验通过体外实验,诱导分化培养3T3-L1前脂肪细胞,当EGCG处理质量浓度为50 μg/mL、处理时间为144 h时,与对照组相比,脂滴大小显著减小(图2A),甘油三酯相对含量降低(图2B)。而脂滴大小减小是否影响了其脂类代谢以及信号传导,本研究对脂类代谢相关因子的表达水平进行了检测。研究发现,EGCG处理降低了脂肪合成相关基因的表达,包括acc1、srebp1c、fas、scd-1、pparγ、dgat1、elovl6;降低了脂肪酸转运相关基因的表达,包括mttp、cd36、fatp1、fatp4;降低了脂肪分解相关基因atgl的表达;也降低了与脂滴合成相关的基因cgi 58的表达(图3),这与之前发表的动物实验的结果[21]一致。
Yang等提出AMPK在介导EGCG对脂肪酸合成和分解代谢的作用中发挥主要作用[6]。AMPK是机体细胞主要的能量传感器,参与脂肪酸氧化与葡萄糖转运、甘油三酯的合成与代谢等多种细胞代谢过程[6,24]。本研究发现EGCG处理3T3-L1成熟脂肪细胞可以激活AMPK(图4A),那么,AMPK在介导EGCG减小3T3-L1成熟脂肪细胞脂滴大小的过程中是否也发挥作用呢?本研究结果显示EGCG可以降低3T3-L1成熟脂肪细胞的PGC-1α和PPARγ的表达水平(图4B)。有文献报道,AMPK可以通过抑制PPARγ调控脂肪的合成及储存,而PGC-1α是PPARγ的辅活化子[6,26]。那么,EGCG是否通过激活AMPK抑制PPARγ调控脂肪的合成及储存,从而来调节脂滴蓄积呢?本研究使用AMPK的抑制剂Dorsomorphin处理3T3-L1成熟脂肪细胞后,发现AMPK的抑制剂显著抑制了p-AMPK的表达,而EGCG与AMPK抑制剂共同使用处理细胞时,发现p-AMPK的表达可以获得部分恢复(图4A)。与对照组相比,AMPK的抑制剂Dorsomorphin可以使PPARγ的表达显著增加,而在Dorsomorphin存在下,加入EGCG可以使PPARγ的表达被显著抑制(图4A)。这些研究结果表明,EGCG通过激活AMPK抑制PPARγ的表达,从而达到减少脂滴蓄积的目的。
在对脂类代谢相关因子的表达水平进行检测时发现,EGCG显著降低了参与脂肪酸转运相关基因的表达(图3B),这表明EGCG可以抑制脂肪的吸收。有文献报道,EGCG可以抑制大鼠脂质吸收[27],这与本研究结果一致,但具体机制仍不清楚。有文献指出cd36的表达受PPARγ的转录调控,因为在cd36启动子的近端区域存在PPARγ反应元件[28];PPARγ可以激活fatp和ap2基因的表达,ap2、fatp是PPARγ的靶基因,位于PPARγ下游,受PPARγ调控,在葡萄糖和脂质代谢中起重要作用[29-30]。因此,EGCG可能通过抑制PPARγ从而降低参与脂肪酸转运的相关基因如cd36、fatp的表达从而抑制了脂肪酸的转运。另外,有文献报道,CD36可抑制AMPK的活化,敲减cd36可以显著增强AMPK的活化水平[31-32]。因此,根据上述讨论内容,推测EGCG调节脂肪细胞脂滴大小的机制可能是通过增强AMPK的活化,来抑制PPARγ的表达,从而抑制与脂肪合成相关基因的表达和脂肪吸收相关基因的表达,来降低脂滴的大小;另一方面,cd36基因表达的下调又反过来增强AMPK的活化水平(图5)。
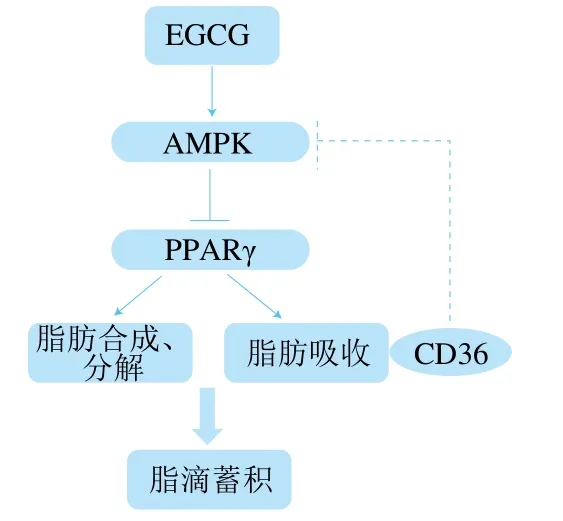
图5 EGCG调控3T3-L1成熟脂肪细胞中脂滴蓄积机制示意图Fig. 5 Schematic diagram of the mechanism of EGCG regulating lipid droplet accumulation in 3T3-L1 mature adipocytes
综上,EGCG处理3T3-L1成熟脂肪细胞可以降低脂滴大小和脂肪细胞甘油三酯相对含量,其降低脂滴大小的机制可能与增强AMPK活性有关。一方面,AMPK活性增加使PPARγ的表达降低从而调控脂肪合成和分解,进而减小脂滴大小;另一方面,AMPK通过抑制PPARγ从而抑制cd36、fatp1、fatp4这些与脂肪吸收相关基因的表达,减少脂肪吸收进而减少脂肪细胞中脂滴蓄积。
