分子动力学模拟超高压结合热处理对β-乳球蛋白结构的影响
2022-01-06简清梅索化夷张喜才苟兴能黄业传
简清梅,索化夷,张喜才,苟兴能,黄业传,*
(1.荆楚理工学院生物工程学院,湖北 荆门 448000;2.西南大学食品科学学院,重庆 400715;3.西南科技大学生命科学与工程学院,四川 绵阳 621010)
牛乳营养丰富,是深受人们喜爱的一种食物。乳制品的杀菌现仍以巴氏杀菌等热处理为主,但加热或多或少会降低产品的品质。随着人们对高质量食品的需求不断增加,希望在保证食品安全的情况下尽量减少营养损失。由此一些非热杀菌技术,如超高压在食品中的应用越来越受到重视,其在具有良好杀菌效果的同时使食物中小分子营养和风味物质得以较好保存,超高压用以牛奶杀菌也有很多研究[1-2]。食物中的一些耐压细菌在高达1 000 MPa的压力下仍能存活,因此现在超高压在食品杀菌的应用主要是压力结合一定的温度进行处理,一般温度不超过60 ℃[3-4]。高压结合热处理会对大分子的食品蛋白质造成影响,一些学者就高压热处理结合对蛋白理化性质、蛋白结构、蛋白氧化[5-6],及对酶活性的影响[7-8]等进行了研究。
高压处理不可避免会影响牛乳中蛋白的结构和性质,进而影响产品品质。一些学者研究了超高压处理对牛乳中蛋白的影响,如Bogahawaththa等研究表明高压能使乳清蛋白,特别是β-乳球蛋白和免疫球蛋白G变性,还会破坏酪蛋白胶束的结构,600 MPa以上处理时通过巯基二硫化物的形成引起乳蛋白聚集[9];Considine等也发现超高压下β-乳球蛋白的变性或聚集主要是蛋白中二硫键重排引起的[10];Russo等发现压力较低时β-乳球蛋白的结构较稳定,而3 000 bar(即300 MPa)以上的压力会使蛋白结构逐渐展开变性[11]。但这些研究仍以常规的实验分析方法为主,如光谱技术、波谱技术、量热技术等,因此仍不清楚超高压处理过程中乳蛋白结构在微观层面的变化。分子动力学模拟现已成为研究蛋白结构的一种有效方式,成为继实验和理论手段后从分子水平了解和认识蛋白质世界的第三种手段,是一种具有足够小的时间尺度和空间尺度的强大模拟技术[12]。分子动力学用于研究牛乳蛋白的报道较多,主要是牛乳中的β-乳球蛋白与一些小分子结合的动力学模拟,如柑橘黄酮[13]、辣椒素[14]、姜黄素[15]、茶多酚[16]、芦丁[17]等。就处理方式而言,关于热处理对蛋白影响的分子模拟较多,如一些学者研究了加热条件下乳蛋白结构变化的分子动力学过程[18-21];而模拟超高压对蛋白影响的研究较少,如Kurpiewska等模拟了胰岛素在高压下的结构变化[22],陈刚模拟了脂肪酶在高压下的结构变化[12],分子动力学用于模拟牛乳蛋白在超高压处理下的变化更是鲜有报道。
β-乳球蛋白是乳清中含量最为丰富的一种蛋白质,由于其良好的功能和营养特性,因此在食品工业中有广泛的应用。β-乳球蛋白每个单体含有162个氨基酸,分子质量为18.4 kDa,是由8 条反向平行的β-折叠构成的桶状结构,外侧含有α-螺旋结构[23]。600 MPa被认为是能够杀灭牛乳中绝大多数微生物的安全压力[2],因此本研究以β-乳球蛋白为研究对象,从分子动力学角度探讨300、600 MPa的压力结合300、330 K的温度对蛋白分子结构的影响,并与通常意义上比较剧烈的加热温度100 ℃(373.15 K)的热处理进行对比,以更深入地了解高压条件下β-乳球蛋白结构在微观层面的变化。因分子动力学模拟得到的数据较多,为更好地反映蛋白分子结构的变化,采用方差分析-偏最小二乘回归分析(analysis of variance-partial least squares regression,APLSR)法探讨温度和压力对蛋白结构的影响规律。
1 材料与方法
1.1 分子动力学模拟
本研究中分子动力学模拟参考文献[12-14,18],采用Gromacs(2019.6)软件[24],β-乳球蛋白从RCSB PDB网站(www.rcsb.org)下载(ID号:3npo),下载后用PyMOL软件手动除去结晶水。模拟过程中选用GROMOS54a7力场[25],将蛋白放入立方体水盒子中,水模型采用简单点电荷(simple point charge,SPC)模型,使蛋白离盒子边缘最短距离为1 nm,添加Na+使体系达到电中性,使用最速下降法对体系进行能量最小化[26]。然后在NVT和NPT系综下分别进行400 ps的平衡,平衡后温度为300 K,压力达到预先设定的压力值(0.1、300、600 MPa)。最后在设定的压力和温度下进行150 ns的分子动力学模拟,使用LINCS(linear constraint solver)算法约束所有键,使用PME(particle-mesh-Ewald)方法计算静电作用,范德华相互作用使用截断半径为1.4 nm进行计算。选用Parrinello-Rahman压浴方式、Isotropic控压方式、V-rescale控温方式。需要升温时,温度从300 K以10 K/ns的速度升至目标温度(300、330、373.15 K),然后一直保持在目标温度下。模拟步长为2 fs,每10 ps储存1 次数据,每个处理平行模拟2 次。
模拟结束后,去除周期性边界条件,然后使用Gromacs软件相应的分析命令分析不同处理条件下蛋白结构的均方根误差(root mean square deviation,RMSD)、均方根波动(root mean square fluctuation,RMSF)、回旋半径、二级结构、溶剂可及表面积、蛋白体积和氢键数量的变化。其中RMSD、回旋半径、蛋白体积均是提取全部150 ns的数据,每0.1 ns提取1 次,共1 500个数据点,以分析整个模拟过程中蛋白的结构变化情况;而蛋白二级结构、氢键数量、溶剂可及表面积、RMSF只分析蛋白稳定后的数据,即100 ns到150 ns的数据,共500个数据点。
1.2 APLSR分析
以7个0/1样品变量(0.1 MPa-300 K、0.1 MPa-330 K、300 MPa-300 K、300 MPa-330 K、600 MPa-300 K、600 MPa-330 K、100 ℃(0.1 MPa-373.15 K))作为X变量,13个蛋白结构信息指标作为Y变量作PLS2分析。13个指标分别为RMSD、RMSF、回旋半径、蛋白体积、总溶剂可及表面积、亲水表面积、疏水表面积、氢键数量、α-螺旋数量、β-折叠数量、无规卷曲数量、转角数量、弯曲数量,分别取100~150 ns共500个数据点的平均值,即每0.1 ns提取1 次数据。
为了更直观地显示压力与温度联合作用对蛋白结构的影响,将100 ℃样品去掉后,以主要设计变量(温度:300、330 K;压力:0.1、300、600 MPa)和6个0/1样品变量作为X变量,上述13个蛋白结构指标为Y变量,进一步做PLS2分析。
APLSR分析采用Unscrambler V 9.7软件,所有数据在分析前均进行标准化。
1.3 数据统计分析
实验结果以平均值±标准差表示,分子模拟结果采用Origin 8.0软件绘图,APLSR分析的关系图采用Unscrambler软件绘制,采用SPSS软件中的Duncan检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 高压结合热处理对β-乳球蛋白RMSD的影响
RMSD是衡量特定时间蛋白结构与原始构象的平均偏差,是评价模拟体系是否稳定的重要指标。由图1可知,100 ℃的体系在100 ns后才达到平衡,而其他体系均是在75 ns以内达到平衡。从平衡以后RMSD的具体值来看,100 ℃加热的体系RMSD远大于其他体系,100 ns后的平均值为0.45 nm,而其他的处理组RMSD均小于0.33 nm,说明100 ℃加热对β-乳球蛋白的结构破坏远大于300、600 MP的压力结合330 K的热处理。从300 K下不同压力来看,0.1 MPa时的RMSD最低,300、600 MP时RMSD相当,后者略高于前者,这说明压力的增大能增加蛋白的不稳定性;陈刚报道脂肪酶在常温下200、400、600 MPa处理时相对0.1 MPa时RMSD均有所增加[12],与本研究结论类似。330 K条件下样品的RMSD总体上明显高于300 K时,说明温度对RMSD的影响显著。从3个压力结合330 K的结果来看,RMSD最大的是单独330 K加热的体系(0.33 nm),其略高于600 MPa-330 K(0.30 nm),远大于300 MPa-330 K处理的体系(0.21 nm)。这说明压力和加热处理对蛋白结构的去稳定机制可能相反,即单独的压力或加热都会使蛋白结构不稳定,但一定的压力处理可以稳定由加热导致的蛋白结构不稳定。鲜有关于高压结合热处理对蛋白RMSD影响的报道,Borgohain等报道了尿素可引起蛋白变性,但其对高压变性有部分抵消作用[27],Angsupanich等报道了压力和温度影响鱼蛋白结构的机理不同[28]。
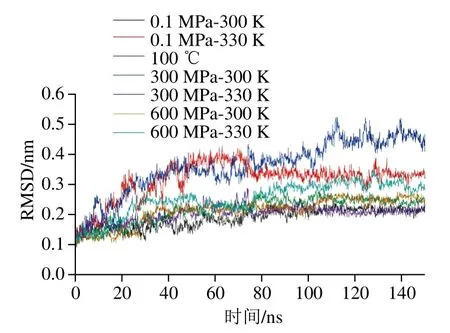
图1 不同处理条件对β-乳球蛋白RMSD的影响Fig. 1 Effect of different treatments on the RMSD of β-lactoglobulin
2.2 高压结合热处理对β-乳球蛋白回旋半径的影响
不同处理条件下蛋白回旋半径的变化如图2所示,回旋半径越小表明蛋白结构越致密,反之则越膨胀。由图2可知,各体系回旋半径相差不大,相对而言,100 ℃的样品和常压下处理的2个样品回旋半径较大,且只有100 ℃的体系后期回旋半径增加,而其他体系都是随时间的延长有所减少,说明100 ℃加热时蛋白会膨胀,而其他处理过程中蛋白或多或少都会变得更加致密。Sahihi等模拟柑橘黄酮与β-乳球蛋白间的结合时报道的回旋半径比本研究的稍低,约1.40~1.45 nm,但Sahihi等是在常温常压下进行模拟[13],与本研究的模拟条件不同。

图2 不同处理条件对β-乳球蛋白回旋半径的影响Fig. 2 Effect of different treatments on the radius of gyration of β-lactoglobulin
2.3 高压结合热处理对β-乳球蛋白RMSF的影响
相比于平均构象,RMSF是蛋白中每一个氨基酸残基的均方根位移,反映残基的波动情况。加热样品在100 ns后结构才比较稳定,因此计算RMSF时均提取100~150 ns的蛋白结构。由图3可以看出,氨基酸残基波动较大的处理有100 ℃、常压下330 K加热、600 MPa-330 K样品,这与RMSD和回旋半径的分析结果基本一致。RMSF较大的一些残基主要有77号赖氨酸、51号谷氨酸、63号天冬酰胺、8号赖氨酸、87号亮氨酸、112号谷氨酸、1号亮氨酸、162号异亮氨酸、159号谷氨酰胺、114号谷氨酸等,说明这些残基在高压处理过程中柔性较大,是导致蛋白结构不稳定的主要氨基酸。这与刘祥雨等报道的结果基本一致,他们在模拟β-乳球蛋白加热过程中,发现35、51、87号位氨基酸波动较大[18]。
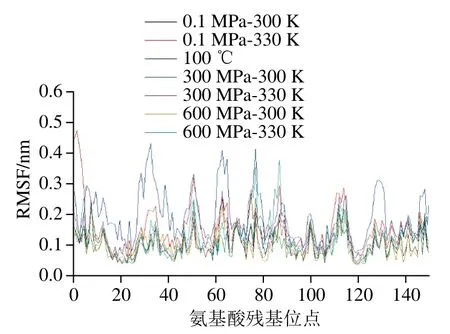
图3 不同处理条件对β-乳球蛋白RMSF的影响Fig. 3 Effect of different treatments on the RMSF of β-lactoglobulin
2.4 高压结合热处理对β-乳球蛋白氢键数量的影响
氢键是稳定蛋白结构的一种重要的非共价结构力,由图4可知,加热或加压处理均可减少蛋白的氢键数量,300 MPa处理组比常压处理组平均少了2个氢键,600 MPa处理组比300 MPa处理组平均少了3个氢键;330 K处理组比300 K处理组的样品平均少了1个氢键,而100 ℃加热处理组氢键在330 K处理组的基础上氢键数量又平均减少了4个左右。氢键是稳定蛋白质结构的主要作用力之一,因此氢键数量的减少会使蛋白结构稳定性降低。刘祥雨等的模拟研究表明100 ℃及以下的温度对β-乳球蛋白的氢键数量影响不大,而120 ℃的加热才会显著减少蛋白的氢键数量[18],这与本研究得到的结果有所差异。

图4 不同处理条件对β-乳球蛋白氢键数量的影响Fig. 4 Effect of different treatments on the number of hydrogen bonds in β-lactoglobulin
2.5 高压结合热处理对β-乳球蛋白体积的影响
各处理对蛋白体积的影响如图5所示,加热处理可以增加蛋白体积,温度越高增加幅度越大;而压力增加则减小蛋白体积,压力越大则蛋白体积减小幅度也越大。因此加热和加压对蛋白结构的影响是不同的,加热使蛋白膨胀,而加压使蛋白收缩从而变得更加致密。这些结果与前面回旋半径的结果一致。Kurpiewska等报道了胰岛素在100 MPa下体积减小1.4%[22]。根据Le Châtelier原理,高压下蛋白朝着体积减小的方向进行,主要是高压下水分子进入疏水腔使疏水腔变形进而体积减小[29]。

图5 不同处理条件对β-乳球蛋白体积的影响Fig. 5 Effect of different treatments on the volume of β-lactoglobulin
2.6 高压结合热处理对β-乳球蛋白溶剂可及表面积的影响
由表1可知,不同处理显著影响蛋白的溶剂可及表面积。具体来看,100 ℃的加热可显著增加溶剂可及表面积,疏水表面积和亲水表面积都显著增加,这可能是该温度下蛋白充分变性所致,这与刘祥雨等报道的结果[18]一致。而高压结合300、330 K的处理相比常温常压组(0.1 MPa-300 K)则显著降低了总溶剂可及表面积和疏水表面积,亲水表面积除了0.1 MPa-330 K和300 MPa-300 K处理组外也显著降低。300 MPa-300 K处理组总溶剂可及表面积及疏水表面积均降低最多,这可能与高压下蛋白体积减小有关,而处理条件更剧烈时,如温度增加或压力继续升高,可能导致部分蛋白变性聚集,使溶剂可及表面积反而有所增加。本研究中亲水表面积始终大于疏水表面积,因此无论是在加热还是高压处理过程中,β-乳球蛋白总体上都是水溶性的。疏水表面积的减少可能是高压下水分子渗透进入蛋白分子内部使更多的疏水区域暴露在极性水溶液中[30]。有关压力作用下蛋白疏水性的变化有一些报道,但结果不一致,有的学者报道随压力的增加蛋白的疏水作用减弱[29,31],而另一些学者报道高压下蛋白的疏水性增加[32-33]。但上述两种报道是以表面疏水性为测定指标,采用实验手段得出的结论,而本研究测定的指标为疏水表面积,是通过分子模拟得出的结论,两者不能完全划等号。

表1 不同处理条件对β-乳球蛋白溶剂可及表面积的影响Table 1 Effect of different treatments on the solvent accessible surface area of β-lactoglobulin
2.7 高压结合热处理对β-乳球蛋白二级结构的影响
由表2可知,与常温常压(0.1 MPa-300 K)处理组相比,随压力增加或温度的升高,蛋白的结构也发生了明显的变化,主要是α-螺旋和β-折叠数量减少而无规卷曲数量增加,其中100 ℃处理组样品比所有压力处理样品变化更剧烈,这和前面的研究结果是一致的。刘祥雨等的模拟结果也表明加热处理能显著降低该蛋白的α-螺旋和β-折叠数量,而增加无规卷曲的数量[18];曹艳芸也用实验手段测得加热后蛋白的部分α-螺旋和β-折叠会向无规卷曲转变[34]。与0.1 MPa-300 K组样品相比,各组样品中蛋白二级结构变化最显著的为600 MPa-330 K处理组,其无规卷曲和β-折叠数量的变化尤为突出,而弯曲和转角数量的变化相对较小且缺少规律性。因此,相对于100 ℃的高温处理,高压结合一定温度的热处理可以较好地稳定蛋白二级结构,但600 MPa结合330 K的处理条件仍会使蛋白二级结构发生较大的改变。邱春江研究表明肌原纤维蛋白在高压下α-螺旋数量下降[32],α-螺旋对压力比较敏感可能是高压下蛋白的氢键受到一定程度破坏,因氢键对α-螺旋的稳定至关重要[35];白雨鑫的研究表明500 MPa的压力对β-乳球蛋白的二级结构影响很小[33];Chen Gang等研究发现400 MPa的压力处理能使大豆蛋白的α-螺旋数量减少而β-折叠数量增加[31],这些差异可能缘于蛋白不一样或测定方法不一样,他们大都采用实验手段测得。总的来说,若将超高压冷杀菌技术用于牛乳制品生产能更好地保持蛋白的结构。
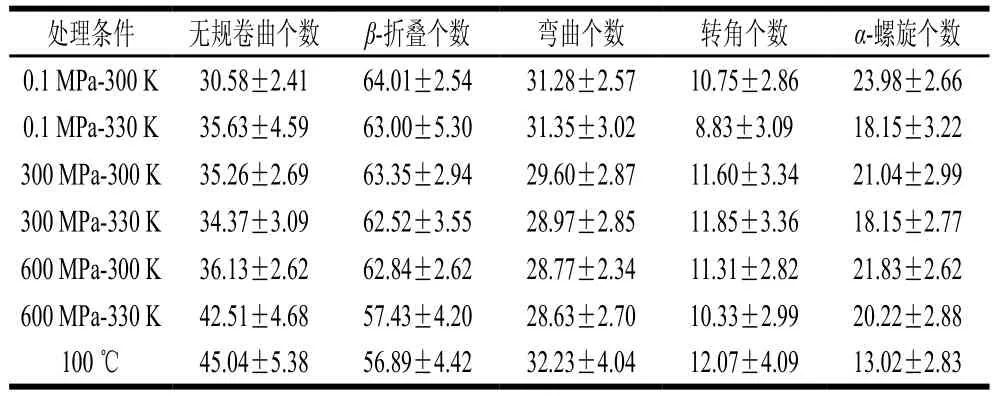
表2 不同处理条件对β-乳球蛋白二级结构的影响Table 2 Effect of different treatments on the secondary structure of β-lactoglobulin
2.8 APLSR分析的结果
前面虽然分别描述了不同处理对β-乳球蛋白13个结构指标的影响,但还是不能直观看出温度、压力对蛋白结构总的影响规律;再加上模拟时间为150 ns,1 ns提取10个数据点,因此分析前面分的指标时均为500或1 500个数据点。为更好地了解高压结合热处理对β-乳球蛋白结构的影响,运用偏最小二乘回归分析的PLS2程序探究温度和压力对蛋白结构的影响规律。
APLSR分析结果如图6所示,X轴代表7个0/1样品变量,Y轴代表β-乳球蛋白13个结构指标,第1、2主成分(principal component,PC)分别解释了Y变量的58%和25%,大多数Y变量都位于r2=0.5(内圆)和r2=1(外圆)之间,具有较好的解释效果。可以看出100 ℃处理的样品位于载荷图的最右端,和其他样品距离均较远,说明其对蛋白结构的影响不同于其他处理。具体来看,RMSD、RMSF、回旋半径、总溶剂可及表面积、疏水表面积、亲水表面积、蛋白体积等指标均在其附近,说明加热处理会增加这些指标,导致蛋白结构的不稳定;蛋白的α-螺旋、β-折叠、氢键数量等指标位于载荷图的左侧,说明高压结合一定的热处理相比100 ℃加热处理能更好地维持蛋白的二级结构和氢键。因100 ℃处理的样品与其他样品在蛋白结构上差异较大,以至于不同压力间样品在载荷图上差异不明显。为更好地探究压力结合热处理对蛋白结构的影响规律,将100 ℃处理的样品去掉后,以6个0/1样品变量和主要设计变量(压力、温度)为X轴,以蛋白结构信息变量为Y轴,再次进行APLSR分析,结果如图7所示。

图6 7个0/1样品变量与蛋白结构信息的APLSR分析载荷图Fig. 6 APLSR correlation loading plot of seven 0/1 indicator variables versus protein structural parameters
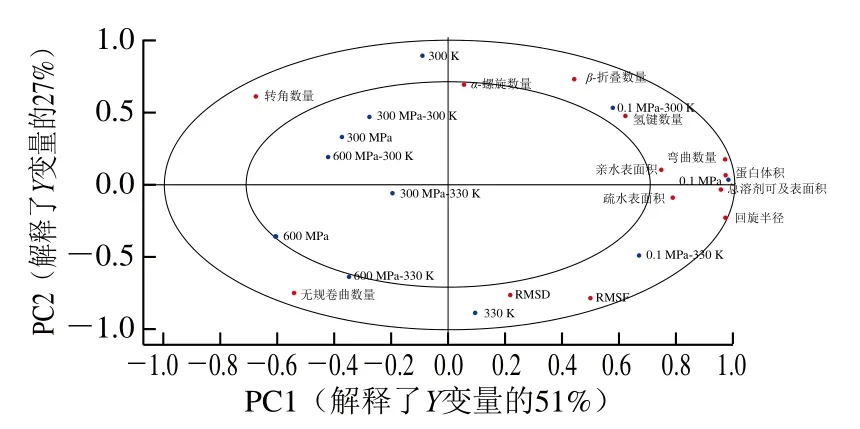
图7 6个0/1样品变量与蛋白结构信息的APLSR分析载荷图Fig. 7 APLSR correlation loading plot of six 0/1 indicator variables versus protein structural parameters
由图7可知,PC1、PC2分别解释了Y变量的51%和27%,13个Y变量基本都位于r2=0.5(内圆)和r2=1(外圆)之间,因此能较好地反映不同处理样品蛋白结构上的差异。不同压力处理样品的差异主要反映在PC1,其中常压处理组位于载荷图最右端,高压处理组在载荷图左侧,300、600 MPa样品的差异同时反映在PC2,前者位于载荷图靠上位置,而后者在左下方。不同温度处理样品主要区别于PC2,其中300 K样品位于上方,而330 K样品位于下方。从Y变量来看,总溶剂可及表面积、疏水表面积、亲水表面积、蛋白体积及回旋半径均位于右侧,与0.1 MPa样品距离很近,说明高压处理会显著减少蛋白的溶剂可及表面积和体积,并使蛋白的结构更加致密,这与前面的分析结果是一致的。氢键数量与常温常压样品(0.1 MPa-300 K)重叠在一起,说明不管是加热还是加压处理都会一定程度上破坏蛋白间氢键,从而影响蛋白的稳定性。α-螺旋数量和RMSD两个指标主要区别于PC2,说明受温度影响较大,温度升高时,会使蛋白结构波动增加,并使α-螺旋数量明显减少。另外,转角、无规卷曲、β-折叠数量和RMSF分别位于载荷图的远离坐标轴的4个不同象限,说明这4个指标同时受温度和压力的影响,具体来看,温度的升高和压力的增加都会减少β-折叠数量,并相应地增加无规卷曲数量,常压和330 K条件下蛋白氨基酸残基数量波动最大,高压和常温条件下转角数量最高。从图7还可以看出,在330 K条件下,涉及蛋白结构稳定的3个指标RMSD、RMSF、回旋半径均与常压样品距离较近(0.1 MPa-330 K),而与高压处理样品,特别是300 MPa样品距离较远(300 MPa-330 K),说明300 MPa的压力处理能减小由于加热导致的蛋白结构破坏,即一定的压力处理可以保护热处理导致的蛋白结构不稳定。
3 结 论
100 ℃加热对β-乳球蛋白的结构破坏远大于600 MPa结合330 K的处理,说明相比于完全的高温,高压结合一定温度的联合处理是一种较温和的方式,蛋白的空间结构保留相对完整。与常温常压处理相比,高压处理会导致蛋白的溶剂可及表面积、蛋白体积减小,而使蛋白结构更加致密;330 K的加热处理会破坏蛋白结构,特别是使α-螺旋数量减少;压力的升高和温度的升高均能使蛋白间氢键、β-折叠数量减少,相应的无规卷曲数量增加;而氨基酸残基波动则随温度升高而增加,随压力增加而减小。一定的压力处理,特别是300 MPa能减缓热处理(330 K)导致的蛋白结构波动。本研究从分子动力学角度分析了高压结合一定温度的热处理对β-乳球蛋白结构的影响,为进一步了解高压对食品蛋白的影响和促进高压技术在含蛋白食品中的应用奠定了一定的理论基础。
