血培养阳性报警时间在微生物初步鉴定中的价值
2022-01-05赵亚楠曹啟新赵建平
赵亚楠, 曹啟新, 赵建平
(内蒙古自治区人民医院,内蒙古 呼和浩特 010010)
近年来,随着侵入性诊疗技术在临床的普及,患者血流感染(bloodstream infection,BSI)发生率大幅上升,早期确诊BSI,并明确引起BSI的病原菌是治疗的关键。血培养作为目前诊断BSI的金标准[1],能够快速且准确地对病原菌进行分离和鉴定,及时将致病菌的药物敏感性报告提供给临床,为临床合理用药提供参考。血培养阳性报警时间(time to positive,TTP)是指将装有患者血液的培养瓶从放入血培养仪到培养瓶中的微生物生长繁殖产生一定量的CO2,从而激发仪器发出阳性报警所经历的时间。本研究拟探讨TTP在初步鉴别微生物种类和区分病原菌与污染菌中的价值,以期为指导临床合理用药提供参考。
1 材料和方法
1.1 菌株来源
收集2017—2020年内蒙古自治区人民医院分离自住院BSI患者的非重复血培养阳性临床分离菌株534株。
1.2 仪器与试剂
法国生物梅里埃公司Bact/ALERT 3D 全自动血培养系统及配套血培养瓶(分成人和儿童培养瓶2种),Vitek 32 全自动微生物分析/药敏系统及配套鉴定卡、药敏卡、哥伦比亚血琼脂平板、巧克力血琼脂平板、沙保弱琼脂平板。药敏纸片购自英国Oxoid公司。
1.3 方法
1.3.1 标本采集 按照美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)M47-A文件要求采集所有患者使用抗菌药物前外周静脉血。对于儿童患者,同时采集其不同部位2~3瓶血培养标本,每瓶不少于2 mL;对于成年患者,同时采集其不同部位2~3套血培养标本,每套8~10 mL。采集后立即送检[2]。
1.3.2 阳性结果的处理 当仪器发出报警时,及时记录阳性报警时间并卸下血培养瓶,用无菌注射器抽取适量培养液,转种于哥伦比亚血琼脂平板和巧克力血琼脂平板;若怀疑是真菌感染,则将其转种于沙保弱琼脂平板,后置于5%~10% CO2温箱中37 ℃培养18~24 h,同时涂片行革兰染色镜检。孵育后如有细菌生长,将其进行分离和鉴定,并行体外药物敏感性试验。
1.3.3 结果判定 仪器发出报警且染色涂片阳性,同时转种培养出病原菌判定为阳性;若转种培养未发现病原菌则判定为假阳性;仪器培养时间>5 d均未发出报警,且转种培养未发现微生物,判定为阴性。
1.3.4 细菌鉴定 采用Vitek 32 全自动微生物分析/药敏系统鉴定分离菌种类,并发出分离菌药物敏感性报告,操作过程严格按照第4版《全国临床检验操作规程》[3]进行。质控菌株大肠埃希菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)、金黄色葡萄球菌(ATCC 29213)、粪肠球菌(ATCC 29212)均购自国家卫生健康委临床检验中心。质控均在控。
1.3.5 病原菌与污染菌判定标准 (1)病原菌判定标准:①患者发热(≥38 ℃)或低温(≤36 ℃)伴有寒战,且发热不能由其他原因解释;②患者白细胞增多(>10.0×109/L,特别是核左移)或粒细胞减少(<1.0×109/L);③患者血小板减少,皮肤黏膜出血;④患者昏迷,多器官衰竭,血压下降,收缩压<12 kPa(90 mmHg),或较原收缩压下降超过5.3 kPa(40 mmHg);⑤患者呼吸加快(呼吸频率>20次/min或CO2分压<32 mmHg),肝脾肿大,关节疼痛,C反应蛋白、内毒素、降钙素升高等;⑥多次血培养为同一种细菌或从其他感染部位或导管尖端分离到相同的病原菌,且耐药谱相同;⑦患者根据血培养药物敏感性试验结果使用敏感抗菌药物治疗有效,或拔出静脉导管、移植异物后感染得到控制[4-5]。(2)污染菌判定标准(至少符合以下条件之一):①患者无明显发热现象或危险因素(如侵入性操作或机体免疫功能受损);②患者发热能由其他因素解释,且无明显感染症状;③血培养培养出2种及以上的皮肤正常菌群(如凝固酶阴性葡萄球菌、痤疮丙酸杆菌、芽孢杆菌或微球菌);④连续多日、多次采集血液标本进行血培养,培养出同一种皮肤正常菌群;⑤患者根据血培养药物敏感性试验结果使用敏感抗菌药物治疗无效;⑥查阅患者病历,临床医生根据其症状、体征及一系列的临床指标判断为污染菌[6-8]。
1.4 统计学方法
采用SPSS 22.0软件进行数据分析。正态分布数据采用±s表示,比较采用t检验;非正态分布数据采用中位数表示,比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 TTP与微生物分布
534株菌株中,TTP≤3 d的分离菌占96.0%;肠杆菌科TTP主要集中在1 d以内(79.9%),葡萄球菌属TTP主要集中在1~2 d(48.1%),酵母菌TTP主要集中在2 d以上(57.2%)。见表1。
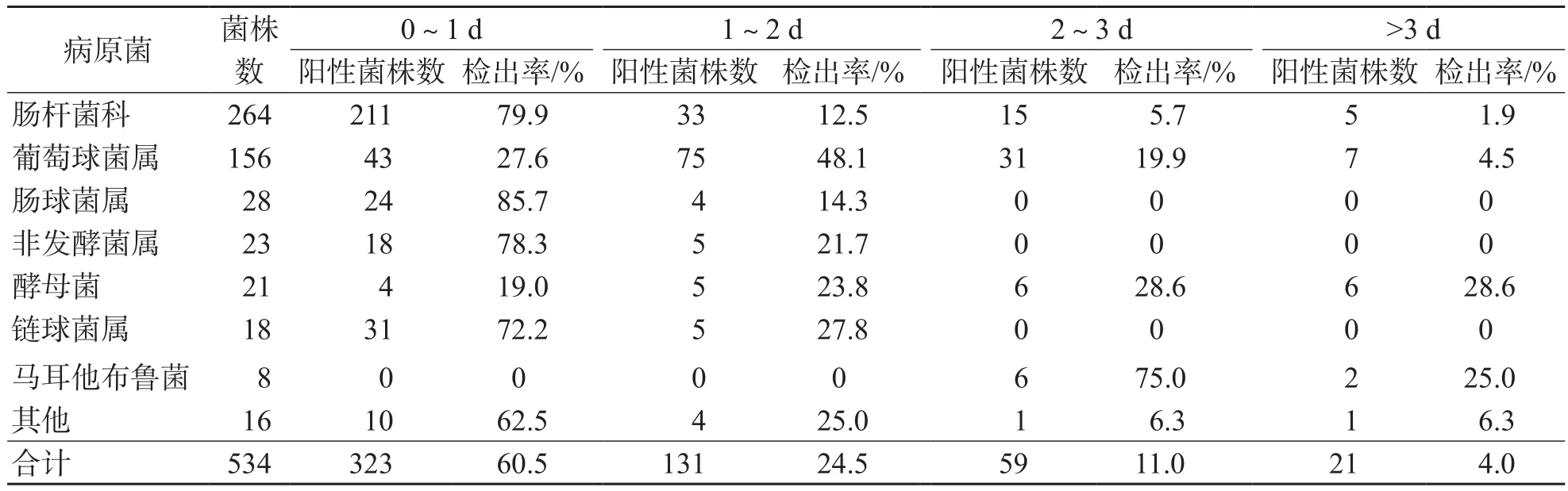
表1 534株菌的TTP及其检出率
2.2 不同种类菌株TTP比较
534株菌中,除马耳他布鲁菌外,所有病原菌的TTP中位值均≤2 d,肠杆菌科TTP中位值最早(0.57 d),马耳他布鲁菌TTP中位值最晚(2.75 d)。肠杆菌科TTP与肠球菌属、葡萄球菌属、酵母菌、马耳他布鲁菌及其他病原菌比较,TTP差异均有统计学意义(P<0.05);与非发酵菌属和链球菌属比较,TTP差异无统计学意义(P>0.05)。见表2。

表2 不同种类菌株TTP比较
2.3 可疑污染菌TTP分布及其与病原菌的比较
2.3.1 可疑污染菌TTP分布 按照评估标准,本研究筛选出99株(18.5%)可疑污染菌,其中46株(46.5%)TTP为1~2 d。99株污染菌以凝固酶阴性葡萄球菌为主,占所有污染菌的59.6%(59/99),其中91.5%(54/59)TTP≥1 d。见表3。

表3 可疑污染菌TTP分布
2.3.2 病原菌与污染菌TTP比较 108株凝固酶阴性葡萄球菌中,污染菌占54.6%(59/108),TTP中位值为1.77 d 。所有革兰阳性杆菌均为污染菌,污染率为100%,TTP中位值为2.08 d。肠球菌属污染菌TTP中位值最短(0.96 d),酵母菌TTP中位时间最长(3.16 d)。不同种类微生物中的病原菌与污染菌TTP差异均有统计学意义(P<0.05)。见表4。
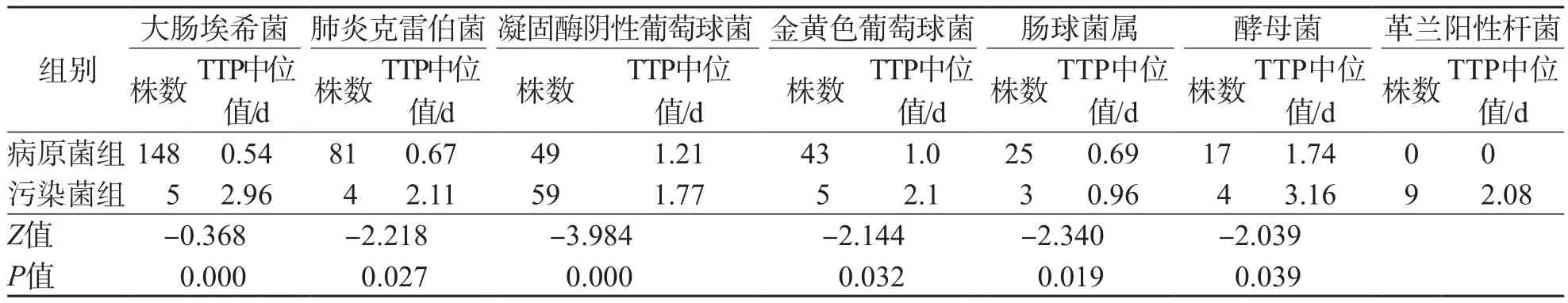
表4 病原菌与污染菌TTP比较
3 讨论
2015—2018 年的CHINET中国耐药性监测数据显示,临床标本来源于血液的临床分离菌所占比例由12.0%上升到14.8%[9-12],提示临床BSI发病率正在逐年上升。
本研究结果显示,534株血培养分离菌中,1、2、3 d内的检出率分别为60.5%、85.0%、96.0%,5 d内检出率几乎为100%(排除某些特殊菌株生长较慢),与相关报道一致[13-14],因此,建议血培养仪报阳时间设定最大值为5 d,超过5 d则为阴性。对于儿童患者,建议将血培养时间缩短为3 d[7]。本研究结果显示,不同种类微生物的TTP由快到慢依次为肠杆菌科(0.57 d)、链球菌属(0.68 d)、非发酵菌属(0.71 d)、肠球菌属(0.72 d)、葡萄球菌属(1.36 d)、酵母菌(1.98 d)、马耳他布鲁杆菌(2.75 d),与文献报道基本一致[15-17]。肠杆菌科大多为兼性厌氧菌,其生长所需营养要求较低,能够在普通培养基上发育良好,生长期较短,细菌可大量繁殖,并且分解发酵葡萄糖产酸产气,产生的CO2多且快,故其TTP较其他病原菌短,最早报警的是大肠埃希菌,TTP最小值仅为0.08 d,与李杰芬等报道的1.92 h一致[14]。本研究中,链球菌属TTP中位时间较肠杆菌科长,但二者比较差异无统计学意义(P>0.05)。链球菌属大多数为兼性厌氧菌,其生长所需营养要求较高,有的甚至还需要某些生长因子辅助,在普通培养基上的生长表现不佳,分解糖的能力不确定,故TTP较肠杆菌科长。非发酵菌属细菌是一类专性需氧菌,因其无法发酵糖类,虽能氧化分解葡萄糖,但只产酸、不产气,又由于血培养瓶中加入了血液等耗氧物质,使其生长环境变得恶劣,故其TTP较肠杆菌科长,但二者差异也无统计学意义(P>0.05)。肠球菌属是一种需氧或兼性厌氧菌,其生长营养要求、基本代谢情况以及生长期曲线与链球菌属相似,与肠杆菌科比较,TTP差异有统计学意义(P<0.05)。本研究中,链球菌属、非发酵菌属和肠球菌属TTP均<1 d,与文献[18]报道一致。葡萄球菌属对生长条件要求较低,在营养肉汤中能够快速生长、繁殖,但其对糖类发酵反应有差异,分解葡萄糖时产酸多、产气少[19],故葡萄球菌属的TTP明显长于肠杆菌科(P<0.05)。酵母菌对营养条件有特殊要求,其代谢基质能力较弱,生长曲线较为圆滑,故其报阳时间晚,与肠杆菌科比较,TTP差异有统计学意义(P<0.05)。马耳他布鲁菌属于专性需氧菌,生长非常缓慢,且营养需求较高,需要多种氨基酸、生物素以及各种离子等的辅助才能生存,故其报阳时间最晚,最大值为4.65 d,明显长于肠杆菌科(P<0.05),由于马耳他布鲁菌可引起人畜共患病,内蒙古自治区以畜牧业为主,马耳他布鲁菌阳性检出率较高。
目前,全自动血培养仪已经广泛应用于临床,大大提高了血培养检测的灵敏度,但是伴随而来的是污染菌的检出率也相应提高,污染菌会使临床误诊,延长患者住院时间[20],同时可能造成抗菌药物的不合理使用,进而加大患者经济负担。因此,如何准确地鉴别病原菌与污染菌是目前临床诊断面临的难题。本研究结果显示,534株血培养分离菌中有99株污染菌,污染率为18.5%,高于叶智颖等[21]报道的16.3%。但远远低于国外报道[22],这可能与医院工作人员严格按照规程进行操作有关,但仍然高于世界卫生组织的要求(血培养污染率≤3%)。本研究污染菌1 d以上的检出率达84.6%,以凝固酶阴性葡萄球菌及革兰阳性杆菌为主,与国内相关报道[23]一致。这可能由于凝固酶阴性葡萄球菌是皮肤正常菌群,当采集临床标本时,皮肤消毒不彻底,导致表皮的凝固酶阴性葡萄球菌随采血针被带入血培养瓶中;或者长期插入导管的患者,在导管处采集标本时将导管内的定植菌带入血培养瓶中有关。血培养TTP与标本含菌量成反比,病原菌在血液中数量较多,故其报阳时间较早,TTP较小;而污染菌因操作不当被带入血液中,含菌量较少,故其报阳时间较晚,TTP较大。本研究发现,病原菌与污染菌TTP差异有统计学意义(P<0.05)。有研究发现,90.9%的葡萄球菌属会在48 h内发出阳性报警,而超过48 h的凝固酶阴性葡萄球菌即可判断为污染菌[24]。本研究中,凝固酶阴性葡萄球菌中污染菌TTP中位时间为1.77 d,与文献[24]报道一致。区分血培养病原菌与污染菌对于临床快速诊断及有效治疗有着重要的意义。答嵘等[25]发现,血培养污染率在规范操作下可以控制在3%以内。临床应在采集量、采集时间、采集时的无菌操作及标本运送等过程中严格遵循相关操作规范,最大限度地降低血培养的污染率。有学者使用分子生物学方法(脉冲场凝胶电泳)对多次血培养分离菌进行同源性分析[26],这些方法准确性较高,但是所需设备较昂贵,一般基层医院难以配备,而通过TTP来初步区分病原菌与污染菌,虽然准确度不高,但无需特殊仪器,只需结合临床相关指标加以判断,具有一定的可行性。
