华蟾素逆转白细胞介素-17A引起的弥漫大B细胞淋巴瘤细胞株对利妥昔单抗的耐药
2022-01-04朱园刘秀丹朱志刚李康保钟伟杰
朱园 刘秀丹 朱志刚 李康保 钟伟杰
广州市第一人民医院1老年病科血液肿瘤科,2超声医学科,3老年病科消化科(广州 510180)
弥漫大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤亚型,约占25%~35%[1],在我国占比更高,可达45%[2]。虽然一线的免疫化疗R-CHOP方案改善了DLBCL患者的预后,但仍有相当一部分患者因利妥昔单抗耐药而出现进展或复发,有研究报道[3],30%的DLBCL病例对利妥昔单抗耐药,既往对利妥昔单抗治疗敏感的B细胞淋巴瘤病人再次接受治疗时,接近60%的病例出现利妥昔单抗耐药[4]。
肿瘤微环境中包含有辅助性17细胞(Th17)和调节性T细胞(Treg),Th17细胞主要分泌白细胞介素(IL)-17起作用。新的CD4+T细胞亚型IL-17+Foxp3+Treg细胞(IFT)为Treg和Th17细胞分化的中间阶段细胞,也可以分泌IL-17。研究发现[5-6]IFT促进食管癌和结肠癌生长。IL-17是DLBCL发生发展中的关键因素,并与预后相关。IL-17在体内及体外均促进DLBCL的生长[7]。利妥昔单抗使DLBCL细胞分泌IL-6增加,促进Th17和IFT细胞表达增加并分泌IL-17增加,抑制了p53的表达,诱导DLBCL细胞抵抗利妥昔单抗[8]。
华蟾素(cinobufagin)的主要成分是干蟾皮提取物,所含的蟾蜍苷元及华蟾蜍精具有较强的抗癌作用[9]。华蟾素可增强恶性淋巴瘤的化疗效果[10]。华蟾素可抑制消化道肿瘤患者Treg细胞的数量[11],降低肺癌患者外周血中IL-17等Th17细胞相关细胞因子的表达[12]。华蟾素还可调控肺癌患者Th17和Treg细胞及IL-17的表达[9]。上述研究均局限于外周血,而目前尚无华蟾素对DLBCL肿瘤微环境中Th17和Treg细胞的研究。
本研究通过体外细胞共培养,构建模拟的DLBCL肿瘤微环境,通过ELISA、qRT-PCR、流式细胞术和细胞凋亡检测等方法,探讨华蟾素能否改善IL-17A引起的DLBCL细胞株对利妥昔单抗的耐药,并初步分析其中的机制。本研究首次在体外实验中证实华蟾素能逆转IL-17A引起的DLBCL细胞株对利妥昔单抗的耐药。
1 材料与方法
1.1 材料与细胞 CCK-8试剂盒购买自日本Dojindo公司,Transwell小室购买自美国CORNING公司,重组人IL-17A购买自美国R&D Systems公司,利妥昔单抗(rituximab,0.1 g/100 mL)购买自瑞士诺华公司,华蟾素(5 mL/支)购买自安徽华润金蟾药业股份有限公司。所有ELISA试剂盒、流式抗体和凋亡试剂盒均购买自美国eBioscience公司,western blot抗体均购买自美国Santa Cruz公司。人体外周血单个核细胞(PBMCs)是通过空腹抽取健康志愿者的外周静脉血10 mL,肝素抗凝,用Ficoll-Hypaque方法分离获得。人DLBCL细胞株SU-DHL-2(ABC型)和SU-DHL-4细胞株(GCB型)购买自BNCC(北京,中国)。本研究方案获得广州市第一人民医院伦理委员会审查通过,伦理批件号为K-2019-034-01。
1.2 体外细胞共培养 本项目包含两个体外细胞共培养实验,分别培养72 h。SU-DHL-2/4细胞和PBMCs的细胞浓度均为1×106个/孔,IL-17A浓度为0.1 ng/mL,利妥昔单抗浓度为10 μg/mL,华蟾素用量为注射液原液0.2 mL。分组具体如下:实验一:分成2大组,各6小组,分组如下:SU-DHL-2单独;SU-DHL-2+华蟾素;SU-DHL-2+利妥昔单抗;SU-DHL-2+利妥昔单抗+华蟾素;SU-DHL-2+利妥昔单抗+IL-17A;SU-DHL-2+利妥昔单抗+IL-17A+华蟾素;SU-DHL-4单独;SU-DHL-4+华蟾素;SU-DHL-4+利妥昔单抗;SU-DHL-4+利妥昔单抗+华蟾素;SU-DHL-4+利妥昔单抗+IL-17A;SU-DHL-4+利妥昔单抗+IL-17A+华蟾素。实验二:将SU-DHL-2/4细胞、PBMCs按1∶1的比例共培养,并使用Transwell小室间接培养,加或不加华蟾素,其中SUDHL-2或SU-DHL-4细胞置于小室中,其他细胞置于小室外。分组如下:PBMCs+SU-DHL-2;PBMCs+SU-DHL-2+华蟾素;PBMCs+SU-DHL-4;PBMCs+SUDHL-4+华蟾素。
1.3 Western blot 本研究使用western blot检测各组SU-DHL-2或SU-DHL-4细胞中cleaved PARP、cleaved caspase-3和GAPDH蛋白的表达,步骤与方法同文献[13]。
1.4 流式细胞术 调整细胞密度为2×106个/mL。Th17细胞检测:在37℃和5%CO2条件下,在培养基中加入50 ng/mL的佛波酯、10 μg/mL的Brefeldin A和1 μg/mL的离子霉素,刺激细胞5 h。然后用抗CD3-FITC、抗CD8-PE和抗IL-17A-APC抗体在室温下对细胞进行染色1 h。Treg细胞检测:在室温下用抗CD25-PE-Cy7、抗CD4-FITC、抗Foxp3-PE和IL-17A-APC抗体进行染色1 h。然后上机分析,使用Flowjo 10软件分析数据。CD3+CD8-IL-17A+细胞定义为Th17细胞,CD4+CD25+Foxp3+IL-17A+细胞定义为IFT细胞。
1.5 CCK-8、ELISA和细胞凋亡测定 步骤与方法同文献[13]。
1.6 统计学方法 采用SPSS 22.0进行分析。计量资料以均数±标准差表示。采用Two-tailed independent-sample Student′s t/t检验对两组之间进行比较。单因素方差分析和Bonferroni检验(每两组之间)用于多组之间的比较。P<0.05认为差异有统计学意义。
2 结果
2.1 华蟾素逆转IL-17A引起的DLBCL细胞株对利妥昔单抗的耐药 前期已经证实IL-17A可引起DLBCL细胞株对利妥昔单抗的耐药[8],本研究旨在探索华蟾素能否逆转IL-17A引起的耐药。见图1,华蟾素并不能直接抑制SU-DHL-2或SU-DHL-4细胞的增殖(SU-DHL-2:P > 0.99;SU-DHL-4:P >0.99);利妥昔单抗可显著抑制SU-DHL-2或SU-DHL-4细胞的增殖(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01);而IL-17A明显减弱了利妥昔单抗抑制SU-DHL-2或SU-DHL-4细胞增殖的作用,引起耐药(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01);最后,华蟾素逆转IL-17A引起的SU-DHL-2或SU-DHL-4细胞对利妥昔单抗的耐药(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01)。
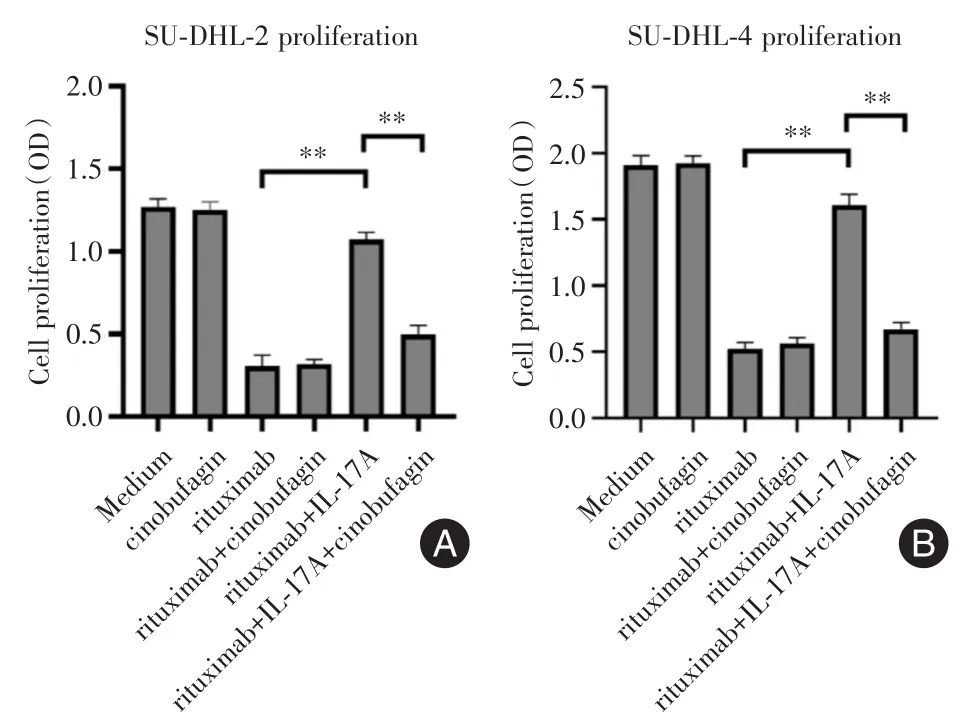
图1 华蟾素逆转IL-17A引起的DLBCL细胞株对利妥昔单抗的耐药Fig.1 Cinobufagin reversed the rituximab resistance of DLBCL cell lines induced by IL-17A
2.2 华蟾素逆转IL-17A引起的DLBCL细胞株凋亡率减少 为了进一步探讨华蟾素逆转IL-17A引起DLBCL细胞株对利妥昔单抗耐药的机制,笔者检测了华蟾素对DLBCL细胞株凋亡的影响。图2A为不同分组中SU-DHL-2或SU-DHL-4细胞的具有代表性的凋亡流式图。如图2B-C所示,利妥昔单抗显著增加了SU-DHL-2或SU-DHL-4细胞的凋亡率(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01);而IL-17A加入后,显著抑制了利妥昔单抗诱发的SUDHL-2或SU-DHL-4细胞的凋亡率(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01);而华蟾素又逆转了IL-17A这一作用,增加了SU-DHL-2或SU-DHL-4细胞的凋亡率(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01)。这些结果表明华蟾素是通过增加DLBCL细胞株的凋亡来改善IL-17A引起的对利妥昔单抗的耐药。
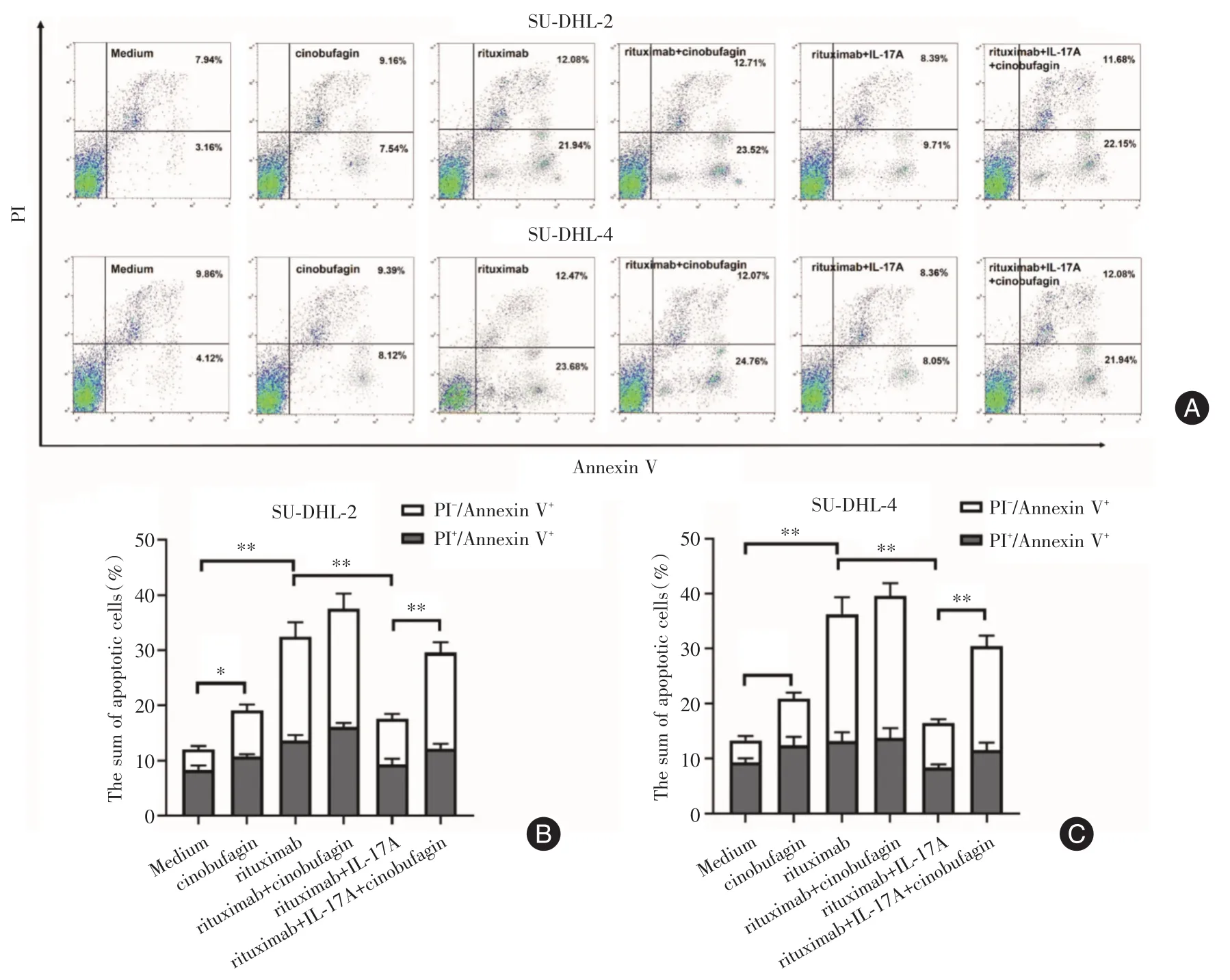
图2 华蟾素逆转IL-17A引起的DLBCL细胞株凋亡率减少Fig.2 Cinobufagin reversed the reduced apoptosis rate of DLBCL cell lines induced by IL-17A
2.3 华蟾素通过升高Cleaved PARP和Cleaved caspase-3的表达促进DLBCL细胞株的凋亡 进一步检测华蟾素对DLBCL细胞株中常见凋亡信号通路中的常见蛋白的影响。收集各组中的SUDHL-2或SU-DHL-4细胞,使用Western blot法检测cleaved PARP和cleaved caspase-3的蛋白水平。图3结果显示,与对照组相比,华蟾素组轻微升高了DLBCL细胞株内cleaved PARP和cleaved caspase-3的蛋白水平,且华蟾素+IL-17A+利妥昔单抗组比IL-17A+利妥昔单抗组DLBCL细胞株内的cleaved PARP和cleaved caspase-3的蛋白水平显著升高。这些结果提示,华蟾素可能通过升高cleaved PARP和cleaved caspase-3表达促进DLBCL细胞株的凋亡。
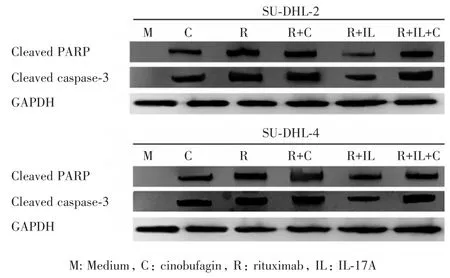
图3 华蟾素通过升高SU-DHL-2和SU-DHL-4细胞中cleaved PARP和cleaved caspase-3的表达Fig.3 Cinobufagin increased the expressions of cleaved PARP and cleaved caspase-3 in SU-DHL-2 and SU-DHL-4 cells
2.4 华蟾素抑制肿瘤微环境中Th17和IFT细胞的分化,降低IL-17A水平 除了直接影响DLBCL细胞株的凋亡以外,还进一步研究华蟾素对肿瘤微环境中Th17和IFT细胞的分化及IL-17A水平的影响。见图4B、D,华蟾素显著抑制SU-DHL-2或SU-DHL-4细胞微环境中 Th17(SU-DHL-2:P=0.011;SU-DHL-4:P=0.025)和IFT细胞(SU-DHL-2:P<0.01;SU-DHL-4:P=0.017)的分化。而且,华蟾素也显著减低SU-DHL-2或SU-DHL-4细胞微环境中IL-17A的水平(SU-DHL-2:P<0.01;SUDHL-4:P<0.01)(图4E),但对TGF-β和IL-10水平无影响(图4F-G)。
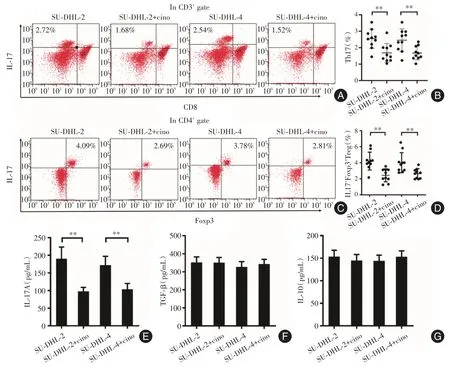
图4 华蟾素抑制肿瘤微环境中Th17和IFT细胞的分化,降低IL-17A水平Fig.4 Cinobufagin inhibited the differentiation of Th17 and IFT cells in tumor microenvironment,and then decreased the level of IL-17A
3 讨论
初治DLBCL患者中有约40%最终会复发或进展,这些患者的3年无疾病进展生存率仅为37%,总生存率仅为49%,预后非常差,而获得性的利妥昔单抗耐药是其中的重要原因[14]。因此,探索并阐明利妥昔单抗耐药的机制以及找到逆转利妥昔单抗耐药的药物非常重要。导致利妥昔单抗耐药的原因很多,主要包括以下三方面:CD20结构功能异常、补体和抗凋亡蛋白异常表达抑制利妥昔单抗作用和肿瘤微环境的改变等[15]。前期研究[8,16]证实利妥昔单抗可促进DLBCL肿瘤微环境中IL-17A水平升高,IL-17A导致DLBCL细胞株凋亡减少,引起利妥昔单抗耐药。
本研究结果证实,外源性IL-17A在体外可构建DLBCL细胞株对利妥昔单抗的耐药模型,而华蟾素通过:(1)升高cleaved PARP和cleaved caspase-3的表达促进DLBCL细胞株的凋亡;(2)抑制肿瘤微环境中Th17和IFT细胞的分化降低IL-17A水平这两方面作用,最终逆转IL-17A引起的DLBCL细胞株对利妥昔单抗的耐药。
IL-17A是IL-17家族6个成员(IL-17A-F)中之一,主要来源于Th17细胞,部分来源于IFT细胞,IL-17A是构成肿瘤微环境的重要成分之一[17]。IFT细胞是Treg和Th17细胞之间的一种中间形态,早已被证实能分泌IL-17A[18]。IL-17A已被多项研究证实能促进卵巢癌、结肠癌等肿瘤的化疗或靶向药物耐药[19-20]。而且,前期研究[8,16]已经证实IL-17A可引起DLBCL对利妥昔单抗的耐药。本研究中通过外源性IL-17A顺利构建DLBCL细胞株对利妥昔单抗的耐药模型,与之前的研究结论一致。因此,如何能降低肿瘤微环境中IL-17A水平或拮抗IL-17A作用成为改善DLBCL对利妥昔单抗耐药的关键因素。
华蟾素是我国中药瑰宝之一,是我国蟾蜍科动物中华大蟾蜍的全皮阴干后,经提取加工处理,制成的水溶性成分,主要成分包括蟾毒内酯类、吲哚生物碱类、多肽、胆固醇等[21]。华蟾素已被广泛应用于肺癌、肝癌、乳腺癌、结直肠癌等恶性肿瘤中,均取得明显抑瘤作用[22]。相比于西医药物,华蟾素优势在于其具有抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、放化疗增敏及逆转耐药等作用[22]。LIU等[23]发现华蟾素能逆转鼻咽癌对顺铂药物化疗的耐药性,王玲等[24]也发现华蟾素能逆转人乳腺癌细胞对阿霉素的耐药。而且,华蟾素能降低肺癌患者外周血中IL-17等Th17细胞相关细胞因子的表达[12],可调控肺癌患者Th17和Treg细胞及IL-17的表达[9]。cleaved PARP和cleaved caspase-3是细胞凋亡通路中的两种重要蛋白,这两者水平升高,提示细胞凋亡率增高[25]。ZHANG等[26]研究发现华蟾素能升高cleaved PARP和cleaved caspase-3蛋白的表达而促进葡萄膜黑色素瘤细胞凋亡。与上述前期研究一致,本研究体外实验证实华蟾素升高cleaved PARP和cleaved caspase-3的表达促进DLBCL细胞株的凋亡,抑制肿瘤微环境中Th17和IFT细胞的分化降低IL-17A水平,最终逆转IL-17A引起的DLBCL对利妥昔单抗的耐药。这个结果进一步证实了华蟾素在逆转化疗耐药上具有独特的优势。
综上所述,本研究证实华蟾素在体外升高cleaved PARP和cleaved caspase-3的表达促进DLBCL细胞株的凋亡,抑制肿瘤微环境中Th17和IFT细胞的分化降低IL-17A水平,最终逆转IL-17A引起的DLBCL对利妥昔单抗的耐药。未来希望能进一步在动物实验或者人体试验中证实华蟾素逆转利妥昔单抗耐药的作用,为未来临床上应用华蟾素联合传统免疫化疗药物治疗DLBCL患者提供更充实的证据。华蟾素未来有望成为DLBCL治疗的联合用药之一。
