来自链霉菌的木聚糖酶协同酶解蔗渣的特性研究
2021-12-28黎忠冼亮李青云唐爱星刘幽燕
黎忠,冼亮,李青云,唐爱星,刘幽燕
(广西大学化学化工学院,广西南宁 530004)
0 引言
近二十年,人口激增和经济发展导致全球能源消耗剧增,人们开始积极探索可替代传统化石燃料的非常规能源以满足需求。木质纤维素生物质被认为是最有潜力的可替代能源之一。以蔗渣为例,它是甘蔗经压榨和提取蔗汁后得到的纤维状残留物,我国蔗渣的年产量超过500万t,除少部分蔗渣被用于生产强度不高的纸张外[1],大部分蔗渣被堆埋或焚烧,这不仅使这些原料没有得到有效利用,还造成了严重的环境污染问题。目前,公认有效利用木质纤维素的途径是将木质纤维素原料降解后生产糖类物质[2],糖类物质再进一步转化为生物燃料、精细化学品等。由此,木质纤维素原料导致的环境污染问题可以通过对木质纤维素原料的高附加值利用得到解决,木质纤维素的开发和再利用也能部分替代传统化石燃料,使能源短缺得到缓解。
木质纤维素由纤维素、半纤维素和木质素等聚合物组成,这些聚合物彼此交联缠绕,使得木质纤维素具有抗降解的特性,也使其难以得到有效的水解。因此,木质纤维素基发酵生产生物燃料和化学品的瓶颈问题之一就是如何将木质纤维素生物质降解为还原糖[3]。与化学、物理方法相比,酶法水解的优势在于副产物少、设备腐蚀少、能耗低和环境友好等,但是酶的降解效率低也成为影响该工艺工业化的限制因素。研究人员一直在开发各种可用于木质纤维素水解的酶,采用复合酶体系是提高酶水解效率的策略之一,其中木聚糖酶与纤维素酶的协同增效作用得到了很多文献报道的证实[4]。
木聚糖酶是一种半纤维素酶,可从木聚糖的均聚物主链中随机切割出β-1,4-D-吡喃木糖单位,并将木聚糖降解为木糖和低聚木糖(Xylooligosaccharides,XOS)。由于低聚木糖是一种很有市场价值的益生元,因此将木聚糖酶用于协同木质纤维素酶解可以带来非常可观的经济效益。木聚糖酶可来源于动物或植物,但主要来自于微生物,包括如黑曲霉(Aspergillus niger)、里氏木霉(Trichoderma reesei)、米根霉(Rhizopus oryzae)、扬氏青霉(Penicillium janczewskii)等丝状真菌。
本课题组前期克隆所得的来自链霉菌的新型木聚糖酶Xyn10A已被证实可高效水解农林业残留物[5],本文通过培养诱导重组大肠杆菌pET30a(+)-SipoEnXyn10A/E.coli Rosetta(DE3)并使用镍柱纯化法纯化得到重组木聚糖酶Xyn10A,并将其应用于蔗渣的协同酶解,考察了蔗渣预处理方式和纤维素酶的种类对协同作用的影响,并通过响应面法对多酶体系的协同特性进行了初步探讨。研究成果可进一步丰富蔗渣酶法降解的生物资源理论基础。
1 材料与方法
1.1 实验材料
纤维素酶C1184和C2730购买于Sigma公司,β-葡萄糖苷酶S10048 from almonds购买于上海源叶生物科技有限公司,重组菌pET30a(+)-SipoEnXyn10A/E.Coli Rosetta(DE3)为本实验室克隆构建所得,蔗渣由广西博世科环保科技有限公司提供,机械研磨后过60目筛,干燥后保存以进行后续的预处理。
1.2 实验方法
1.2.1 木聚糖酶Xyn10A的纯化
按照文献[5]中的方法纯化Xyn10A。在摇床(37℃,150 r/min)中培养含重组菌的LB培养基(氯化钠10 g/L、蛋白胨10 g/L、酵母粉5 g/L,pH调至7.0,121℃灭菌20 min)至菌体OD600浓度约为1.0,加入终浓度为1 mM的诱导剂IPTG,在摇床(18℃,100 r/min)中诱导12~16 h。诱导结束后,离心收集菌体细胞,然后重悬于含有10 mM的咪唑,300 mM的NaCl和50 mM的NaH2PO4(pH 8.0)的缓冲液中。通过ATS匀质机破碎菌体,并使用Ni2+亲和色谱法在10~500 mM的咪唑梯度下洗脱重组蛋白。使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis,SDS-PAGE)测定重组蛋白的纯度,并采用二喹啉甲酸法测定蛋白的浓度。纯化后的Xyn10A洗脱液经脱盐浓缩后用于后续实验。
1.2.2 蔗渣的预处理
采用两种方法对蔗渣进行预处理。第一种为AHPⅠ(Alkaline Hydrogen PeroxideⅠ)预处理:蔗渣与质量分数为2% NaOH按1∶10的固液比混合均匀,并在121℃下蒸压20 min,待反应混合物冷却至室温后加入质量分数为5%的H2O2,密封后置于暗处静置24 h[6]。第二种为AHPⅡ预处理:蔗渣与质量分数为2%的H2O2和0.5%的MgSO4组成的混合溶液(用NaOH调节pH值为11.6)按1∶20的固液比混合均匀,并在60℃下水浴4 h[7]。反应完成后,AHPⅠ和AHPⅡ蔗渣用去离子水清洗至中性,并在50℃下干燥后密封保存备用。不同预处理蔗渣的化学成分如表1所示。
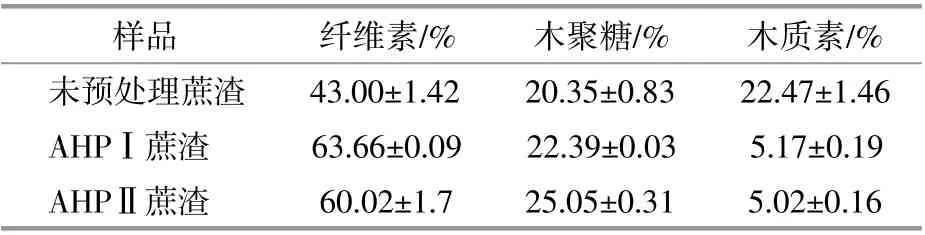
表1 不同预处理蔗渣的化学成分Table 1 The chemical composition of sugarcane bagasse with different pretreatment
1.2.3 Xyn10A协同不同纤维素酶水解蔗渣
反应体系以AHPⅠ和AHPⅡ预处理蔗渣作为底物,底物含量为2%,反应液为2 mL的柠檬酸-Na2HPO4缓冲液(pH值为6.0)。单Xyn10A酶组的酶用量(以单位质量的底物计)为1 mg/g(37.5 U/g)的Xyn10A、单纤维素酶组的酶用量为0.5 FPU/g的C1184或C2730,协同酶组同时含有以上酶用量的相应酶。各组别反应体系置于水浴振荡器(50℃,150 r/min)中水解24 h,设置灭活的酶组进行同样操作作为空白对照。最终以二硝基水杨酸法测定还原糖量并计算协同程度。
1.2.4 协同酶酶用量的响应面设计
反应体系以AHPⅠ预处理蔗渣作为底物,底物含量为2%,反应液体积为2 mL。以C2730(X1),S10048(X2),Xyn10A(X3)的酶用量为研究因素,以产糖量和协同程度作为响应值,根据Design-Expert 8.0.6的响应面法进行3因素3水平的Box-Benhnken Design探究实验。各组别反应体系均置于水浴振荡器(50℃,150 r/min)中水解24 h,设置灭活的酶组进行同样操作作为空白对照,每组设两个平行实验,结果取平均值。研究因素与水平值如表2所示。
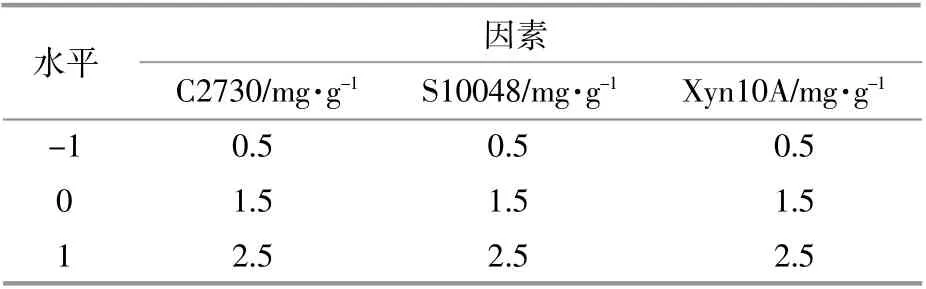
表2 Box-Behnken Design考察因素与水平Table 2 Factors and levels of the Box-Behnken Design
1.2.5 总酶用量对还原糖产量和协同程度的影响
反应体系设置底物浓度为2%,反应液体积为2 mL,以总酶用量为考察因素,协同酶组的各酶酶用量为C2730∶S10048∶Xyn10A=1∶1∶1,总酶用量设为1.5~72 mg/g。设置灭活的酶组进行同样操作作为空白对照,每组设两个平行实验,结果取平均值。各反应样品使用液相HPLC和蒸发光检测器ELSD联合检测,并在测试时使用乙腈/水(体积比为85∶15)作为流动相,以2 mL/min的流速洗脱,待测样品的进样量为20μL,HPLC配备了Hypersil NH2色谱柱,该色谱柱柱尺寸为250×4.6 mm,粒径为5μm,柱温为30℃,使用蒸发光散射检测器在温度为40℃,载气压力为0.35 MPa的条件下检测糖分。单糖产率的计算式为

式中:Y1+2为添加纤维素酶和木聚糖酶进行水解反应时的糖浓度,g/L;Y1和Y2分别为纤维素酶和木聚糖酶单独水解时的糖浓度,g/L。
2 结果与讨论
2.1 木聚糖酶Xyn10A的纯化结果
将镍柱填料纯化Xyn10A所得洗脱液进行SDS-PAGE,结果如图1所示。
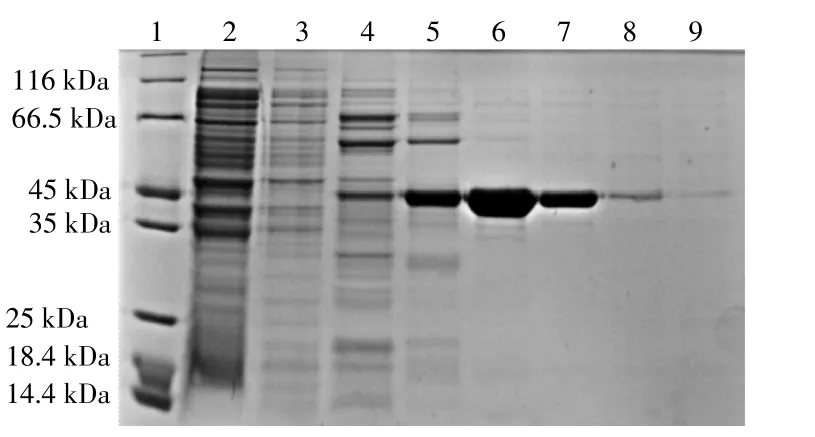
图1 纯化Xyn10A的凝胶电泳图Fig.1 Gel electrophoresis of purified Xyn10A
由图1可看出,随着洗脱液中咪唑浓度的升高,目的蛋白条带开始出现,在第6,7泳道出现一条纯度较高的条带,该条带的分子量约44 kDa,符合预计大小[5]。含0.2,0.3 M咪唑的洗脱液能够将目的蛋白洗脱下来,洗脱行为也符合预计,说明Xyn10A得到成功纯化。将0.2,0.3 M咪唑的洗脱液合并进行脱盐和浓缩用于后续实验。
2.2 不同来源纤维素酶对预处理蔗渣水解效果的影响
为了提高预处理蔗渣的水解效果,分别选用C2730和C1184与Xyn10A协同水解预处理蔗渣,结果见图2。
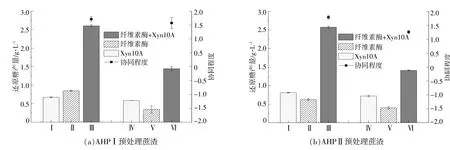
图2 Xyn10A分别与C2730或C1184协同降解预处理蔗渣Fig.2 Degradation of different pretreated bagasse by synergizes of Xyn10A with C2730 or C1184
从图2可以看出,以不同预处理蔗渣为底物时,单C2730酶组的还原糖产量均明显高于单C1184酶组,并且C2730与Xyn10A协同酶组降解AHPⅠ和AHPⅡ预处理蔗渣的还原糖产量分别为2.60,2.58 g/L,比C1184与Xyn10A协同酶组均提高了1.80倍。由此可见,反应体系即便添加了相同酶活单位的酶制剂,但由于酶制剂的来源不同,所含的辅酶成分不一,则反应获得的还原糖产量也并不一定相同,这也进一步说明多酶协同反应的水解效率与各辅酶组分息息相关,辅酶组分的添加和水解效率的分析才能加深对多酶协同作用的了解,从而为更高效的混合酶制剂的制定提供参考[8]。此外,不同协同酶组在降解不同预处理蔗渣时,AHPⅠ预处理蔗渣均可以获得最高的还原糖产量,可见不同底物的降解优势并不随反应酶系的改变而改变。
就协同程度而言,C2730与Xyn10A协同酶组降解AHPⅠ和AHPⅡ预处理蔗渣的协同程度分别为1.71和1.79,相较于C1184与Xyn10A协同酶组的1.55和1.26,均得到提高,这说明相较于C1184,C2730与Xyn10A之间存在更明显的协同作用。因此,在本文其后研究中均以C2730和Xyn10A组成协同酶组,并以具有最高还原糖产量的AHPⅠ预处理作为预处理方法。
2.3 多酶酶用量的响应面分析
考虑到多酶之间的协同作用是有交互作用的,而单因素实验较难考察多酶之间的交互影响,故运用响应面法进行多因素探究。分别以C2730,S10048和Xyn10A的酶用量为考察因素,以还原糖产量和协同程度为响应值,进行三因素三水平的Box-Benhnken Design实验来评估多酶之间的协同行为,实验结果如表3所示。使用Design-Expert8.0.6软件对还原糖产量和协同程度这两项响应值进行ANOVA分析,在还原糖产量的回归模型中,F值=356.64,p<0.000 1,说明模型具有显著性;在协同程度的回归模型中,F值=4.08,p=0.030 2,说明该模型同样具有显著性,故响应面模型可以很好地对实验结果进行分析和预测[9]。
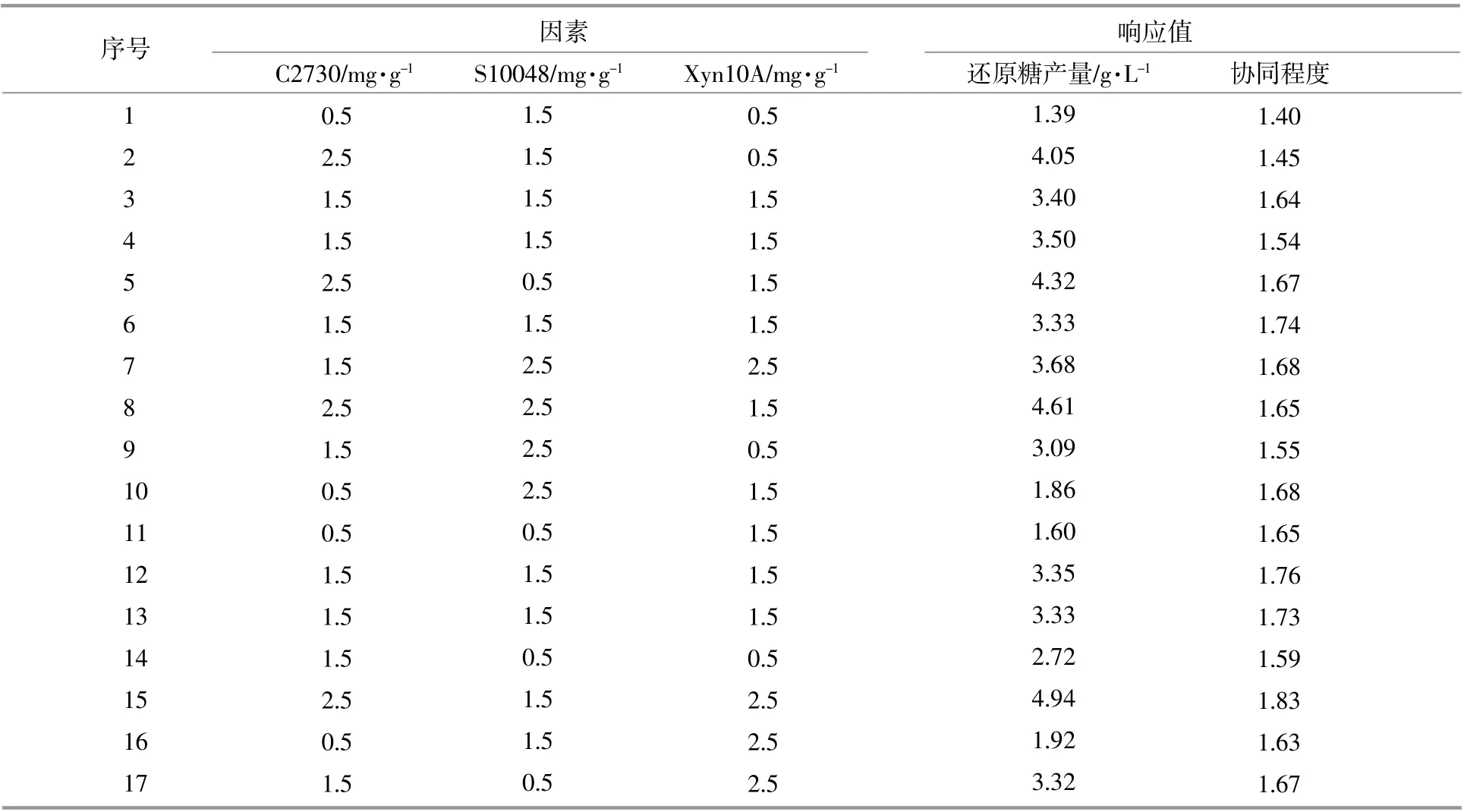
表3 Box-Benhnken Design实验结果Table 3 Box-Benhnken Design experimental results
影响还原糖产量和协同程度的各因素的相互作用分别如图3,4所示。

图3 各酶酶用量对还原糖产量的影响Fig.3 The effect of each enzyme loading on sugar production
由图3可以看出:随着C2730和Xyn10A两酶酶用量的增加,还原糖产量持续增高,说明C2730和Xyn10A在协同水解过程中对还原糖产量的提升有积极作用,且C2730在提高还原糖产量上的作用优于Xyn10A;C2730和S10048两酶酶用量的增加对还原糖产量的增高展现出积极影响,而S10048酶用量的变化在促进还原糖产量提升方面的作用弱于C2730;Xyn10A和S10048两酶酶用量的变化并未明显改变还原糖产量。
由图4可以看出:就协同程度而言,C2730与Xyn10A的交互影响作用比C2730与S10048的交互影响作用更明显,说明C2730和Xyn10A之间的协同作用要比C2730和S10048的之间的协同作用更显著;在协同程度的提升上,Xyn10A的影响效应比C2730和S10048更显著。
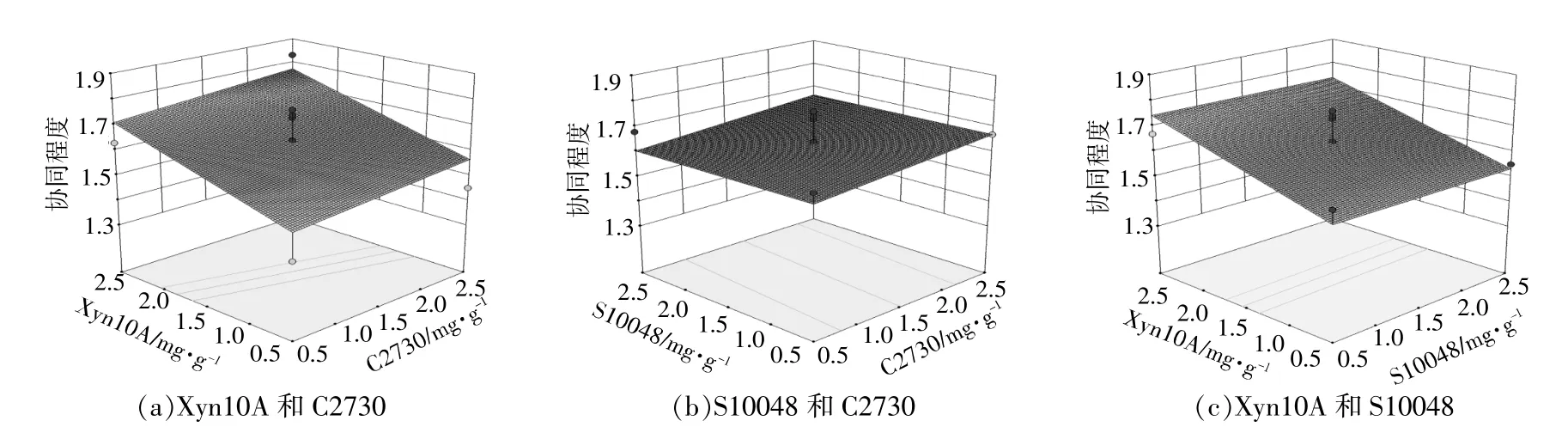
图4 各酶酶用量对协同程度的影响Fig.4 The effect of each enzyme loading on the degree of synergy
综上可知,在C2730,Xyn10A和S10048的多酶混合体系中,3种酶酶用量的变化对还原糖产量和协同程度均有影响,但影响效果略有差异,C2730酶用量的变化对还原糖产量的影响作用最强,而Xyn10A是协同程度的最大影响因素。
2.4 酶用量对产糖和协同作用的影响
酶用量对单酶系统还原糖产量的影响如图5所示。总酶用量对多酶协同系统(C2730,S10048和Xyn10A的酶用量之比为1∶1∶1)还原糖产量和协同程度的影响如图6所示。
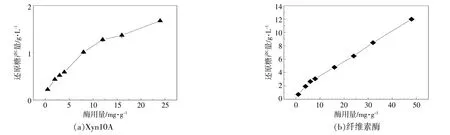
图5 单Xyn10A酶和纤维素酶酶用量对还原糖产量的影响Fig.5 Effect of only Xyn10A and cellulase enzyme loading on sugar production
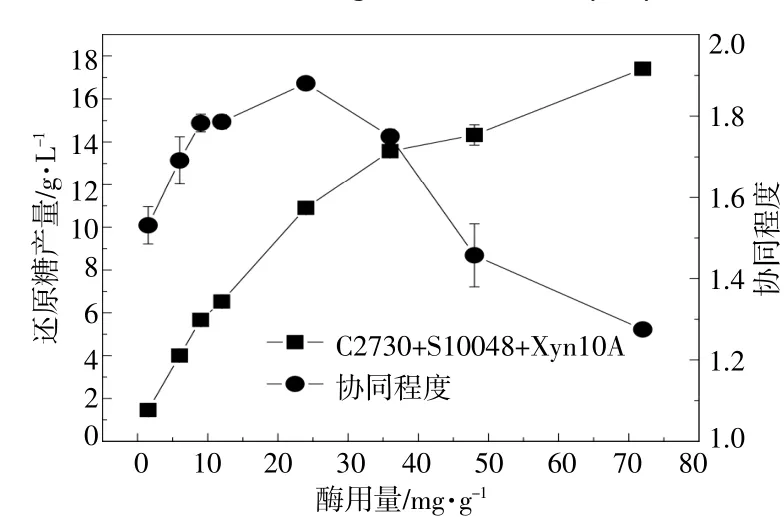
图6 酶用量对还原糖产量和协同程度的影响Fig.6 Effect of total enzyme loading on sugar production and the degree of synergy
从图5,6可以看出:单Xyn10A组、单纤维素酶组和协同酶组的还原糖产量均随着酶用量的增加而持续增加;在最高酶用量下,各组的还原糖产量分别为1.68,11.98,17.41 g/L,协同酶组的还原糖产量相较于单纤维素酶组提高了45%,由此可见,Xyn10A的添加使得协同酶组的还原糖产量有显著提高。随着酶用量的增加,相较于单纤维素酶组和协同酶组,单Xyn10A组的还原糖产量的增长趋势更为平缓,说明纯木聚糖酶只有在协同体系中才能更好的发挥作用。
由图6可以看出:协同程度随总酶用量的增加而先增后减,最高协同程度1.88出现在总酶用量为24 mg/g时;当总酶用量小于24 mg/g时,还原糖产量和协同程度均随着总酶用量的增加而增加,当总酶用量大于24 mg/g时,还原糖产量随着总酶用量的增加而增加,而协同程度开始下降。这与Converse A O得出结论相一致[10]。产生上述现象的原因:在低总酶用量下,底物对酶的有效结合位点处于盈余状态,故此时增加酶用量能增加底物与酶的结合,从而增强酶对底物的有效水解,产糖和协同程度同时增加;在高总酶用量下,酶分子间的竞争结合作用会使协同程度下降[11]。
2.5 单糖产率分析
进一步对2.4节中协同酶组的反应样品进行单糖产率分析,结果如图7所示。
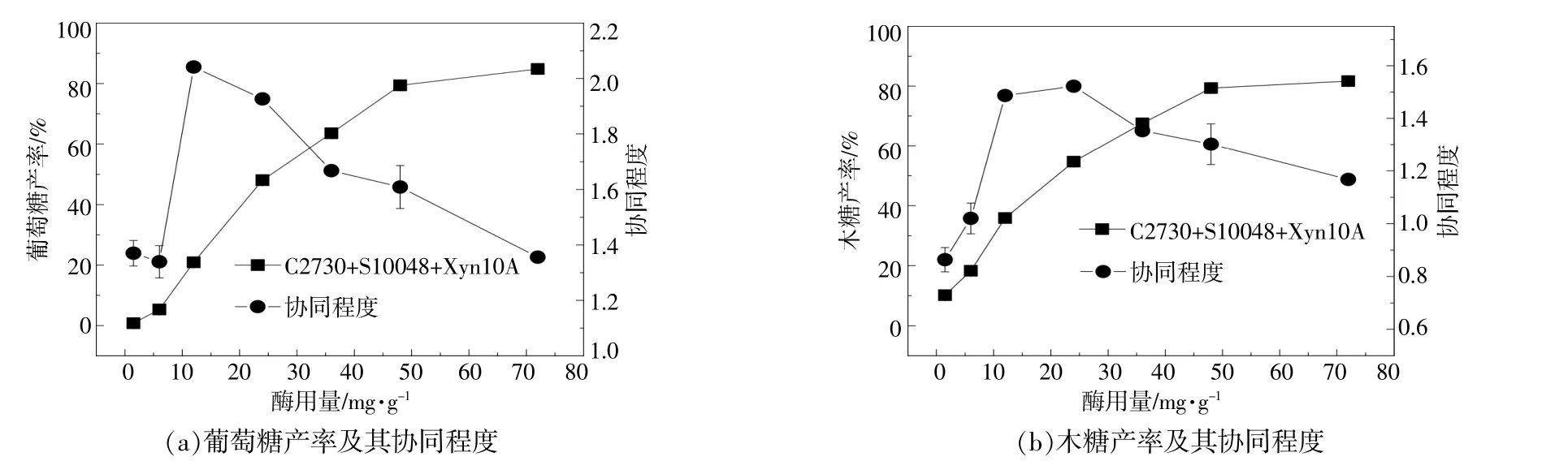
图7 酶用量对单糖产率和协同程度的影响Fig.7 Effect of total enzyme loading on monosaccharide yield and synergy
从图7可以看出:无论是葡萄糖还是木糖,随酶用量的变化,单糖产率和协同程度均出现了相似的变化趋势,即协同程度均随着酶用量的增加而先增后减,单糖产率均随着酶用量的增加而增加;在最高酶用量处,葡萄糖产率为84.83%,协同程度为1.36,木糖产率为81.67%,协同程度为1.17。
3 结论
①蔗渣的不同预处理方式和不同来源的纤维素酶均会影响协同酶解效果,采用不同来源的纤维素酶协同Xyn10A降解不同预处理蔗渣时,AHPⅠ预处理蔗渣均可以获得最高的还原糖产量,底物的降解优势并不随反应酶系的改变而改变。
②C2730,S10048和Xyn10A3种酶酶用量的增加对酶解还原糖产量的提升具有积极作用,C2730是还原糖产量的最大影响因子,而Xyn10A则是协同程度的最大贡献者。在C2730酶用量不变的情况下,Xyn10A和S10048两辅酶的交互作用不会明显提升还原糖产量。
③协同程度随酶用量的增加而先增后减,最高协同程度1.88出现在总酶用量为24 mg/g时。还原糖产量随着酶用量的增加而持续增高,当总酶用量为72 mg/g时,协同酶组的还原糖产量为17.41 g/L,相较于单纤维素酶的11.98 g/L,提高了45%,相应的葡萄糖产率为84.83%,协同程度为1.36,木糖产率为81.67%,协同程度为1.17。
