高糖环境下cGAS-STING通路在巨噬细胞活化中的作用
2021-12-28韩东宛刁宗礼黄红东刘文虎
韩 雪 韩东宛 刁宗礼 黄红东 刘文虎
研究表明,糖尿病肾病(diabetic nephropathy, DN)是一种慢性免疫炎性疾病,巨噬细胞活化在DN炎性过程中发挥关键性作用[1]。巨噬细胞浸润、细胞信号及细胞因子共同参与了DN的发生、发展过程[2]。
干扰素基因激活蛋白(stimulator of interferon genes,STING)是一种内质网膜蛋白,环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)能够激活STING,cGAS-STING信号通路可通过调控多种细胞信号表达引发固有免疫应答及炎性反应,是多种慢性免疫炎性疾病的潜在发病机制[3~5]。目前该信号通路在DN中的作用尚不清楚。
本研究在人体及细胞水平观察高糖环境下,巨噬细胞cGAS-STING信号通路的表达情况,并明确该通路对巨噬细胞活化的影响,初步探讨cGAS-STING信号通路在DN慢性炎性反应过程中可能的生物学功能。
材料与方法
1.主要材料:小鼠单核-吞噬细胞系RAW264.7购自美国ATCC公司;DMEM培养基等购自美国Gibco公司;cGAS抗体、STING抗体、p65 NF-κB及p-p65 NF-κB等抗体购自美国CST公司;CD11b、F4/80、CD86、CD206等流式抗体购自美国Biolegend公司;STING抑制剂C-176购自美国MCE公司;引物购自生工生物工程(上海)股份有限公司。
2.免疫组织化学实验:以瘤旁正常肾组织为对照,检测DN患者肾组织M1型巨噬细胞标志物CD86及STING的表达。石蜡切片脱蜡、水化、自来水冲洗、对组织进行抗原修复;加用非特异染色阻断剂室温孵育10min;除去阻断剂后加入一抗室温孵育60min;加入二抗室温孵育10min;DAB染色液显色、核固红复染、封片。
3.免疫荧光双染实验:以瘤旁正常肾组织为对照,检测DN患者肾组织M1型巨噬细胞标志物CD86及STING的表达。石蜡切片脱蜡、水化、自来水冲洗、对组织进行抗原修复;0.5%Triton X-100室温下通透20min,5%BSA室温封闭30min;加入STING一抗4℃孵育过夜;加入二抗室温孵育60min,5%BSA室温封闭30min;加入CD86一抗4℃孵育过夜;再加入二抗室温孵育60min;冲洗、封片、4℃保存。
4.细胞培养及分组:细胞以4×104个/毫升的浓度接种于含10%胎牛血清、1%青链霉素的RPMI 1640培养基,在37℃、5%CO2培养箱中培养,待细胞生长至80%融合状态时,0.25%胰蛋白酶消化进行传代。细胞分组:①正常对照组(NG组):培养基中葡萄糖浓度为5.5mmol/L;②高糖组(HG组):培养基中葡萄糖浓度为30mmol/L;③HG+C-176组:STING抑制剂C-176的浓度为1μmol/L;④NG+C-176 组: C-176浓度为1μmol/L。
5.Western blot法检测:胰酶消化细胞,向细胞沉淀中加入蛋白酶抑制剂和细胞裂解液(二者比例为1∶100),BCA法测定样本蛋白浓度;根据目的蛋白相对分子质量,配制分离胶、浓缩胶;经历上样、电泳、转膜后将膜完全浸没于5%脱脂奶粉中,摇床孵育1h;然后将膜与相应一抗一起孵育,4℃过夜;将膜与二抗一起孵育,室温40min;最后曝光、定影。
6.RT-PCR实验:应用Trizol法提取细胞总mRNA,采用20 μl反转录体系获得cDNA。用RT-PCR法检测扩增基因片段,反应条件:第1步50℃ 2min,第2步95℃ 10min,第3步95℃ 15s,第4步60℃ 1min,扩增40个循环。以荧光强度为纵坐标,循环数为横坐标,绘制曲线,计算阈值。cGAS上游引物为5′-ATCTGCCTGCTTCTGCCATTGG-3′,下游引物为5′-GCGTGAGGACTTGAGTTGAGACC-3′;STING上游引物为5′-CCAAGAACCCACAGACGGAAACAG-3′,下游引物为5′-TCAGATGAGGTCAGTGCGGAGTG-3′;p65 NF-κB上游引物为5′-GGCTACACAGGACCAGGAACAGT-3′,下游引物为5′-TTGCTCCAGGT-CTCGCTTCTTCA-3′;TNF-α上游引物为5′-TAACTTAGAAAGGGGATTATGGCT-3′,下游引物为5′-TGGAAAGGTCTGAAGGTAGGAA-3′;IL-1β上游引物为5′-ACAAGGAGAACCAAGCAACGACAA-3′,下游引物为5′-TGTGAGGTGCTGATGTACCAGTTG-3′。
7.流式细胞术实验:消化细胞,离心,PBS重悬,吸取细胞悬液于流式管内,冰上孵育30min,应用流式表面抗体F4/80、CD11b、CD86标记M1型巨噬细胞, 应用F4/80、CD11b、CD206标记M2型巨噬细胞,添加荧光一抗,避光4℃孵育30min,洗涤,4℃,1000r/min,离心5min除去未结合的抗体,PBS重悬细胞沉淀后上流式细胞仪检测。

结 果
1.STING在DN患者肾脏的表达及定位:免疫组织化学结果显示,与NG组比较,DN患者肾脏CD86+M1型巨噬细胞明显浸润、STING表达量明显增加(图1A);免疫荧光双染结果显示,与NG组比较,DN患者肾脏CD86+M1型巨噬细胞明显浸润、STING表达量明显增加,且二者存在共定位(图1B)。

图1 正常对照及DN患者肾组织M1型巨噬细胞标志物CD86及STING的表达A.免疫组织化学法;B.免疫荧光双染法(×1000)
2.cGAS-STING信号通路对巨噬细胞活化表型的影响:流式细胞术结果显示,与NG组比较,HG组巨噬细胞主要向M1型(F4/80、CD11b、CD86阳性)巨噬细胞转化,其比例明显增加,STING抑制剂C-176可明显降低HG组M1型巨噬细胞的比例,差异有统计学意义(P<0.05,图2)。各组M2型巨噬细胞比例比较,差异无统计学意义。
3.cGAS-STING信号通路对下游p-p65 NF-κB表达的影响:Western blot法检测及RT-PCR结果表明,HG组巨噬细胞cGAS、STING、p-p65 NF-κB的蛋白表达及mRNA表达量均明显高于NG组,STING抑制剂C-176可明显抑制STING、p-p65 NF-κB的蛋白及mRNA表达水平,差异有统计学意义(P<0.05,图3和图4)。
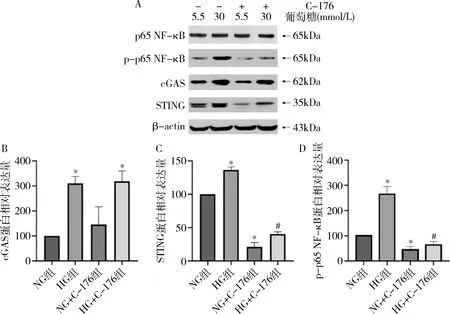
图3 STING抑制剂C-176对cGAS-STING及p-p65 NF-κB蛋白表达的影响A.Western blot法检测结果;B.cGAS相对表达量; C.STING相对表达量;D.p-p65 NF-κB相对表达量。与NG组比较,*P<0.05;与HG组比较,#P<0.05

图4 STING抑制剂C-176对cGAS-STING及p-p65 NF-κB mRNA表达的影响A.cGAS 相对表达量;B.STING相对表达量;C.p-p65 NF-κB 相对表达量。与NG组比较,*P<0.05;与HG组比较,#P<0.05
4.cGAS-STING信号通路对下游炎性细胞因子表达的影响:RT-PCR结果表明HG组巨噬细胞炎性细胞因子TNF-α和IL-1β的mRNA表达量均明显高于NG组,STING抑制剂C-176可明显抑制上述两种指标的表达,差异有统计学意义(P<0.05,图5)。

图5 STING抑制剂C-176对炎性细胞因子表达的影响(RT-PCR)A.TNF-α 相对表达量; B.IL-1β 相对表达量。与NG组比较,*P<0.05;与HG组比较,#P<0.05
讨 论
DN是糖尿病最严重的微血管并发症之一,DN导致的慢性肾衰竭已成为血液透析和肾移植的首位病因[6]。研究其发病机制、寻找新的治疗靶点具有重大意义。
DN诊断标准:有明确DM病史,同时与尿蛋白、肾功能变化存在因果关系,并排除其他原发性、继发性肾小球疾病与系统性疾病,符合以下3种情况之一者,可诊断DN。3种情况为随机尿白蛋白/肌酐比值≥30mg/g或尿白蛋白排泄率≥30mg/24h,且在3~6个月内重复检查,3次中有2次达到或超过临界值,并排除感染等其他干扰因素;估算肾小球滤过率<60ml/(min·1.73m2) 3个月以上;肾活检符合DN病理改变[7]。
肾脏慢性微炎性状态已被证实参与了DN的发生、发展过程[1]。巨噬细胞活化在DN的炎性过程中发挥着关键作用,DN早期,巨噬细胞作为最主要的炎性细胞浸润在肾脏组织中。在DN中造成肾脏损伤的巨噬细胞主要是M1型巨噬细胞,主要表现为促炎、促损伤作用,其标志物主要有iNOS、CD11c、CD68、CD86等。M2型巨噬细胞在主要发挥抗炎及促进组织修复的作用,标志物主要有Arg-1、CD206、CD11b等[2, 8]。NF-κB 信号通路是参与DN巨噬细胞活化的主要胞内信号转导通路。在体内持续高糖刺激下,成熟巨噬细胞活化为M1型巨噬细胞,NF-κB信号通路被激活后释放大量炎性细胞因子如TNF-α、IL-1β等,进而诱导肾脏局部慢性炎性反应,促使肾小球系膜细胞基质增生、成纤维细胞增殖、足细胞损伤等病理过程,最终加速肾脏纤维化[9, 10]。
STING在多种细胞中普遍表达,如巨噬细胞、内皮细胞、上皮细胞等[3]。最初对STING的研究主要集中在微生物感染性疾病,STING的激活始动于细胞质内异常DNA,如细菌及病毒DNA,cGAS能够识别并结合异常DNA,通过自身结构改变分解DNA合成环磷酸鸟苷酸腺苷酸,随后激活内质网膜上的STING,活化的STING离开内质网,移动到细胞核周围,诱导Ⅰ型干扰素表达,最终引发固有免疫应答及炎性反应[4, 11]。此外,STING还可直接激活NF-κB信号通路促进炎性反应[12]。研究表明cGAS-STING通路的激活可能是多种慢性免疫炎性疾病的发病机制,如恶性肿瘤、系统性红斑狼疮、急性胰腺炎等[13~15]。动物实验表明抑制STING活性可明显改善急性心肌梗死后小鼠的病理性心肌重塑[16]。在脂肪肝炎小鼠模型中,肝脏巨噬细胞STING表达增加,STING可通过介导巨噬细胞活化激活NF-κB信号通路、促进炎性细胞因子表达,诱发肝脏炎性及纤维化[17]。
目前cGAS-STING信号通路是否参与DN的调控尚不清楚,笔者推测在DN慢性微炎性状态下,肾脏cGAS-STING通路极有可能表达上调。为验证该假设,本研究检测DN患者肾组织STING的免疫组织化学表达水平,并利用免疫荧光双染技术对STING及巨噬细胞进行定位,结果表明DN患者肾脏CD86+M1型巨噬细胞明显浸润、STING表达量明显增加,且二者存在共定位。为进一步明确巨噬细胞cGAS-STING通路在DN中的作用,本研究应用Western blot法、RT-PCR等技术对小鼠巨噬细胞RAW264.7进行体外实验,给予高糖刺激,结果表明高糖环境下,巨噬细胞cGAS-STING信号通路被激活、巨噬细胞向M1型活化,同时p-p65 NF-κB信号蛋白表达上调、炎性细胞因子TNF-α和IL-1β释放增加;加入STING抑制剂C-176可明显抑制M1型巨噬细胞活化及下游炎性蛋白、炎性细胞因子的表达。以上结果证实,高糖环境下,巨噬细胞cGAS-STING信号通路被激活,该通路可进一步促进M1型巨噬细胞活化及下游炎性反应。但高糖环境下cGAS-STING被激活的分子生物学机制目前仍不清楚。线粒体功能障碍已被证实参与DN的发生、发展,与高糖诱导的氧化应激有关[18~20]。cGAS-STING通路可被线粒体损伤释放入胞质的线粒体DNA(mitochondrial DNA,mtDNA)所激活[21]。因此推测,高糖环境下巨噬细胞极有可能发生线粒体功能障碍,随之mtDNA逃逸至胞质激活cGAS-STING信号通路,进而介导巨噬细胞活化。今后课题组拟进一步完成高糖环境下巨噬细胞的线粒体功能检测。
综上所述,本研究在人体水平证实STING在DN患者肾脏M1型巨噬细胞中表达上调。进一步通过细胞水平表明高糖环境下,cGAS-STING通路被激活并介导M1型巨噬细胞活化,进而促进下游炎性反应。
本研究探索cGAS-STING信号通路在DN慢性免疫炎性反应过程中的作用,初步阐明cGAS-STING介导巨噬细胞活化、促进下游炎性反应的生物学功能。今后将继续探讨该通路介导巨噬细胞活化的分子生物学机制,并进行动物实验进一步加以验证。该研究拟为DN的分子免疫治疗提供新的理论依据和实验数据。
