lncRNA ACTA2-AS1通过靶向下调miR-586表达抑制子宫内膜癌生物学行为的研究
2021-12-28刘雨欣
刘雨欣 秦 黎 王 琳 蔡 晶 余 莉
子宫内膜癌是对女性健康生命危害最大的恶性肿瘤之一,其细胞增殖较快、迁移性较强,因而恶性程度较高[1]。子宫内膜癌位居妇科生殖系统肿瘤第2位,术后复发率高,患者5年生存率较低[2]。针对子宫内膜癌分子机制的研究,对于子宫内膜癌的分子靶向治疗具有重要意义。长链非编码RNA(lncRNA)是一种具有生物学功能的非编码RNA,长度往往超过200个核苷酸[3]。lncRNA广泛参与细胞的发育、增殖、迁移、衰老等生命活动,其在癌症的起始和发展环节具有重要调控功能[4, 5]。对lncRNA的深入研究可能为子宫内膜癌的筛查、诊疗、预后评估提供新的生物学标志物。目前已有报道显示,ACTA2-AS1在肝癌、肺腺癌、结肠腺癌等多种癌症组织或细胞株中低表达,发挥抑癌基因的作用[6~8]。ACTA2-AS1在子宫内膜癌组织和细胞株中的表达和作用尚未明确。本研究旨在探究ACTA2-AS1在子宫内膜癌中的表达,分析ACTA2-AS1通过靶向调控miR-586对子宫内膜癌细胞生物学行为的影响,为子宫内膜癌的诊疗提供新的分子靶点。
材料与方法
1.细胞与试剂:子宫内膜癌细胞HEC-1A、Ishikawa、AN3CA、HEC-1B及人正常子宫内膜上皮细胞ESC购自美国标准培养物保藏中心。qRT-PCR试剂盒购自日本TaKaRa公司。ACTA2-AS1过表达质粒和空白质粒(pGPU6)、miR-586 mimic、miR-NC mimic、荧光素酶报告载体(ACTA2-AS1-wt、ACTA2-AS1-mut)购自上海吉玛生物制药有限公司。Lipofectamine 2000购自美国Invitrogen公司。双荧光素酶报告基因试剂盒购自美国Promega公司。RPMI 1640培养基、胎牛血清、DMEM/F12培养基、购自美国Amresco公司。细胞周期试剂盒购自北京鼎国昌盛生物技术有限公司。一抗PTEN、β-tubulin、p-PI3K、p-AKT、p-mTOR及山羊抗兔二抗均购自美国CST公司。
2.ACTA2-AS1在子宫内膜癌组织中的表达:采用GEPIA数据库(http:∥gepia.cancer-pku.cn/index.html)分析ACTA2-AS1在子宫内膜癌组织和癌旁组织的表达水平。
3.细胞培养与转染:子宫内膜癌细胞株Ishikawa、AN3CA、ESC细胞用含10%胎牛血清的DMEM/F12培养基,HEC-1A、HEC-1B细胞用含10%胎牛血清的RPMI 1640培养基,在37℃、5%CO2培养箱中孵育。取生长状态良好的AN3CA细胞接种于12孔板,待AN3CA细胞生长融合度为30%,根据Lipofectamine 2000转染试剂说明书转染空白质粒(NC组)或ACTA2-AS1过表达质粒(ACTA2-AS1组)。
4.qRT-PCR检测ACTA2-AS1、miR-586、PTEN mRNA相对表达:用TRIzol溶液提取组织和细胞样品总RNA,进一步反转录为cDNA。ACTA2-AS1、PTEN mRNA以GAPDH为内参,miR-586以U6为内参,根据qRT-PCR试剂盒说明书扩增检测,以2-ΔΔCt公式计算ACTA2-AS1、miR-586相对表达。ACTA2-AS1上游引物为5′-GTTCTGGAGGCTGGCTTGATATGG-3′,下游引物为5′-TCCTTCA-TCGGTAGGCAACAAACG-3′;U6上游引物为5′-CTCGCTTCGGCAGCACA-3′,下游引物为5′-AACGCTTCACGAATTTGCGT-3′;miR-586上游引物为5′-ACACTCCAGCTGGGTATGCATTGTATTTTTAGGT-3′,下游引物为5′-CTCAACTGGTGTCGTGGA-3′;GAPDH上游引物为5′-CTCAGACACCATGGGGAAGGTGA-3′,下游引物为5′-ATGATCTTGAGGCTGTTGTCATA-3′;PTEN上游引物为5′-AGGGACGAACTGGTGTAATGA-3′,下游引物为5′-CTGGTCCTTACTTCCCCATAGAA-3′。
5.流式细胞法检测AN3CA细胞周期:NC组和ACTA2-AS1组AN3CA细胞用预冷的磷酸盐缓冲液洗涤5次,用预冷的乙醇溶液重悬、固定,在4℃下孵育13h。用预冷的磷酸盐缓冲液洗涤5次,用200μl RNA酶溶液重悬,37℃下孵育20min,加入40μl溴化丙锭溶液,4℃下孵育20min,用流式细胞仪检测AN3CA细胞周期。
6.细胞划痕实验检测AN3CA细胞迁移能力:NC组和ACTA2-AS1组AN3CA细胞铺于12孔板上,AN3CA细胞生长融合度为90%,用10μl的无菌移液枪枪头在12孔底划线,保证划痕为单层细胞。用预冷的磷酸盐缓冲液洗涤5次,至没有脱落的细胞存在。添加不含胎牛血清的培养基,在100倍倒置显微镜下,于0h和24h拍照并测量细胞迁移距离,计算细胞迁移率。
7.双荧光素酶报告基因检测验证ACTA2-AS1与靶基因的结合:运用LncBase v.2数据库预测ACTA2-AS1的靶基因为miR-586。在AN3CA细胞中,共转染ACTA2-AS1-wt或ACTA2-AS1-mut以及miR-586、miR-NC。共转染48h后,采用细胞裂解液收集AN3CA细胞,采用双荧光素酶报告基因检测试剂盒分析每组AN3CA细胞中荧光素酶的相对活性。
8.Western blot法检测PTEN蛋白和PI3K-AKT-mTOR信号通路蛋白表达:用RIPA裂解液提取ACTA2-AS1组和NC组AN3CA细胞总蛋白,BCA法分析蛋白浓度,每个泳道60μg蛋白的上样量行SDS-PAGE凝胶电泳,将分离蛋白电转至聚偏氟乙烯膜。10%脱脂牛奶封闭0.5h,加入一抗PTEN(1∶1000稀释)、β-tubulin(1∶3000稀释)、p-PI3K(1∶1000稀释)、p-AKT(1∶1000)、p-mTOR(1∶1000),4℃孵育13h。加入羊抗鼠二抗(1∶5000稀释),在室温下摇床孵育3h。按比例配制ECL显影发光液,在暗室内曝光、采集图像。

结 果
1.ACTA2-AS1在子宫内膜癌组织中的表达:GEPIA数据库显示,ACTA2-AS1在子宫内膜癌组织中的表达水平显著低于癌旁组织(P<0.01,图1)。

图1 ACTA2-AS1在子宫内膜癌组织和癌旁组织中的表达水平
2.ACTA2-AS1在子宫内膜癌细胞株中的表达:qRT-PCR检测显示,ACTA2-AS1在子宫内膜癌细胞(HEC-1A、Ishikawa、AN3CA、HEC-1B)及正常子宫内膜上皮细胞ESC的表达分别为0.58±0.07、0.41±0.05、0.18±0.06、0.66±0.08和1.05±0.09(图2)。与ESC细胞比较,ACTA2-AS1在子宫内膜癌细胞株中的表达明显下降(P<0.05),AN3CA细胞ACTA2-AS1表达下降最明显(P<0.01),因而采用AN3CA细胞进行研究。

图2 ACTA2-AS1在子宫内膜癌细胞株和正常子宫内膜上皮细胞中的表达水平与ESC细胞比较,*P<0.05,**P<0.01
3.转染ACTA2-AS1过表达质粒对AN3CA细胞中ACTA2-AS1表达的影响:转染ACTA2-AS1过表达质粒后,ACTA2-AS1组和NC组AN3CA细胞中ACTA2-AS1表达分别为12.26±1.12和1.21±0.20,ACTA2-AS1组ACTA2-AS1表达显著高于NC组(P<0.01)。
4.上调ACTA2-AS1对AN3CA细胞周期的影响:流式细胞法结果显示,ACTA2-AS1组和NC组AN3CA细胞在G0~G1期的细胞比例分别为61.34%±4.51%和29.73%±3.39%,上调ACTA2-AS1能明显提升G0~G1期细胞比例,诱导G0~G1期停滞(P<0.05,图3)。
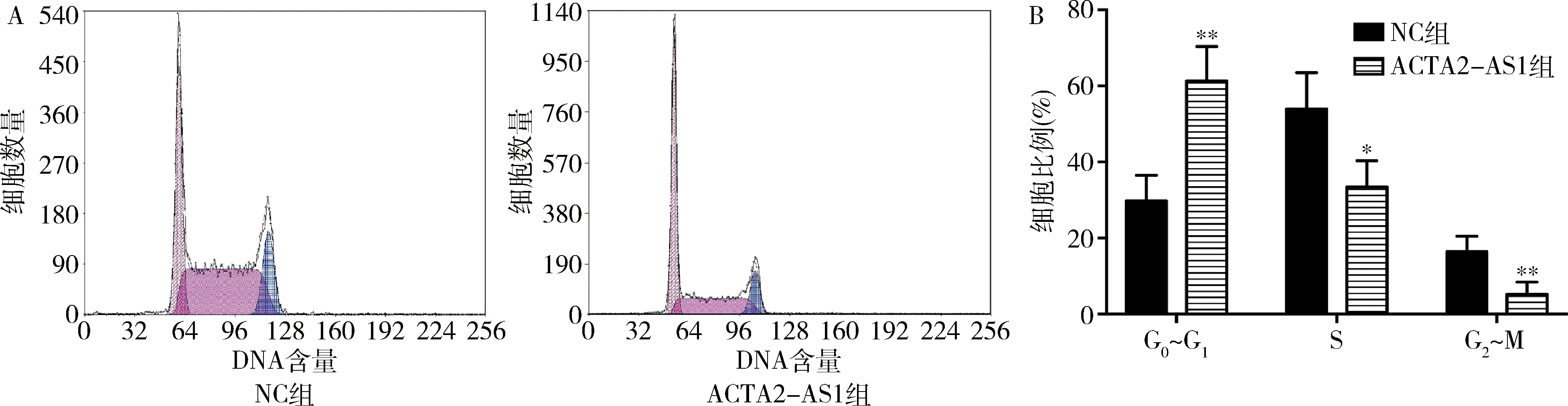
图3 上调ACTA2-AS1对AN3CA细胞周期的影响A.流式细胞法;B.细胞周期比例分析。与NC组比较,*P<0.05,**P<0.01
5.上调ACTA2-AS1对AN3CA细胞迁移能力的影响:细胞划痕实验结果显示,ACTA2-AS1组和NC组AN3CA细胞的迁移率分别为40.46%±3.76%和69.54%±6.64%,上调ACTA2-AS1可抑制AN3CA细胞的迁移能力(P<0.01,图4)。
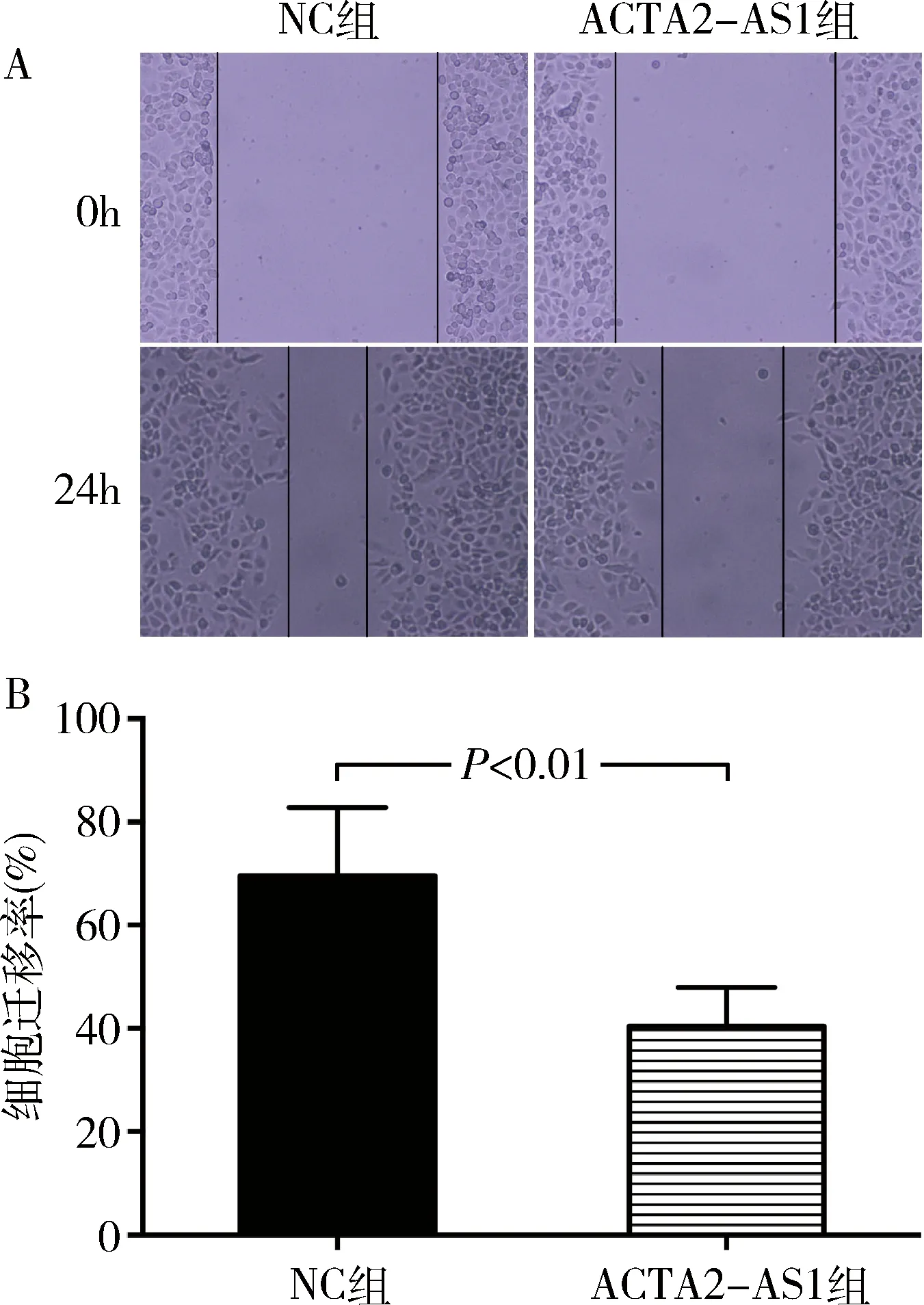
图4 上调ACTA2-AS1对AN3CA细胞迁移能力的影响A.细胞划痕实验(×100);B.细胞迁移率定量分析
6.ACTA2-AS1对miR-586的靶向位点预测:采用LncBase v.2数据库预测ACTA2-AS1的潜在靶基因,ACTA2-AS1与miR-586具有潜在的互补结合位点(图5)。

图5 LncBase v.2数据库预测ACTA2-AS1的潜在靶基因
7.双荧光素酶报告基因检测验证ACTA2-AS1对miR-586的靶向调控:双荧光素酶报告基因检测结果显示,在AN3CA细胞中,与共转染ACTA2-AS1-wt和miR-NC比较,共转染ACTA2-AS1-wt和miR-586后相对荧光素酶活性明显下降(P<0.01),ACTA2-AS1能够靶向调控miR-586(图6)。

图6 双荧光素酶报告基因法验证ACTA2-AS1对miR-586的靶向调控与miR-NC组比较,*P<0.01
8.上调ACTA2-AS1对miR-586和PTEN mRNA表达的影响:qRT-PCR检测结果显示,ACTA2-AS1组和NC组AN3CA细胞中miR-586表达分别为0.21±0.05和1.12±0.09,上调ACTA2-AS1可抑制miR-586表达(P<0.01)。ACTA2-AS1组和NC组AN3CA细胞中PTEN mRNA表达分别为6.11±1.76和1.23±0.53,上调ACTA2-AS1可促进PTEN mRNA表达(P<0.01)。
9.上调ACTA2-AS1对PTEN蛋白和PI3K-AKT-mTOR信号通路蛋白表达的影响:Western blot法检测结果显示,上调ACTA2-AS1表达后,PTEN蛋白表达升高,PI3K-AKT-mTOR信号通路蛋白p-PI3K、p-AKT、p-mTOR表达降低(图7)。
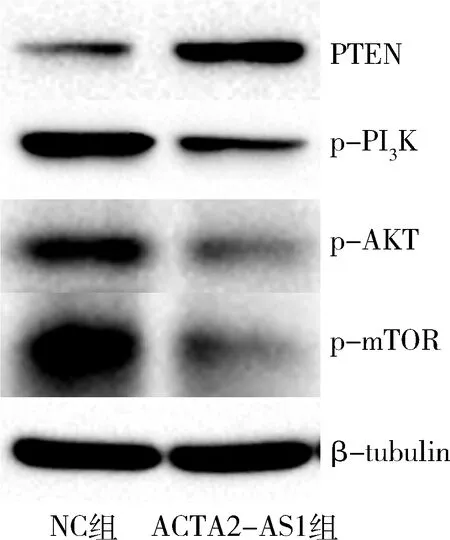
图7 上调ACTA2-AS1对AN3CA细胞PTEN蛋白和PI3K-AKT-mTOR信号通路蛋白表达的影响
讨 论
lncRNA在细胞内发挥广泛的基因表达调节功能,其异常表达可诱导细胞活动的紊乱,引起肿瘤的发生[9]。不同的lncRNA在同一种肿瘤细胞中的功能不同,可能为抑癌基因,也可能为癌基因[10]。lncRNA如LA16c-313D11.11在子宫内膜癌组织中的表达水平显著降低,其可充当miR-205-5p的海绵分子,间接增加PTEN基因的表达,抑制子宫内膜癌细胞的侵袭、迁移和活力[11]。lncRNA如RHPN1-AS1、UCA1、DLX6-AS1、CHL1-AS1等在子宫内膜癌组织和细胞株中表达均显著上调,与子宫内膜癌的分期、组织学分级、淋巴结转移、不良预后等显著相关,促进子宫内膜癌细胞的周期进展、迁移以及侵袭[12~15]。近年来,ACTA2-AS1已被证实与多种肿瘤的发生和发展有关。Ying等[8]研究发现,ACTA2-AS1在肺腺癌组织和细胞株中低表达,上调ACTA2-AS1可抑制肺腺癌细胞的上皮间充质转化并诱导细胞凋亡。其可能成为垂体泌乳素瘤发病机制的新型生物学标志物。Pan等[6]研究发现,ACTA2-AS1在结肠腺癌组织和细胞株中表达降低,其可明显抑制结肠腺癌细胞的活力和集落形成能力。
ACTA2-AS1在子宫内膜癌中的作用鲜有报道。本研究通过GEPIA数据库分析发现,ACTA2-AS1在子宫内膜癌组织中的表达水平明显低于癌旁组织,且ACTA2-AS1在子宫内膜癌细胞株中的表达水平明显低于正常子宫内膜上皮细胞,提示ACTA2-AS1表达的异常改变与子宫内膜癌的发生存在相关性。本研究利用ACTA2-AS1表达最低的AN3CA细胞进行了系列细胞实验,上调ACTA2-AS1表达可以促进G0~G1期细胞比例增加、抑制细胞的迁移能力,ACTA2-AS1在子宫内膜癌中发挥抑癌基因的作用。lncRNA通过与靶微小RNA(miRNA)以不完全或完全的碱基配对方式,降低miRNA的表达,调控细胞周期、凋亡、迁移等生物过程[16, 17]。研究ACTA2-AS1的作用机制,重点在于探究ACTA2-AS1与靶miRNA的相互结合。本研究通过LncBase v.2数据库发现,ACTA2-AS1与miR-586可能互补结合。Yang等[18]研究发现,miR-586可以促进骨肉瘤细胞的增殖、侵袭、转移,同时抑制骨肉瘤细胞的凋亡,发挥癌基因作用。
本研究通过双荧光素酶报告基因实验证实ACTA2-AS1可互补结合miR-586。qRT-PCR结果也证明了,ACTA2-AS1能负性调控miR-586的表达。这些结果提示ACTA2-AS1能直接靶向作用miR-586。Yu等[19]研究发现,miR-586通过靶向结合PTEN mRNA的非翻译区,干扰PTEN基因表达,促进癌症的发生。本研究中qRT-PCR和Western blot法均显示上调ACTA2-AS1后,PTEN基因表达降低,进一步证明ACTA2-AS1靶向作用miR-586。Zheng等[20]研究发现,PTEN通过影响PI3K-AKT-mTOR信号通路的活化,抑制子宫内膜癌的进展。本研究中Western blot法检测结果显示,上调ACTA2-AS1后,PI3K-AKT-mTOR信号通路活化被抑制。
综上所述,本研究观察到ACTA2-AS1在子宫内膜癌组织和细胞株中存在异常低表达。对于存在PI3K-AKT-mTOR信号通路的子宫内膜癌类型,上调ACTA2-AS1表达通过靶向调控miR-586,促进PTEN基因表达和抑制PI3K-AKT-mTOR信号通路活化,抑制子宫内膜癌细胞周期和迁移。ACTA2-AS1可能为子宫内膜癌的靶向治疗提供了新的靶点和实验依据。
