RNA干扰技术与害虫防治
2021-12-25张建珍柴林史学凯高璐范云鹤
张建珍,柴林,史学凯 ,高璐 ,范云鹤
(1.山西大学 应用生物学研究所,山西 太原 030006;2.山西大学 生命科学学院,山西 太原 030006)
0 RNA干扰技术简介
RNA干扰(RNA interference,RNAi)是一种广泛存在于真核生物的转录后基因沉默现象,其原理是双链RNA(double-stranded RNA,dsRNA)可引起生物体内同源序列mRNA特异性地降解。RNAi现象最早由NAPOLI和JORGENSEN在研究矮牵牛(Petuniahybrida)的花色时报道:插入强启动子后,本应高表达的查耳酮合成酶(chalcone synthase,CHS)基因受到抑制,致使花色变浅,并称之为共抑制(cosuppression)[1]。1991年 FIRE 等向秀丽隐杆线虫(Caenorhabditiselegans)注射unc-22的反义链RNA(antisense RNA,asRNA)后,引发肌肉抽搐的表型,证明asRNA可以抑制基因的表达[2]。之后,GUO和KEMPHUES研究par-1基因在线虫胚胎中的功能时发现,注射反义链RNA,可导致胚胎发育停滞,而作为阴性对照的正义RNA(sense RNA)也出现了相类似的表型,导致par-1mRNA的降解[3]。直到1998年,FIRE等通过严格制备并纯化unc-22基因的正义ssRNA、反义ssRNA和dsRNA,并等量注射入秀丽隐杆线虫性腺后,发现dsRNA可引起基因沉默,而ssRNA导入线虫体内则很快被降解[4]。以上的发现促进了RNA干扰技术的快速发展,为广泛研究生物的基因功能提供了高效便捷的技术途径。
小干扰RNA(small interference RNA,siRNA)是一类长度为21 nt~23 nt的双链RNA,根据其来源可分为内源性siRNA(endo-siRNA)和外源性siRNA(exo-siRNA)[4]。外源 dsRNA 进入生物体后,会被自身的核心酶系统降解为外源性siRNA进而发挥作用。siRNA通路的作用机制为:外源或内源产生的dsRNA在Dicer2酶的作用下,切割为长度为21 nt~23 nt、5′端含有一个磷酸基团、3′端含有一个羟基且突出2 nt悬垂的siRNA;随后siRNA在Dicer2及其协助蛋白R2D2的帮助下,将与siRNA诱导的沉默复合体(siRNA-induced silencing complex,siRISC)结合[5];随即,其正义链被降解,激活后的RISC在反义链的引导下,通过碱基互补配对原则识别靶标mRNA,由Agonaute2(AGO2)切割与靶标mRNA碱基互补序列,从而导致靶基因快速和持续性沉默[6]。
RNAi技术由于其高效性和特异性,在许多生物,特别是非模式生物中得到了广泛应用。KENNERDELL和CARTHEW(1998)首次将dsRNA应用于黑腹果蝇(Drosophilamelanogaster)胚胎frizzled基因功能研究,之后,RNAi逐渐成为研究基因功能的强有力工具。近年来,RNAi技术在害虫防治方面也呈现出巨大潜力。如2007年美国孟山都公司研究人员在玉米中表达可干扰玉米根萤叶甲(Diabroticavirgiferavirgifera)V-ATPaseA基因的dsRNA,将其喂食玉米根萤叶甲后,导致幼虫发育异常并死亡[7]。随后该公司研发表达dsRNA的转基因玉米于2017年获得美国FDA批准。因此,RNAi技术有望成为害虫防控领域的有效手段。
1 dsRNA进入虫体发挥作用的关键环节
外源dsRNA从进入虫体到发挥RNAi作用需要经过几个关键环节,包括dsRNA的稳定性、dsRNA在细胞内的吸收、转运和逃逸以及dsRNA被核心酶系统加工为siRNA的效率。这些关键环节将会影响昆虫的RNA干扰效率。
1.1 dsRNA的稳定性
在RNAi过程中,通过注射法或饲喂法导入虫体的dsRNA,首先存在于血淋巴液或肠液中,随后被血腔组织细胞或肠上皮细胞吸收。越来越多的证据表明dsRNA在进入细胞前保持完整性是保证RNAi效率的关键因素之一,而核酸降解酶(dsRN-ases)是最为关键的作用因子。大量研究表明,昆虫中肠特异性的dsRNases对RNAi效率具有显著的影响,通过RNAi抑制马铃薯甲虫(Leptinotarsadecemlineata),沙漠蝗(Schistocercagregaria)和烟草天蛾(Manducasexta)等昆虫dsRNases的表达后,能够显著降低dsRNA的降解,从而提升dsRNA在昆虫体内的稳定性和持续性,增强RNAi效应[8-10]。本课题组成功解析了飞蝗(Locustamigratoria)饲喂dsRNA干扰无效的机制,发现LmdsRNase2在飞蝗中肠高表达,随后分泌到中肠液中,在pH 6~10的胞外环境条件下可快速降解dsRNA,破坏其完整性,从而导致RNA干扰无效。对血淋巴特异表达的核酸酶进行研究表明,飞蝗dsRNases受血淋巴液或肠液pH条件的限制,最终影响RNAi的效率[11-12]。
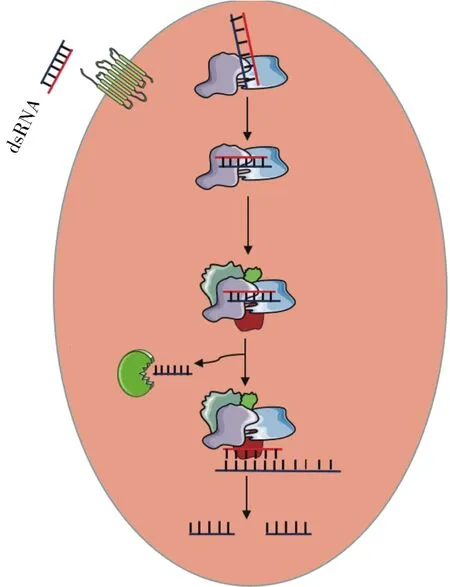
图1 siRNA通路示意图Fig.1 Diagrammatic sketch of siRNA pathway
1.2 dsRNA的吸收、转运和逃逸
环境中的dsRNA能否吸收进入昆虫细胞及能否从内体(Endosome)成功逃逸,是决定RNAi效率的第二个关键环节。研究表明,外源dsRNA主要通过跨膜通道蛋白SID介导的吸收和细胞内吞作用进入细胞。2002年,Winston等首次在秀丽隐杆线虫(C.elegans)中发现系统性 RNAi缺陷基因 1(systemic RNA interference defective 1,SID-1)参 与dsRNA的吸收[13]。随后,人们发现部分昆虫中也存在SID-1同源基因,然而该基因并不是吸收dsRNA所必需的。已有研究表明沙漠蝗和赤拟谷盗(Triboliumcastaneum)均具有SID-1基因,但沉默该基因后并不影响RNAi效率,说明SID-1并不参与上述昆虫的RNAi。2006年,ULVILA等首次发现dsRNA通过网格蛋白依赖的内吞途径进入黑腹果蝇(D.melanogaster)S2 细胞[14]。自此,dsRNA 通过内吞作用进入细胞的机制日益受到关注。多种内吞途径参与核酸的吸收,包括网格蛋白(Clathrin)介导的内吞、小窝/脂筏介导的内吞、大型胞饮依赖的内吞、吞噬作用依赖的内吞等,由于载体的多样性导致内吞途径有所差异。研究发现,沙漠蝗、赤拟谷盗和马铃薯甲虫等昆虫均可通过网格蛋白依赖的内吞途径吸收dsRNA[15]。GILLET等报道,dsRNA可依赖大型胞饮途径进入棉铃象甲(Anthonomusgrandis)中肠细胞[16];其他类型的胞吞途径是否参与昆虫细胞吸收dsRNA尚未见报道。当外源dsRNA进入细胞后,dsRNA可快速地进入早期内体中(Early endosome),在Rab等蛋白的参与下转运进入晚期内体(Late endosome),晚期内体与溶酶体(Lysosome)发生融合,并被溶酶体降解。dsRNA吸收进入细胞后能否在早期内体和晚期内体成功逃逸与RNAi效率相关。此外,晚期内体的形成和转运也会影响昆虫RNAi效率。克服这些dsRNA逃逸的障碍,可提高RNA干扰的效率。
1.3 RNAi核心酶系统
从内体成功逃逸的dsRNA被RNAi核心酶系统加工为siRNA的效率,是决定RNAi的第三个关键环节。RNAi核心酶主要包括Dicer与Argonaute,首先,dsRNA被Dicer剪切为siRNA,之后,其反义链与Argonaute蛋白组装成RNA诱导沉默复合体(RNA-induced silencing complex,RISC),降解目标mRNA[17]。研究发现,不同昆虫RNAi途径关键因子的数目及表达丰度存在差异,这与RNAi效率密切相关。2012年,WYNANT等发现沙漠蝗生殖系统微弱的RNAi与核心酶基因Dicer2和Argonaute2在精巢和卵巢中的低表达密切相关[18];2016年,YOON等在马铃薯甲虫中发现了两个Dicer2(Dicer2a和Dicer2b)基因,这一发现可解释马铃薯甲虫相较其他昆虫物种对RNAi更为敏感的原因[15]。2018年,YOON等发现在鞘翅目昆虫中存在一种特有的Staufen蛋白,称为StaufenC,其在马铃薯甲虫中参与dsRNA的剪切过程[19]。基于此,通过进一步研究RNAi核心酶基因及鉴定参与昆虫siRNA途径关键因子,可以更加深入地阐释不同昆虫RNAi效率的差异机制,从而实现RNAi技术在害虫防控中的高效应用。dsRNA在虫体发挥作用的关键环节见图2。
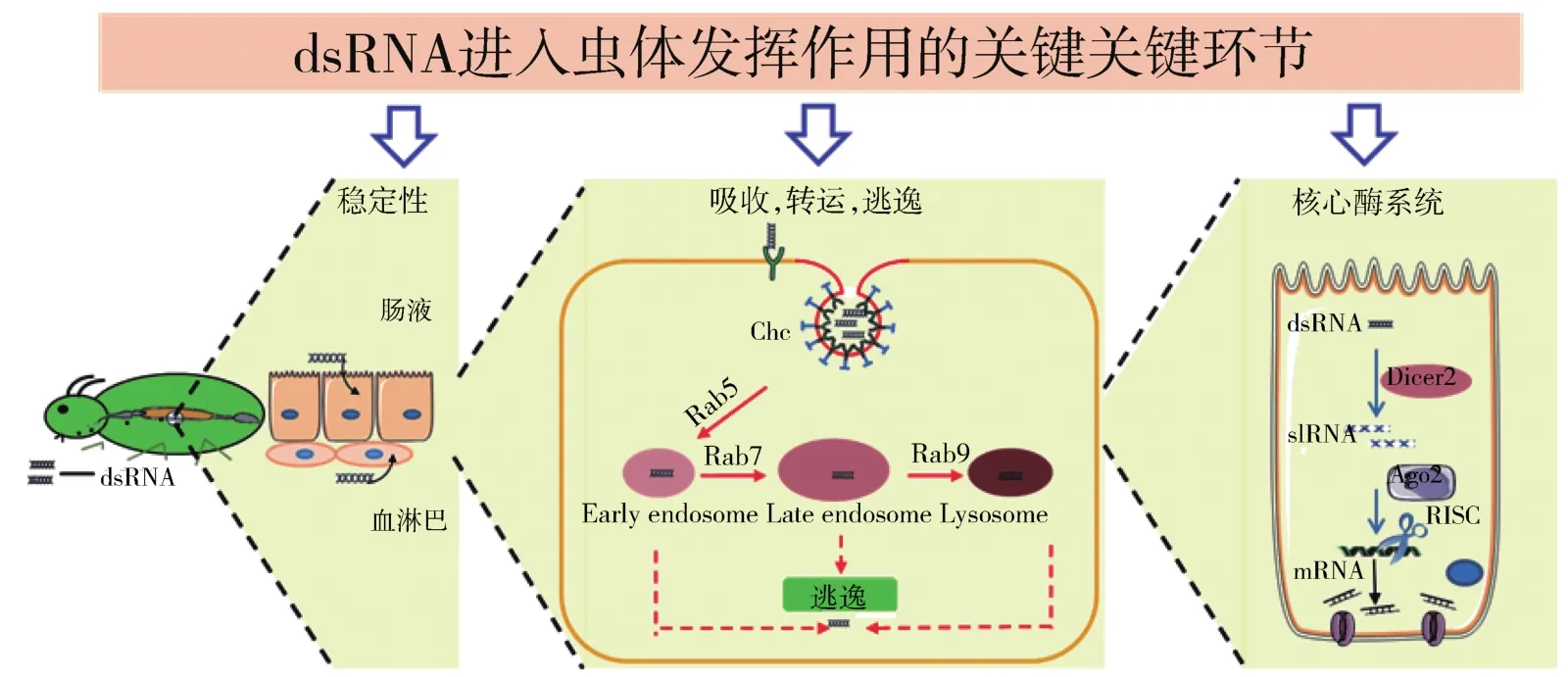
图2 dsRNA在虫体中发挥作用的关键环节Fig.2 Key steps for the roles played by dsRNA in insects
2 RNA干扰技术在害虫防治中的应用
2.1 RNA干扰用于害虫防治的优势
目前防治害虫主要采用传统的农业防治、化学防治、物理防治和生物防治等方法。农业防治主要是通过利用耕作栽培技术的改善,控制害虫种群数量。化学防治是利用马拉硫磷、西维因和溴氰菊酯等化学农药防治害虫。物理防治主要是粘板诱杀、人工或诱虫灯捕捉害虫等。生物防治主要是利用瓢虫、寄生蜂等天敌进行害虫防治。然而传统的害虫防治方法面临如下问题:1)害虫对常用化学杀虫剂产生抗药性,农药残留导致环境污染,防治成本提高,并造成严重的生物安全问题;2)传统的农业防治、物理防治和生物防治起效慢,杀虫效率低。
RNAi作为新型的害虫防控技术[20]具有许多传统方法无法比拟的特点和优势:1)特异性:可通过选择dsRNA序列区域,针对性地降解靶标基因的mRNA;2)广谱性:目前已在鞘翅目、直翅目、膜翅目、半翅目、双翅目和鳞翅目等多种重要农业害虫中开展了RNA干扰技术研究,均取得良好的防治效果;3)高效性:dsRNA介导的RNAi在生物体中以催化放大的方式进行,少量的dsRNA就能有效地抑制靶基因的表达;4)系统性:RNAi效应可以在害虫全身甚至在世代间传递,可明显提高RNA干扰效率[21];5)环境安全性:残留的dsRNA在自然界极易降解,无残留,对环境无毒无害,相对安全。国际上普遍认为RNAi技术在害虫防治中具有潜在的应用价值,可为农业的可持续发展提供新路径。
2.2 RNA干扰技术用于害虫防治的关键因素
RNAi作为新型的害虫防控技术,靶标基因的筛选以及将dsRNA高效递送至靶标生物是其规模化应用的关键因素。
2.2.1 靶标基因的选择
合适的靶标基因是RNAi防治技术成功应用的关键。与昆虫生长发育及生存密切相关的功能基因是RNAi防治靶标基因的首选,通过设计基因特异的dsRNA片段,以达到高效和无脱靶风险的害虫防治效果。目前研究较多的靶基因可分为:①昆虫特有的靶标基因,如本课题组长期研究的几丁质酶基因,这类基因特异性强,安全性高,不会对其他非靶标生物造成为害;②高效安全的管家基因,如Snf7基因[22];③与害虫抗性或免疫相关的基因,如P450酶基因[23];④与害虫行为有关的基因,如与食性、繁殖等有关基因(卵黄原蛋白受体)等[24]。
2.2.2 高效运载体系
将RNAi技术应用于害虫防治,必须具有高效的运载体系。在选定合适的靶基因后,有效导入害虫体内的dsRNA剂量是田间防治害虫的关键因素。实验室合成dsRNA通常借助商品化的试剂盒,不仅合成量少且造价高,且很难满足田间大规模应用。因此,高效的dsRNA运载体系(如植物介导表达dsRNA、微生物表达dsRNA和纳米材料等)是RNA生物农药研发和推广的重要技术平台。表1列举了高效运载体系在RNA生物农药研发中的成功应用。
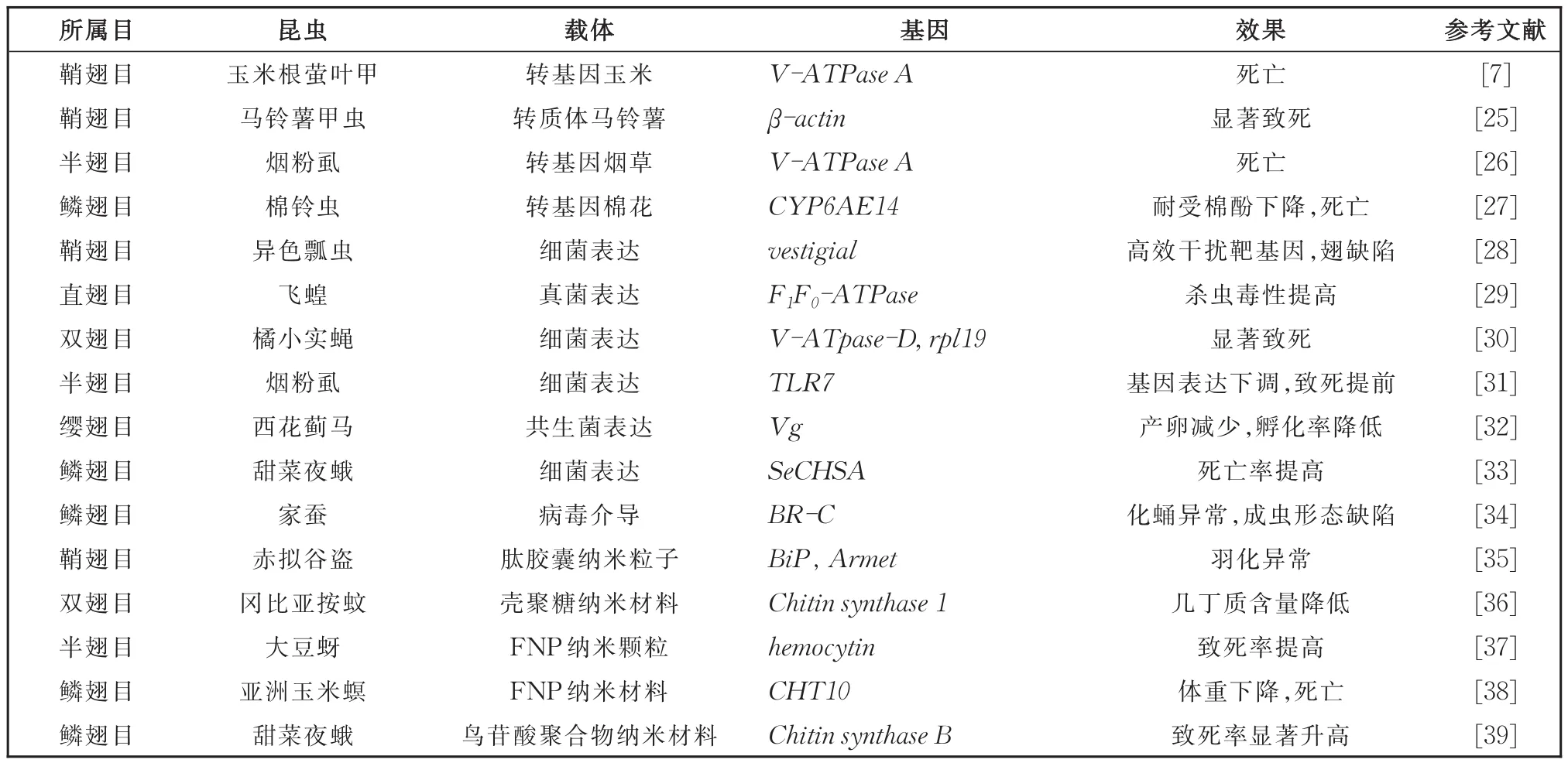
表1 高效运载体系介导的RNAi在害虫防治中的成功应用Table 1 Successful applications of high efficiency delivery system-mediated RNAinterference
2.3 RNA生物农药的研发
RNAi主要通过双链RNA(dsRNA或siRNA)诱导而沉默靶基因,因此基于RNAi技术开发的生物农药,被称为RNA生物农药。RNA生物农药以dsRNA与基因序列互补为基础,沉默靶标生物目的基因,使昆虫生长发育异常,从而达到防治害虫的目的。RNA生物农药的研发主要技术包括以下几种。
2.3.1 植物介导表达dsRNA
通过转基因技术将害虫靶标基因的dsRNA在植物体中表达,害虫取食含有dsRNA的植物组织后生长发育受阻,生存率下降,种群数量减少,从而达到防治目的。已在玉米、棉花、烟草和马铃薯等有应用报道(表1),主要针对鳞翅目、鞘翅目和半翅目等咀嚼式和刺吸式口器害虫。
2.3.2 微生物表达dsRNA
常见的微生物表达dsRNA方法有病毒介导法与工程菌介导法。病毒介导法是利用病毒可侵染昆虫的特性,在寄主昆虫体内复制形成靶标基因的dsRNA,以获得RNAi效果。如寄生于家蚕的重组病毒产生靶向BR-C基因的dsRNA使家蚕幼虫不能化蛹、成虫形态缺陷[34]。工程菌介导法是通过构建可以表达靶基因dsRNA的载体,将其转入细菌和真菌等微生物,获得大量的dsRNA(表1)。其中缺失RNaseIII的细菌HT115大量表达dsRNA应用较为广泛,将其与饲料混合饲喂害虫,以提高RNA生物农药的防效。
2.3.3 纳米材料携带dsRNA
纳米颗粒携带dsRNA是RNA生物农药应用的又一种方法,其原理是利用纳米颗粒通过静电作用和范德华力与dsRNA结合,以提高dsRNA在昆虫体内的稳定性,保护dsRNA不受核酸酶和昆虫体内环境的影响,从而提高RNAi效率,促进RNA生物农药的防效。选择毒性低且易于被细胞高效吸收的纳米颗粒[38],可大幅提升dsRNA的应用价值(表1)。
2.3.4 化学合成dsRNA
实验室常用T7 RNA聚合酶(T7 RNA polymerase)体外合成dsRNA,该酶的特点是不需要其他蛋白因子参与就能够独立行使转录功能。此外,T7 RNA聚合酶只能特异性地识别T7启动子,且合成延伸速率较快。因此,通过T7 RNA聚合酶可以在体外条件下快速地合成dsRNA。另一种合成dsRNA的方法为传统的化学合成核酸序列,主要通过对碱基的去保护、偶联、加帽和氧化等步骤,逐步循环添加新的核苷酸,最终得到目标核酸序列,但价格昂贵,合成效率低,有机杂质多。无论是体外转录法还是化学合成法都限于小规模的RNAi实验,很难在田间进行大规模推广与应用。因此,关于RNA生物农药的研发与推广方面,多数科研人员聚焦于前三种方法(表1)。
3 RNA干扰技术用于害虫防治的制约因素及应对策略
3.1 制约RNAi技术在害虫防治中应用的因素
RNAi技术已广泛应用于基因功能研究,由于其高效性和特异性,有望成为第四代杀虫剂的核心技术。但迄今为止,RNAi技术的应用还存在一定的限制因素,其中主要制约因素是RNAi效率问题。不同的昆虫类群RNAi效率存在较大差异,例如鞘翅目昆虫赤拟谷盗(T.castaneum)和直翅目昆虫飞蝗(L.migratoria)RNAi效率很高[40],而鳞翅目昆虫亚洲玉米螟(Ostriniafurnacalis)的RNAi效率很低[41];同一种昆虫通过注射、饲喂或植物介导表达等不同方式导入dsRNA,其RNAi效率也存在差异,例如对飞蝗注射dsRNA干扰效率很高,而饲喂dsRNA则无干扰效果[11]。
影响RNAi效率的因素很多,当dsRNA进入虫体,首先接触的是血淋巴和肠液,因此,dsRNA在血淋巴和肠道中的稳定性将直接影响RNAi是否能被成功诱发。已有研究表明,dsRNA进入血淋巴或肠腔的稳定性与RNAi效率成正相关[42]。由于进入虫体的dsRNA被核酸外切酶所降解,导致RNAi效率低下[9-11,41]。除此之外,靶基因的选择也会影响RNAi效率,2011年,TERENIUS等总结了鳞翅目昆虫中150个基因的RNAi效率,发现与免疫相关的基因容易被干扰,而上皮组织中表达的基因则相对更难被干扰[43]。苗雪霞等将10个靶基因的dsRNA直接喷洒在新孵化的亚洲玉米螟虫体上,发现其中9个靶基因可以引起虫体发育不良的现象,且有4个靶基因可以导致高达90%的死亡率。由此可见,同种昆虫同一干扰方式,不同的靶基因所引起的基因沉默效率显著不同[44]。另外,应用成本也是在推广过程中需要考虑的问题之一,实验室可以通过注射的方式干扰靶基因,但实际应用中饲喂和喷洒显然是更便捷且更易被推广的方式,但是饲喂和喷洒都需要消耗大量的dsRNA,而市面上体外合成dsRNA的试剂盒成本较高,所以在实际应用中选择微生物表达dsRNA,不但可以大大降低成本,还可以实现持续供给的目的。
3.2 提高RNA干扰技术应用的策略
dsRNA的稳定性是影响RNAi效率的重要因素,保证dsRNA的稳定性是提高RNAi效率的关键。研究表明,可以通过载体包裹dsRNA的策略以提高dsRNA的稳定性。近年来,纳米材料因其具有低毒性、高转染效率以及便于大量生产等特点被认为是递送dsRNA的良好载体。2010年,朱坤炎等利用壳聚糖纳米材料包裹dsRNA饲喂冈比亚按蚊幼虫,可以显著沉默靶基因[36]。沈杰等研发合成的一种阳离子核-壳荧光纳米材料(FNP)与dsRNA通过静电作用相结合,利用其荧光可追踪的特点,可以观察到该材料能够被果蝇肠上皮细胞所吸收。用FNP携带亚洲玉米螟Cht10的dsRNA饲喂亚洲玉米螟,发现其靶基因显著沉默且出现虫体显著减小的表型[38]。除提高外源dsRNA进入细胞前的稳定性外,可采用筛选高效的靶基因,通过转基因植物介导、工程菌介导和病毒介导的方式,低成本高效率地合成dsRNA的方法,并将dsRNA持续递送到害虫体内干扰其靶基因,从而实现RNAi技术在害虫防治中的应用。
4 结论与展望
化学农药的长期施用导致了环境污染、生态安全和食品安全等一系列问题,已成为制约现代农业可持续发展的瓶颈。因此,研发害虫绿色防控技术体系对推动绿色农业及生态和食品安全具有重要意义。RNAi技术已被公认为第四代杀虫剂的核心技术。2015年,美国孟山都公司培育出dsRNA与Bt蛋白共表达的转基因玉米 MON 87411[45],2017年获得美国FDA批准,并计划实现商业化。我国尚无基于RNAi技术的害虫防控产品,因此研发高效安全的核酸生物农药是植物保护领域的重要研究方向。探究昆虫RNAi机理,明确昆虫RNAi效率差异的分子机制,筛选害虫高效致死基因,研发高效运载体系将会有力地促进RNAi技术在植物保护领域的应用。
