镉对拟南芥L-半胱氨酸脱巯基酶的影响研究
2021-12-25张丽萍裴雁曦
张丽萍 ,裴雁曦*
(1.山西大学 生命科学学院,山西 太原 030006;2.特色植物资源研究与利用山西省重点实验室,山西 太原 030006)
0 引言
近年来随着H2S相关研究的日益深入,发现生理浓度的H2S在生物体中承担着调控多种生理功能的作用,与NO和CO并称为气体信号分子[1]。研究发现H2S参与植物发育的多个过程,如种子萌发、根的形态建成、光合作用、气孔运动、开花调控、延缓衰老等[2]。在植物抵抗各种环境胁迫时,H2S通过调控逆境相关基因表达、蛋白质的合成、以及对关键酶进行巯基化修饰等多种作用方式缓解胁迫造成的氧化应激反应[3]。在帮助植物抵抗重金属胁迫时,H2S可以调节植株对金属离子的转运,吸收和螯合,降低重金属离子在体内的有效含量,减少重金属对植物造成的损伤。H2S在发挥以上作用时还需要Ca2+、NO、H2O2、乙烯等信号分子的参与[4]。
20世纪80年代,人们已在多种植物中检测到H2S的释放[5-6],近年来随着H2S生理功能研究的不断深入,植物中H2S的来源也逐渐清晰:通过叶片吸收大气中的H2S;在亚硫酸盐还原酶的作用下,将SO32-直接还原成H2S;通过半胱氨酸脱巯基酶(CDes)催化Cys降解生成H2S、丙酮酸盐和NH3。最后一条途径是植物体内H2S的主要来源,CDes被认为是植物体内产生H2S的最重要的酶。根据催化底物Cys的不同构型,CDes被分为L-型CDes和D-型CDes,由于植物中富含LCys,所以对L-型CDes的研究更为深入。DES1(L-Cys desulfhydrases,At5G28030),是第一个被确定的L-型CDes,它是一种O-乙酰基-L-丝氨酸(硫醇)裂解酶,ÁLVAREZ等[7]证明其具有降解L-Cys生成H2S的功能,且催化活性需要5-磷酸吡哆醛作为助因子。NFS2(Nitrogen fixation S2,At1g08490)定位于质体,能够催化Cys降解产生单质硫和丙氨酸,也能催化含硒的Cys降解产生元素硒和丙氨酸[8]。LCD(L-Cysteine desulfhydrases,At3G62130)位于细胞核内,其功能是催化L-Cys 降解生成H2S、NH3和丙酮酸[9]。
当植物遭受重金属胁迫时,体内H2S的含量会升高。不同浓度的Cd处理后白菜(Brassicapekinensis)幼苗LCD基因表达量显著上调,内源H2S含量也随之增加,说明Cd胁迫能够激活白菜幼苗内源 H2S 的产生[10];方慧慧等[11]发现,铬胁迫通过上调LCD、DCD和DES1的基因表达,增加谷子体内的H2S产生速率。而且过表达拟南芥LCD可以增强拟南芥(Arabidopsisthaliana)对Cd的耐受[12]。以上结果表明LCD在植物应对重金属胁迫过程中是调节H2S生成的关键酶。
为了详细了解Cd这种胁迫信号是如何影响植物内源H2S产生酶LCD,提高内源H2S生成的,前期构建原核表达载体,获得了具有生成H2S能力的重组LCD蛋白,制成了LCD单克隆抗体,希望从体内、体外、分子水平、翻译后水平研究Cd对LCD的影响。
1 材料与方法
1.1 材料培养
拟南芥种子,4℃春化2 d~3 d,播种于育苗钵中(蛭石:营养土=1∶2),培养间光照强度200 μmol·m2·s-1,16 h/8 h(昼/夜),23 ℃,相对湿度50%~60%。
1.2 实验处理
生长4周~5周的拟南芥幼苗用1、2.5、5 mmol·L-1CdCl2溶液处理,每育苗钵10 mL,对照组加等量蒸馏水,处理12、24、48 h后取拟南芥莲座叶进行实验。每一处理设3个重复。
1.3 H2S含量的测定
称取约0.08 g拟南芥莲座叶,放入研钵中,加入0.8 mL 0.05 mmol·L-1的磷酸缓冲液(包含0.2 mmol·L-1抗坏血酸和 0.1 mmol·L-1乙二胺四乙酸(EDTA),pH=7.0),研磨成匀浆,把匀浆转入离心管,用四通道自由基测定仪检测电位变化,根据标准曲线计算得出H2S含量。
1.4 LCD活性的测定
以每毫克蛋白释放H2S的速率来衡量LCD活性。拟南芥中LCD的活性测定方法见文献[11]。
重组蛋白LCD活性测定前,在100 μL蛋白中分别加入2、5、10 μL的50 mmol·L-1CdCl2溶液,使蛋白中的 CdCl2终浓度为 1、2.5、5 mmol·L-1,室温孵育30 min后测定重组蛋白活性,详细步骤见文献[11]。
1.5 LCD基因的检测
液氮研磨拟南芥叶片,提取RNA,反转录成cDNA。荧光定量PCR测定Ct值,计算2-△Ct表征样品间基因水平的相对差异。
1.6 蛋白质免疫印迹法(Western)检测蛋白水平的L-Cys脱巯基酶的表达量
剪取0.3 g拟南芥叶片液氮充分研磨,干粉转入离心管,加 200 μL 蛋白提取液(0.05 mmol·L-1PBS缓冲液,含0.2 mmol·L-1抗坏血酸和0.1 mmol·L-1EDTA,pH=7.0),冰上静提 3 h;12 000 r/min冷冻离心10 min后取上清,加入1/5上清体积的上样缓冲液,煮沸5 min,-80℃冻存。12%SDS聚丙烯酰胺(SDS-PAGE)凝胶电泳后转膜,100 mA转膜10 h。免疫反应后用5-溴-4-氯-3-吲哚-磷酸盐-四唑硝基蓝碱性磷酸酶(BCIP-NBT)显色。
1.7 数据的统计学分析
所有数据依据3次独立实验,用平均值±标准差表示(M±SD)。SPSS17.0软件进行单因素方差分析处理组间的差异。
2 结果与分析
2.1 Cd处理对拟南芥H2S含量的影响
用不同浓度CdCl2溶液处理拟南芥4~5周龄幼苗,分别处理在12、24、48 h后测定H2S含量。从图1可以看出,Cd胁迫12、24 h时,拟南芥幼苗中的内源H2S含量发生了显著(P<0.05)变化。Cd处理12 h 时,2.5、5 mmol·L-1CdCl2溶液处理组的内源H2S含量显著升高;处理24 h时,各浓度Cd处理组中H2S含量均显著高于对照组;处理时间达到48 h时,各处理组的H2S含量却没有显著的差异。
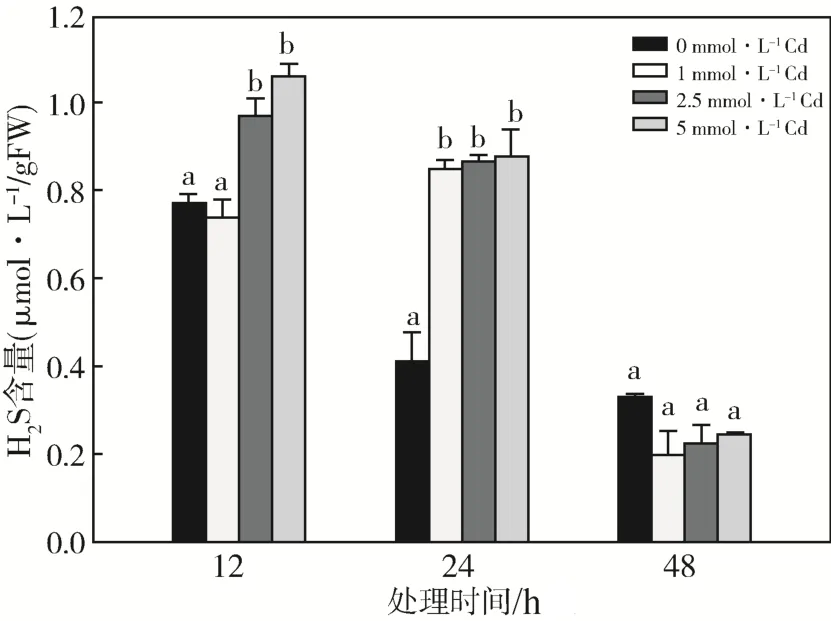
图1 Cd胁迫对拟南芥H2S含量的影响不同字母表示同一处理时间不同处理组间差异显著(P<0.05)Fig.1 Effects of Cd stress on H2S content on Arabidopsis thaliana.Different letters indicate significant at 0.05 level between different treatment at the same time
2.2 Cd处理对拟南芥LCD表达的影响
在Cd胁迫状态下,体内的H2S在一定时间内会增加以应对胁迫,为进一步研究Cd胁迫如何导致拟南芥体内H2S的增加,首先检测了拟南芥LCD(AtLCD)的表达情况(图2)。Cd处理12 h时,Cd处理组AtLCD的表达量均有升高,且5 mmol·L-1Cd处理组的表达量为对照组的2.57倍;处理24 h时,Cd处理组AtLCD的表达量急剧升高,分别是对照组的9.79、12.95、18.9倍;处理48 h 时,Cd处理组AtLCD的表达量却与对照组比下调显著。
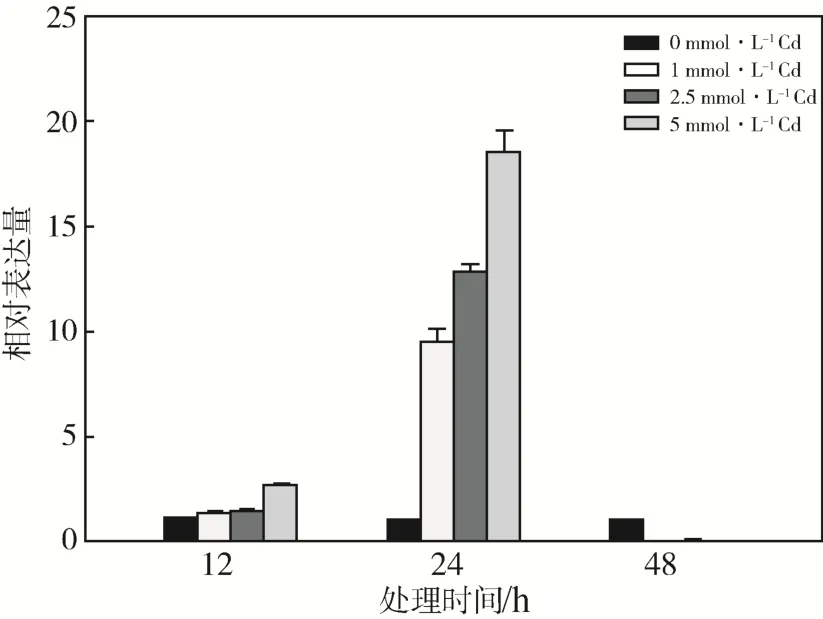
图2 Cd处理对拟南芥LCD表达的影响Fig.2 Effects of Cd stress on AtLCD expression on Arabidopsis thaliana
2.3 Cd处理对拟南芥重组LCD蛋白活性的影响
体外实验验证Cd胁迫下LCD活性是否升高。利用大肠杆菌原核表达重组拟南芥LCD蛋白,纯化获得的蛋白用 1、2.5、5 mmol·L-1Cd 处理 30 min后,测定其酶活性,结果发现:重组LCD蛋白受到与拟南芥植株相同浓度的Cd处理时,处理30 min,仅2.5 mmol·L-1Cd处理组LCD蛋白的活性却显著增加了。其他Cd处理组LCD蛋白的活性虽然增加,但与对照组比差异不显著(图3)。
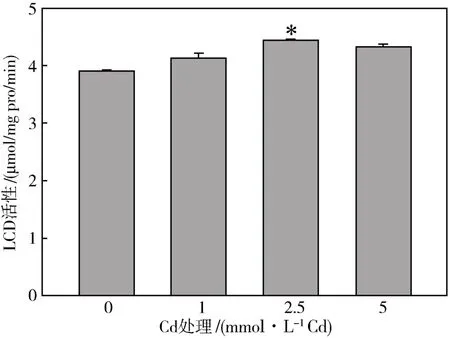
图3 Cd胁迫对拟南芥重组LCD蛋白活性的影响*表示处理组与对照组比差异显著(P<0.05)Fig.3 Effects of Cd stress on the activity of recombinant LCD protein in Arabidopsis thaliana*indicate significant at 0.05 level between different treatment
2.4 Cd处理对拟南芥体内LCD活性的影响
体外短时间Cd处理可以提高LCD重组蛋白的活性。测定Cd处理后拟南芥植株中LCD的酶活,图4显示了Cd胁迫过程中拟南芥幼苗LCD活性的变化。Cd处理12 h时,叶片中LCD的活性提高,2.5、5 mmol·L-1Cd处理对LCD活性的提高更为显著;处理24 h时,Cd处理组LCD的活性显著升高,且均高于12 h处理组;Cd处理48 h时,各处理组拟南芥幼苗中LCD的活性急剧降低,且各处理组间差异不显著。
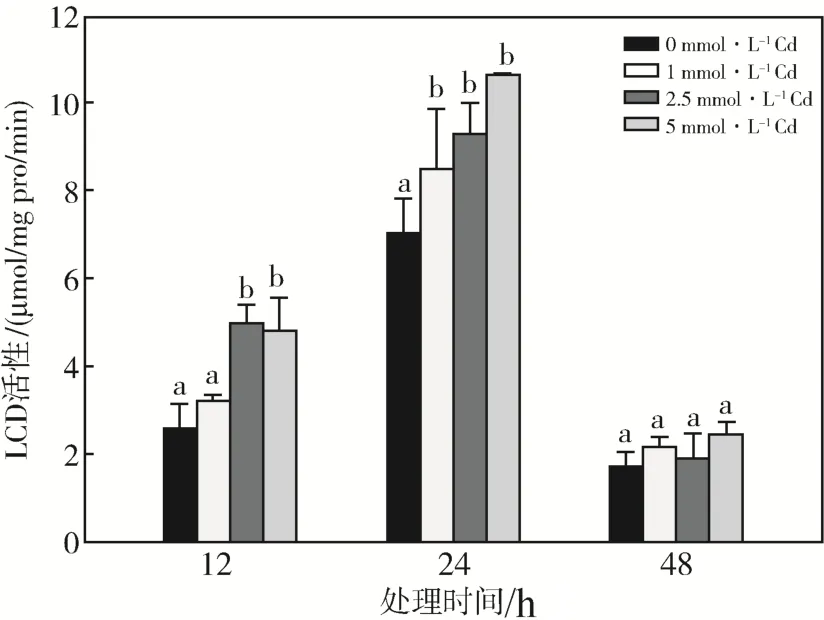
图4 Cd胁迫对拟南芥LCD活性的影响不同字母表示同一处理时间不同处理组间差异显著(P<0.05)Fig.4 Effects Cd stress on LCD activity in Arabidopsis thaliana.Different letters indicate significant at 0.05 level between different treatment at the same time
2.5 Cd处理对拟南芥LCD蛋白含量的影响
为了验证Cd处理后LCD的转录水平升高是否可以导致LCD基因翻译水平的增加,从而使体内LCD活性增强,在Cd处理拟南芥幼苗24、48 h时提取总蛋白,用LCD抗体进行WesternBlot检测。结果发现,处理24 h时,LCD蛋白量随Cd处理浓度的增加而略有增加(图5A),但用Image J做Westren-Blot条带的灰度分析后发现处理组之间没有显著差异;当Cd处理时间达到48 h时,各处理组的LCD蛋白含量没有变化(图5B)。而且处理24 h时的各处理组LCD蛋白量均高于处理48 h各组。
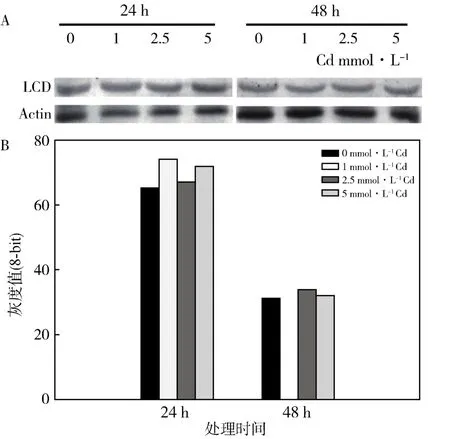
图5 Cd胁迫后拟南芥LCD的Westren检测A:Westren检测结果B:Image G分灰度析结果Fig.5 Western blot analysis of LCD in Arabidopsis thaliana under Cd stress A:Western blot analysis B:Image G analysis
3 讨论
LCD作为植物体内的L型CDs,催化L-Cys的分解产生H2S,和DES一样依赖5-磷酸吡哆醛作为辅因子。大量研究表明[13-16]H2S参与了植物应对Cd胁迫的过程,且胁迫发生时LCD基因的表达上调明显。本研究结果表明,Cd胁迫早期,拟南芥体内的H2S会增加;但随着处理时间延长到48 h时,体内H2S的含量甚至会显著降低。这可能是由于长时间较高浓度的Cd胁迫对植物造成了不可逆的毒害作用,从而使体内的新陈代谢减弱,H2S的合成被抑制。拟南芥体内LCD编码基因的表达量在Cd处理24 h时显著升高,但在48 h时却恢复到对照水平,且各处理组差异不显著,说明拟南芥LCD的转录水平增加来响应Cd胁迫有时间效应。
研究发现Cd胁迫发生时,拟南芥主要依靠LCD催化L-半胱氨酸促反应途径产生H2S,因为当LCD活性升高时,H2S的含量也随之增加。实验结果显示拟南芥LCD基因的转录被激活后,LCD活性的显著升高,体内的H2S含量也显著增加。LCD蛋白Western检测结果显示LCD蛋白的翻译水平也略有增加;24 h时Cd处理组与对照相比LCD蛋白量略有增加,但变化不显著,可能是LCD蛋白抗体的特异性不高导致检测结果不够灵敏。
Cd胁迫下,拟南芥幼苗中LCD的转录水平升高幅度明显高于蛋白水平的升高幅度,例如处理24 h时,5 mmol/L Cd处理组的转录是对照组的18.9倍,但是相同处理条件下的LCD蛋白水平略有增加,且这时检测到的LCD活性是对照组的1.7倍。推测此时蛋白水平增幅较小的原因除抗体的因素外,可能在LCD蛋白翻译后存在某种修饰作用,虽然LCD蛋白量没有显著提高,但通过修饰作用使蛋白的活性增强。
综上所述,Cd胁迫造成的拟南芥体内H2S的增加主要是通过LCD这条酶促途径,且较低浓度Cd胁迫后引起LCD的基因表达和酶活性升高,从而增加体内H2S的合成,发挥其信号作用来增强植物抵抗Cd胁迫的能力。但是Cd是如何上调LCD基因表达,以及Cd胁迫时是否诱导LCD的翻译后修饰作用增强,中间的过程和许多组分还需要进一步研究。
