紫锥菊中菊苣酸大孔吸附树脂纯化工艺的优化
2021-12-23张天锡
张天锡,史 磊,冯 帅,杨 敏,李 健,李 峰*
(1.山东中医药大学,山东 济南 250355;2.山东中医药大学附属医院药学部,山东 济南 250014)
紫锥菊Echinaceapupurea(L.)Moench.来源于菊科紫锥菊属多年生草本植物[1],具有显著的免疫促进作用和抗细菌、抗病毒感染能力,其提取物在欧美被广泛应用于药品、营养补充剂、保健食品中[2-5],它含有多种成分,如酚酸衍生物、烷基酰胺、多糖、挥发油、生物碱、黄酮、多炔等[6-7]。国内大多以紫锥菊的地上部分为原料[8-9],其乙醇提取物含有丰富的咖啡酸衍生物[10-12],其中菊苣酸已被证实具有抗呼吸道合胞病毒(RSV)[13]、抗流感、提高免疫作用[14-17]。吴启林[18]采用大孔吸附树脂纯化菊苣酸,测定其纯度为20.2%左右;曾栋[19]以同法纯化该成分,7%甲醇洗脱后发现其纯度为36%,可知纯度不高、纯化过程中损失较多是目前阻碍其大规模生产应用的关键因素。因此,本实验优化紫锥菊中菊苣酸大孔吸附树脂纯化工艺,以期为该成分进一步开发利用提供依据。
1 材料
1.1 药材 紫锥菊购自青州市康达中药材种植专业合作社(批号2019072432),经山东中医药大学药学院李峰教授鉴定为菊科植物紫锥菊属紫锥菊Echinaceapupurea(L.)Moench的干燥地上部分。
1.2 仪器 Agilent 1260 Infinity型高效液相色谱仪(美国安捷伦科技公司);CPA 2250型电子分析天平(十万分之一,德国赛多利斯公司);TDL-5-A型低速台式离心机(上海安亭科学仪器厂)。
1.3 试剂与药物 AB-8、HPD600、HPD826、D101、DM130、HPD100型大孔吸附树脂(沧州宝恩吸附材料科技有限公司),物理性能见表1。菊苣酸对照品(批号111752-200902,纯度≥98%,中国食品药品检定研究院)。甲醇(批号190259)、乙腈(批号AS1122-801)为色谱纯(美国Fisher公司);其余试剂均为分析纯(天津市富宇精细化工有限公司)。

表1 大孔吸附树脂物理性能
2 方法与结果
2.1 菊苣酸含量测定
2.1.1 色谱条件 参照文献[20]报道。ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),以十八烷基硅烷键合硅胶为填充剂;流动相0.2%磷酸(A)-乙腈(B),梯度洗脱,程序见表2;体积流量1.5 mL/min;检测波长330 nm;柱温35 ℃;进样量5 μL。色谱图见图1。
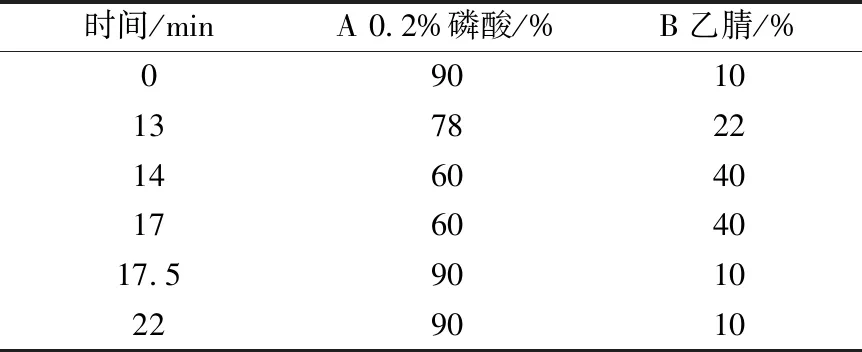
表2 梯度洗脱程序

1.菊苣酸图1 菊苣酸HPLC色谱图
2.1.2 对照品溶液制备 精密称取菊苣酸对照品适量,置于25 mL棕色量瓶中,70%甲醇溶解并定容至刻度,即得(菊苣酸质量浓度为0.6 mg/mL)。
2.1.3 供试品溶液制备 药材粉碎后过60目筛,取细粉约0.4 g,精密称定,置于具塞锥形瓶中,精密加入甲醇-0.5%磷酸(5∶1)混合溶液75 mL,称定质量,室温下超声提取60 min,混合溶液补足减失的质量,摇匀,滤过,收集滤液,即得。
2.1.4 线性关系考察 精密吸取“2.1.2”项下对照品溶液100、200、400、500、600、1 000 μL,置于1 mL量瓶中,70%甲醇定容至刻度,制成系列质量浓度溶液,在“2.1.1”项色谱条件下进样测定。以菊苣酸质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得到方程为Y=15.432X-212.44(r=0.999 6),在60~600 μg/mL范围内线性关系良好。
2.1.5 精密度试验 取“2.1.4”项下溶液,在“2.1.1”项色谱条件下进样测定6次,测得菊苣酸峰面积RSD为0.26%,表明仪器精密度良好。
2.1.6 重复性试验 取同一批药材干燥粉末,按“2.1.3”项下方法平行制备6份供试品溶液,在“2.1.1”项色谱条件下进样测定,测得菊苣酸含量RSD为1.87%,表明该方法重复性良好。
2.1.7 稳定性试验 取“2.1.3”项下供试品溶液1份,精密移取1 mL至EP管中,加入2 mL 70%甲醇醇沉5 min后定容至5 mL,于0、2、4、6、8、12 h在“2.1.1”项色谱条件下进样测定,测得菊苣酸峰面积RSD为0.68%,表明溶液在12 h内稳定性良好。
2.1.8 加样回收率试验 取同一批药材干燥粉末,精密称取0.400 0 g,精密加入适量“2.1.2”项下对照品溶液,按“2.1.3”项下方法制备供试品溶液,在“2.1.1”项色谱条件下进样测定,测得菊苣酸平均加样回收率为101.61%,RSD为2.3%。
2.2 单因素试验
2.2.1 上样液制备 取药材700 g,60%乙醇回流提取3次,设定料液比分别为1∶10、1∶8、1∶6,提取时间分别为1.5、1、1 h,滤过,合并滤液,减压浓缩至无醇味,离心,取上清液,调节pH至2,抽滤,即得。
2.2.2 大孔吸附树脂预处理 取适量树脂,95%乙醇浸泡24 h后洗至溶液无白色秽浊异物,再用蒸馏水洗至无醇味,备用。
2.2.3 大孔吸附树脂类型筛选 将AB-8、HPD600、HPD826、D101、DM130、HPD100型树脂预处理后进行抽滤,分别精密称取1.000 g,置于250 mL具塞锥形瓶中,加入含2.7 mg/mL菊苣酸的上样液20 mL,置于摇床中静态吸附,转速80 r/min,12 h后吸取上样液,HPLC法测定菊苣酸含量。过滤树脂后,去离子水清洗树脂表面残存溶液,再转移到另一具塞锥形瓶中,加入30%乙醇50 mL,置于摇床中解吸附12 h,解吸液在“2.1.1”项色谱条件下进样测定。以菊苣酸比吸附量、解吸量、解吸率为指标筛选树脂类型,结果见表3,可知HPD-100、HPD-826、AB-8型吸附量均较大,但前两者解吸量、解吸率较低,故最终确定为AB-8型。

表3 6种大孔吸附树脂对菊苣酸比吸附量、解吸量、解吸率的影响(n=3)
2.2.4 静态吸附曲线绘制 称取AB-8型树脂5 g,置于250 mL具塞锥形瓶中,加入200 mL上样液进行静态吸附,每10 min取样1次,在“2.1.1”项色谱条件下进样测定,绘制静态吸附曲线,结果见图2。由此可知,随着吸附时间延长,树脂吸附量逐渐增大,前期较快,后期较慢,吸附平衡时间为180 min,最大吸附量为80 mg。
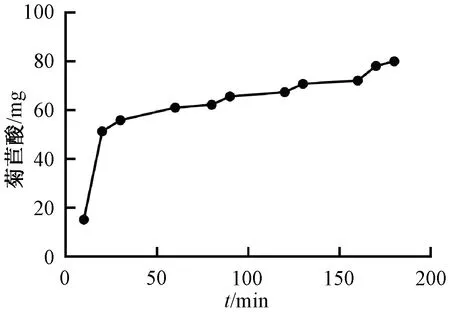
图2 AB-8型树脂静态吸附曲线
2.2.5 上样液pH筛选 由于菊苣酸在pH低于2时极易分解,稳定性差,故选择pH高于2的条件进行考察。将上样液(pH=5.6)平均分为6份,每份20 mL,6 mol/L HCl、10%NaOH溶液分别调pH至相应值,置于含1 g AB-8树脂的250 mL具塞锥形瓶中,摇床上静态吸附12 h,取样检测。过滤树脂,去离子水清洗树脂表面残存的溶液,转移至已包好锡箔纸的250 mL具塞锥形瓶中,加入50 mL 30%乙醇解吸12 h,洗脱液在“2.1.1”项色谱条件下进样测定,计算比吸附量、解吸量、解吸率,结果见表4。由此可知,当pH为2时AB-8型树脂比吸附量、解吸量最大。
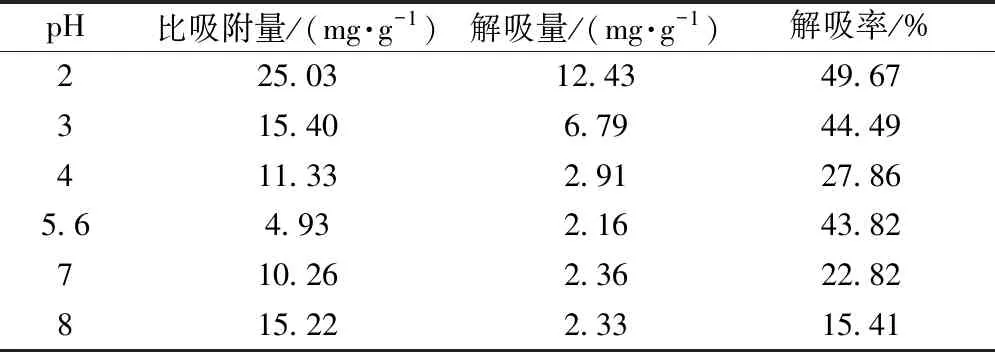
表4 上样液pH对菊苣酸比吸附量、解吸量、解吸率的影响(n=3)
2.2.6 上样液质量浓度筛选 量取pH为2的上样液200 mL,以2 BV/h的体积流量加到径高比1∶5的树脂柱内循环吸附3 h,收集循环液,在“2.1.1”项色谱条件下进样测定,计算吸附量、吸附率,结果见表5。由此可知,随着上样液质量浓度增加,吸附量呈递增趋势,但泄漏量也随之增大,从而大大降低吸附效率,增加生产成本,最终选择2~3 mg/mL作为上样液质量浓度。

表5 上样液质量浓度对菊苣酸吸附量、吸附率的影响(n=3)
2.2.7 上样体积流量筛选 量取4份质量浓度2.62 mg/mL、pH 2的上样液,于径高比1∶5的层析柱内调节吸附速度为相应数值,循环吸附3 h,量取500 mL蒸馏水至层析柱中,洗去树脂表面残存的上样液,收集水液与流出液,在“2.1.1”项色谱条件下进样测定,计算吸附量、吸附率,结果见表6。由此可知,随着上样体积流量增加,树脂吸附量逐渐降低,吸附率也随之减少,为确保树脂的最大吸附量,最终选择2 BV/h作为上样体积流量。

表6 上样体积流量对菊苣酸吸附量、吸附率的影响(n=3)
2.2.8 径高比筛选 选取径高比1∶3、1∶5、1∶7、1∶9的玻璃柱,以AB-8型树脂进行湿法装柱,调节上样体积流量为2 BV/h,量取200 mL药液至层析柱中,收集液循环吸附3 h,再量取500 mL蒸馏水至层析柱中,洗去树脂表面残存上样液,收集水液与流出液,在“2.1.1”项色谱条件下进样测定,计算吸附量、吸附率,结果见表7。由此可知,径高比越大,吸附率越高,故不能作为选择径高比的指标,可改为比吸附量,当径高比为1∶5时最大,最终选择1∶5作为径高比。

表7 径高比对菊苣酸吸附量、吸附率的影响(n=3)
2.2.9 泄露曲线绘制 量取适量树脂装入层析柱中,使其径高比为1∶5,量取400 mL 质量浓度为2.76 mg/mL、pH为2的药液加到层析柱中,以2 BV/h体积流量进行动态吸附,每只试管收集10 mL流出液,在“2.1.1”项色谱条件下进样测定,绘制泄露曲线,结果见图3。由此可知,在上样量为100 mL时发生泄漏;为130 mL时,泄漏量为菊苣酸原质量浓度的10%,为确保该成分吸附完全,最终选择130 mL作为上样量,即4 BV。

图3 菊苣酸泄露曲线
2.2.10 洗脱剂(乙醇)体积分数筛选 表8显示,在乙醇体积分数为30%、50%时,菊苣酸解吸量、解吸率较大,考虑到经济因素,最终选择30%作为洗脱剂体积分数。

表8 洗脱剂体积分数对菊苣酸解吸量、解吸率的影响(n=3)
2.2.11 洗脱体积流量筛选 量取上样液130 mL,置于径高比1∶5的层析柱中,以2 BV/h体积流量循环吸附3 h,加入蒸馏水3 BV(pH=2),当流出液经Molish反应呈阴性时,加入500 mL 30%乙醇,在2、3、4 BV/h体积流量下洗脱,收集洗脱液,在“2.1.1”项色谱条件下进样测定,计算解吸量、解吸率,结果见表9。由此可知,在2、4 BV/h体积流量下解吸率相近,考虑到经济效益,最终选择4 BV/h作为洗脱体积流量。

表9 洗脱体积流量对菊苣酸解吸量、解吸率的影响(n=3)
2.2.12 洗脱曲线绘制 设定解吸条件为上样液质量浓度为2.7 mg/mL,pH为2,上样体积流量为2 BV/h,上样体积为130 mL,取3份上样液至径高比为1∶5的层析柱中,动态循环吸附3 h,加入3 BV蒸馏水使流出液经Molish反应呈阴性,加入30%乙醇洗脱,收集洗脱液,每管10 mL,在“2.1.1”项色谱条件下进样测定,绘制洗脱曲线,结果见图4。由此可知,洗脱体积为11 BV时可将菊苣酸完全洗脱下来,并且该成分富集化部位主要集中在5 BV,此时其纯度为36.5%,解吸率为80.2%,故选择5 BV作为洗脱体积。

图4 菊苣酸洗脱曲线
2.3 正交试验 在单因素试验基础上,选择上样液质量浓度(A)、上样液pH(B)、洗脱体积流量(C)、洗脱剂体积分数(D)作为影响因素,解吸率(Y)作为评价指标,因素水平见表10,结果见表11,方差分析见表12。由此可知,各因素影响程度依次为D>B>A>C,最优工艺为A3B2C2D3,即上样液质量浓度3 mg/mL,上样液pH 3,洗脱体积流量3 BV/h,洗脱剂体积分数35%。

表10 因素水平

表11 试验设计与结果

表12 方差分析
2.4 验证试验 将“2.3”项下结果进行3批验证试验,结果见表13。

表13 验证试验结果(n=3)
3 讨论
本实验创新之处在于大孔树脂洗脱溶剂的选择较前期文献有所改进,采用纯化水(pH=3)、不同体积分数乙醇梯度洗脱的方式进行除杂,既减少了菊苣酸在纯化过程中的损失,又能使该成分洗脱富集化,从而其平均纯度可达到52.00%,较纯化前提高了近8倍。但菊苣酸对温度较敏感,在洗脱液减压浓缩过程中温度过高会造成该成分损失较大,故今后将系统考察温度对其稳定性的影响。
综上所述,紫锥菊中菊苣酸最优大孔吸附树脂纯化工艺为AB-8大孔吸附树脂,上样液质量浓度3 mg/mL,上样液pH 3,洗脱体积流量3 BV/h,洗脱剂体积分数35%,洗脱体积5 BV,能达到较好的分离纯化效果,具有成分损失少、吸附量大、吸附速度快、易于解吸附、树脂再生处理简单、使用周期长等优点,适合大规模工业化生产。同时可有效地提高提取物中该成分纯度,为其后续精制奠定基础。
