封闭式取栓支架的生物力学研究
2021-12-18张晓颖谷雪莲田浩孟繁鹤邱晓键
张晓颖 谷雪莲 田浩 孟繁鹤 邱晓键
0 引言
脑卒中(stroke)是一种突然起病的脑血液循环障碍性疾病,分为缺血性(脑梗死)和出血性(脑出血和蛛网膜下腔出血)两大类[1]。急性缺血性脑卒中(acute ischemic stroke,AIS)的病理学起因包括大动脉粥样硬化、心脏疾病、小动脉脂质堆积、其他血管疾病及未确定来源而形成的血栓,AIS占全部脑卒中类型的87%,具有发病率高、致残率高、复发率高等特点[2-3]。目前AIS的有效治疗方法包括药物静脉溶栓和机械取栓术(mechanical thrombectomy,MT)。相比于静脉溶栓的时间窗在患者发作后的3~6 h内,MT的时间窗可达6~24 h内,且其治疗优势还在于再通率高,再通时间更快[4-5]。
MT是指通过股动脉穿刺,将机械取栓装置通过导管输送进血管闭塞的部位,通过取栓装置将血栓拉出,使得血管血流恢复的一种技术方法。就机械取栓装置而言,可根据作用原理分为3类:远端切除装置、近端抽吸装置和血管内通路装置(即取栓支架,也称作可回收支架)[6]。
取栓支架多为多网孔结构,代表性的Trevo支架(Stryker,美国)是一种外观呈封闭圆筒状的多网孔可回收支架。取栓过程中支架首先压握进内径很小的微导管,此过程支架的外径逐渐减小,如果支架自身的局部应变过大则会导致变形无法恢复甚至断裂的不良后果,并且会在释放的时候抓捕血栓不利,遗漏的碎小血栓形成新的栓塞。随后,取栓支架通过股动脉穿刺通道输送至病变部位,由于镍钛合金的超弹性和形状记忆性[7],取栓支架从导入鞘中释放后可渐渐恢复自身结构,凭借径向支撑力支撑血管,恢复部分血流。此时径向支撑力过大可能会造成后续支架回撤困难;径向支撑力过小则无法形成通道便于血流恢复。最后,取栓支架和包裹着的血栓一起经由微导管撤回,完成取栓全过程。回撤步骤中,支架如果径向力过大可能会形成阻力进而对血管造成损伤。
据现有的文献报道,取栓支架在临床应用时确实会出现颅内出血性转化、血管痉挛、血栓栓塞等并发症[8-10]。取栓支架和血栓一起在血管中迁移时,可能会由于阻力过大而无法成功回收[11];还有可能划伤血管壁引发炎症,造成内膜增厚[12]。
为了减少取栓支架的临床使用局限性和与器械相关的并发症,对取栓支架的生物力学研究是非常有必要的。因此,本研究从取栓支架的设计角度出发,以多网孔状的封闭式取栓支架为研究对象,采用有限元分析技术,研究其在取栓过程中的生物力学性能,分析取栓支架的结构及其力学特征并得到综合性能较优的结构。
本研究参考现有的典型支架,建立了支撑单元(cell)数为3、4、5的封闭式取栓支架模型来进行有限元分析,利用SolidWorks 2016和ABAQUS 6.14软件建立模型,对取栓支架的压握入管、自膨胀释放和迁移取栓3个阶段进行模拟,分析不同结构的封闭式取栓支架在模拟过程中自身以及血管的变形和场输出情况,得到的结果可为取栓支架的研发及设计提供一些参考。
1 研究方法
1.1 取栓支架几何模型
本文依据现有的临床中常使用的封闭式取栓支架[13],见图1(a),确定本研究的支架长度为35 mm,内径为4 mm,支架厚度0.05 mm,取栓支架的几何模型由三维实体建模软件SolidWorks 2016绘制。
封闭式取栓支架包括呈卷曲圆筒状的主体部分和呈椎体状的近端部分,从平面展开图来看,是由一系列可重复的支撑单元组成的。本研究的取栓支架模型在轴向上统一设置4个封闭单元,在径向上分别设置3、4、5个单元。然后通过包覆、浮雕和蚀雕等特征命令形成取栓支架的三维几何模型,厚度统一为0.05 mm。图1(b)所示是封闭式取栓支架主体结构的二维平面图,将3、4、5cell结构的取栓支架记为B3、B4、B5。

图1 取栓支架的几何模型和有限元模型Figure 1 Geometric and finite element models of the stent retrievers
将所绘制的封闭式取栓支架的三维模型导入到有限元分析软件ABAQUS 6.14中进行下一步模拟分析。
1.2 有限元模型
利用有限元分析软件ABAQUS 6.14建立取栓支架、压握工具、模拟血管和模拟血栓的有限元模型,并进行同轴装配。
取栓支架整体采用六面体网格划分,在实体离散过程中,如果采用相同单元尺寸,六面体网格划分的单元数量比四面体网格划分的单元数量少,使得有限元计算时间较小,误差较小。使用ABAQUS软件将支架划分为八结点线性六面体单元,采用减缩积分单元(C3D8R),设置沙漏控制。
为了简化模型,压握工具直接建立为三维圆柱形壳体,网格选取四结点线性四边形减缩单元(SFM3D4R)。模拟血管建立为圆筒状可变形实体,内径为3 mm,壁厚为0.1 mm。考虑到计算收敛性问题,模拟血栓被建成外形规则的实体部件,由中间部分的圆柱体和两端的半球体组成,外径与血管内径相等。模拟血栓和模拟血管的网格均采用八结点线性六面体杂交模式单元(C3D8H),模拟血管在其壁厚方向划分3层单元。将所有部件进行同轴装配,考虑取栓支架的工作原理,初始就将血栓添加在靠近支架近端的血管内部,具体如图1(c)所示。
1.3 材料属性
本研究采用各向同性,均匀不可压缩的镍钛合金材料,利用其超弹性和形状记忆效应完成取栓。通过ABAQUS软件用户定义(user material)属性来描述镍钛的本构模型,具体参数来自文献[14]。
压握工具的材料被定义为刚性的表面。模拟血管设定为理想状态下的各项同性、均匀、不可压缩的Neo-Hookean超弹性模型。Neo-Hookean模型是一种减缩多项式模型,其应变势能密度方程为:
U=C10(I1-3)+1/D1(J-1)2
(1)
式中:I1为应变不变量;J为体积比;C10与D1为两个常数,具体数值来源于文献[15]。
从人体中取出的血栓由于组成成分的不同,表现出的机械特性也不相同,本研究中将模拟血栓假设为各向同性的线弹性材料[16],并根据相关文献完成参数设置[17]。以上各部件的主要材料参数见表1。

表1 各部件主要材料参数Table 1 Main material parameters of each part
1.4 边界条件
1.4.1 压握入管
在封闭式取栓支架压握进微导管的分析过程中,将所有模型均转化在基准柱坐标系下。ABAQUS软件柱坐标系的R代表径向,T代表周向,Z代表轴向,其正方向分别与1、2、3自由度对应。对压握工具的周向和轴向进行限制,在径向上施加位移载荷,使取栓支架外径减少至0.021 in(约0.5 mm,1 in=2.54 cm,是微导管常用尺寸)。为了避免刚体位移,需要在取栓支架的轴向方向进行约束。
分析中的接触对采用“罚”函数算法,添加压握工具内表面和取栓支架外表面的接触对;还需添加模拟血管的内表面和血栓外表面的接触对。计算中将分析步中的几何非线性开关打开,以提高计算收敛性。
1.4.2 自膨胀释放
封闭式取栓支架自膨胀释放分析时,恢复压握工具的径向位移,取栓支架凭借其镍钛材料的特性逐渐自膨,与血管进行接触。需新增一对主从接触对,主面是模拟血管的内表面,从面是取栓支架外表面。接触属性仍是“罚”函数算法,摩擦系数设为0.25。将模拟血管的两端进行约束,使其在周向和轴向上固定。其余的设置保持不变。
1.4.3 迁移取栓
封闭式取栓支架完成自膨胀释放后,压握工具与支架的接触对被禁用,新增取栓支架和血栓的接触对,其余的设置保持不变。
在取栓支架的近端节点施加轴向位移,同时限制其他两个方向的运动,血管两端的约束与之前的相同,这样可以使得支架在轴向上平稳位移。
1.5 分析指标
本文中,通过压握入管阶段的应变和应力指标,说明支架的径向支撑性能和结构完整性能;通过自膨胀释放阶段的支架应变和支架对血管的Mises应力指标,分析支架的安全性;通过迁移取栓阶段的血管Mises应力和回撤力,分析支架的血栓捕获性能及安全性。
2 结果与分析
2.1 径向压握过程中的应变和应力
图2为封闭式取栓支架外径压握至0.5 mm时的最大主应变云图。可以发现取栓支架在压握状态下,最大主应变峰值出现在两个支撑单元之间的连接筋部位,支撑单元弧形段的主应变则相对较小。3款取栓支架的最大主应变峰值由大到小的排序是B4(10.41%)>B3(9.10%)>B5(8.61%),都未超过镍钛合金材料的断裂极限12%[18]。该结果说明了支架的结构完整性能。
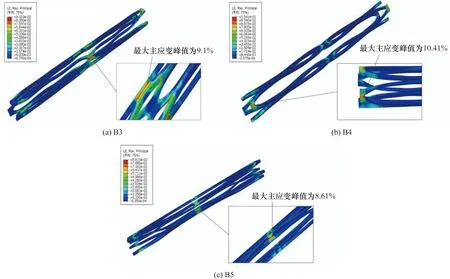
图2 取栓支架压握入管最大主应变云图Figure 2 Maximum principal strain of the stent retrievers as pressed into the microcatheters
取栓支架的径向支撑力(radical force,RF)的变化曲线如图3所示,可以看出取栓支架的径向支撑力随着支架外径的减小而增大。当支架外径与血管内径相等均为3 mm时,B3支架的径向支撑力最大;当支架外径小于1.5 mm时,3款取栓支架的径向支撑力曲线都呈急速上升趋势。该数据显示出支架的径向支撑性能。

图3 取栓支架外径-径向支撑力曲线Figure 3 The stent retrievers’outer diameter-radial force curve
2.2 自膨胀释放
封闭式取栓支架在释放过程中的最大应变峰值见表2。对比压握结果发现,取栓支架释放过程中的最大主应变峰值更小。图4为取栓支架在血管中自膨胀释放后血管的Mises应力图。可以看出,支撑单元数越大,血管上的应力分布越不均匀,造成的等效应力值也越大。其中B5支架的血管Mises应力值为1.757 MPa,超过了已知的正常血管的极限应力1.34 MPa[19]。这些数据可以分析取栓支架在释放时的安全性。

图4 释放过程中血管Mises应力分布云图Figure 4 von Mises stress of artery during self-release

表2 支架释放过程中的最大主应变峰值Table 2 Maximum principal strain during the stent release
2.3 迁移取栓
图5是血管在封闭式取栓支架迁移取栓过程中的Mises应力分布图,为方便观察,将模型进行部分透明化显示处理。图中血管应力集中的部位就是血栓所在的位置,取栓支架在轴向上对血栓进行拉取,在径向上对血管造成的应力值较小。结果表明,取栓支架的支撑单元数越大,血管的Mises应力也越大,这一趋势与自膨胀释放结果相同。
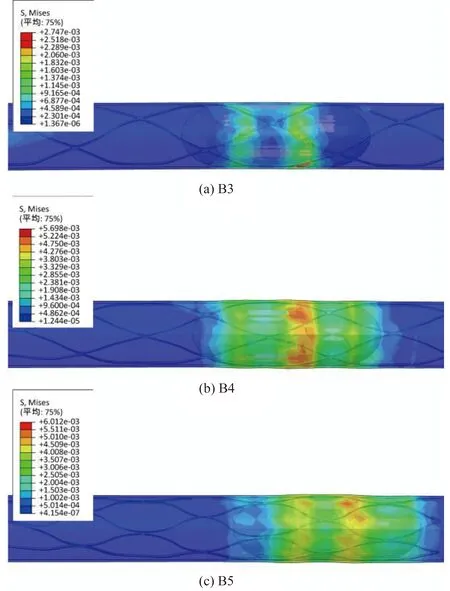
图5 取栓过程中血管Mises应力分布云图Figure 5 von Mises stress of artery during stent retrieval
为了评价封闭式取栓支架的取栓效果,可用支架的回撤力来表示取栓支架捕获血栓的能力[20]。在取栓支架近端的位移施加面提取取栓支架的回撤力,支架的回撤力随分析步时长的变化曲线见图6。可以发现,在分析的初始阶段,取栓支架的回撤力达到最大值,后渐渐下降趋于平稳。3款取栓支架的回撤力峰值由大到小的排序是B5>B3>B4,不过差异并不明显。

图6 迁移取栓中的回撤力变化曲线Figure 6 Withdrawal force curve during the retracting of the stent retrievers
3 讨论
封闭式机械取栓支架已经广泛应用于临床,但仍存在部分局限性[21]。为了进一步提高取栓支架性能,减少使用过程中因器械造成的并发症,本研究针对封闭式的取栓支架进行生物力学分析。此研究通过建立支撑单元数不同的封闭式取栓支架的有限元模型,运用数值仿真方法分析了取栓支架取栓过程的压握入管、自膨胀释放和迁移取栓3个阶段的力学现象。根据最大主应变、径向支撑力、Mises应力和回撤力等参数,评价3款取栓支架的生物力学性能,分析取栓支架机械结构及其力学性能。
通过压握入管的结果可知,最大主应变集中在取栓支架两个支撑单元之间的连接筋部位,这是取栓支架工作时容易发生失效的位置。本文设计的B3、B4、B5取栓支架的最大主应变峰值均小于断裂极限12%,不易发生断裂等严重失效事件。此外,在压握过程中,3款取栓支架的径向支撑力均随着支架外径的减小而增大。但相比而言,B3支架在外径为3 mm时拥有更大的径向支反力,在支撑血管建立通路方面更具有优势。根据自膨胀释放和迁移结果可知,取栓支架的支撑单元数越多,造成的血管Mises应力值也越大,且B5支架对血管造成的Mises应力超过了已知的血管极限应力。虽然迁移取栓结果表明,B5支架拥有最大的回撤力,但为了避免血管内膜损伤等问题,临床使用时不宜选用这种支撑单元数过多的设计。
所以,综合以上的分析结果,B3支架不论是自身的应力应变还是对血管的应力都处于较低的安全范围内,且迁移取栓的回撤力大于B4支架,是综合性能更优的取栓支架。
本文中的研究方法也存在一定的局限性:对模型进行了适当简化,在分析过程中没有考虑血流和血压对取栓支架的影响;分析所用的血管和血栓模型均是理想化模型,实际中的血管和血栓都不是规则的形状,这些需要在今后的研究中进一步分析。
4 结论
此研究建立了3种结构的封闭式取栓支架模型,完成了取栓过程的生物力学分析,并根据数值仿真结果,分析取栓支架的结构及其力学性能。结果表明支撑单元数目过多的支架设计不可取,整体性能表现最好的是支撑单元数目为3的支架。本文的研究结果可作为评价封闭式取栓支架生物力学的参考,也可以为取栓支架的结构设计及优化提供一定的思路和方向。
