黄铁矿在硫酸铁和氯化铁中的电化学氧化机理研究
2021-12-16毛王彬李栢庄李佳蕊唐家华张炎
毛王彬 李栢庄 李佳蕊 唐家华 张炎






摘要:采用开路电位、循环伏安、Tafel曲线及电化学阻抗谱等电化学测试技术手段,研究黄铁矿在pH=1.0、不同浓度的Fe2(SO4)3和FeCl3溶液中的电化学氧化机理,并讨论了在Fe3+浓度相同时,SO2-4和Cl-对黄铁矿氧化机理的影响。结果表明:Fe2(SO4)3和FeCl3能够促进黄铁矿的氧化,其中起作用的离子是Fe3+和Cl-;SO2-4不会改变黄铁矿的氧化机理,但其浓度的提高会增大电子转移电阻,从而降低黄铁矿表面氧化速率。该研究对黄铁矿氧化机理有了新的了解,对黄铁矿的实际应用具有参考价值。
关键词:电化学氧化;黄铁矿;硫酸铁;氯化铁;氧化机理
中图分类号:TD95文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1001-1277(2021)11-0060-06doi:10.11792/hj20211112
引言
黄铁矿(FeS2)一般用作生产硫磺和硫酸的原料。近年来,由于黄铁矿优异的半导体性能和光学性能,使其不仅可用作锂电池等电极材料,也可用作太阳能电池吸光材料的原料。但是,由于黄铁矿在空气和水环境中极易被氧化,实际使用中会导致其性能降低甚至使用寿命缩短,因此研究黄铁矿在不同溶液中的电化学氧化机理、氧化过程中电化学参数的变化及表面电化学反应机制,对防止和避免黄铁矿的氧化具有重要的理论研究和实际应用价值。BIEGLER等[1]研究了黄铁矿在酸性溶液中的阳极行为,得出阳极反应是2种途径的结合,会生成硫酸盐和单质硫的结论,同时表明黄铁矿的半导体性质并不显著影响其阳极反应动力学。FENG等[2]研究表明,黄铁矿在酸性条件下生成Fe2O3、Fe2(SO4)3、Fe(OH)3和S。林森等[3]研究了黄铁矿在不同pH硫酸钠溶液中的电化学腐蚀,发现随着pH的升高,黄铁矿更易被腐蚀。ANTONIJEVI'C等[4]研究了硫酸、盐酸、磷酸和高氯酸中黄铁矿的阳极氧化,发现黄铁矿在盐酸中氧化速率最快,但在这4种酸中的阳极氧化过程并无明显差异。
本次试验运用相关电化学测试技术,研究当pH=1.0时黄铁矿在不同浓度Fe2(SO4)3和FeCl3溶液中的电化学氧化机理,同时探讨了不同离子对黄铁矿氧化机理和反应速率的影响,结果表明Fe3+和Cl-会加快黄铁矿表面氧化速率,而SO2-4会降低其表面氧化速率但不会改变黄铁矿氧化机理。该研究对黄铁矿氧化机理有了新的了解,可为黄铁矿的实际应用提供理论参考,并有望应用于黄铁矿的防腐与保护。
1试验材料与方法
1.1电解池及电极
电解池为3电极系统,以铂电极作为辅助电极,饱和甘汞电极作为参比电极,工作电极为镶嵌有工作表面积约1 cm2、厚度2 mm黄铁矿的石墨碳棒;电化学测量仪器为CHI660e型电化学工作站(上海辰华仪器有限公司)。
1.2试验溶液
本次试验中所用电解质溶液:浓度分别为0 mmol/L、5 mmol/L、10 mmol/L、15 mmol/L、20 mmol/L的Fe2(SO4)3溶液及0 mmol/L、10 mmol/L、20 mmol/L、30 mmol/L、40 mmol/L 的FeCl3溶液。为了深入探讨阴、阳离子对黄铁矿氧化机理的影响,试验还配制了10 mmol/L Fe2(SO4)3+30 mmol/L Na2SO4溶液。所有溶液的pH值均为1.0(用质量分数为10 %的NaOH溶液调节溶液pH)。
1.3试验方法
试验中所用黄铁矿是天然矿物,用切割机将黄铁矿切成直径约1 cm、厚度2 mm的圆柱体,并用不同的砂纸将其中一个表面打磨至光滑作为工作表面,另一粗糙底面镶嵌在石墨碳棒中用于导电,露出的工作表面(表面积约为1 cm2)置于電解液中。
以铂电极作为辅助电极,饱和甘汞电极作为参比电极,表面镶嵌有黄铁矿的石墨碳棒作为工作电极。工作电极在溶液中静置一段时间达到稳定后测量所需数据。每次测量完数据后均用细砂纸打磨黄铁矿工作表面至光滑,并用蒸馏水洗净,以确保工作表面洁净和无反应生成物质残留。
2结果与讨论
2.1黄铁矿的开路电位
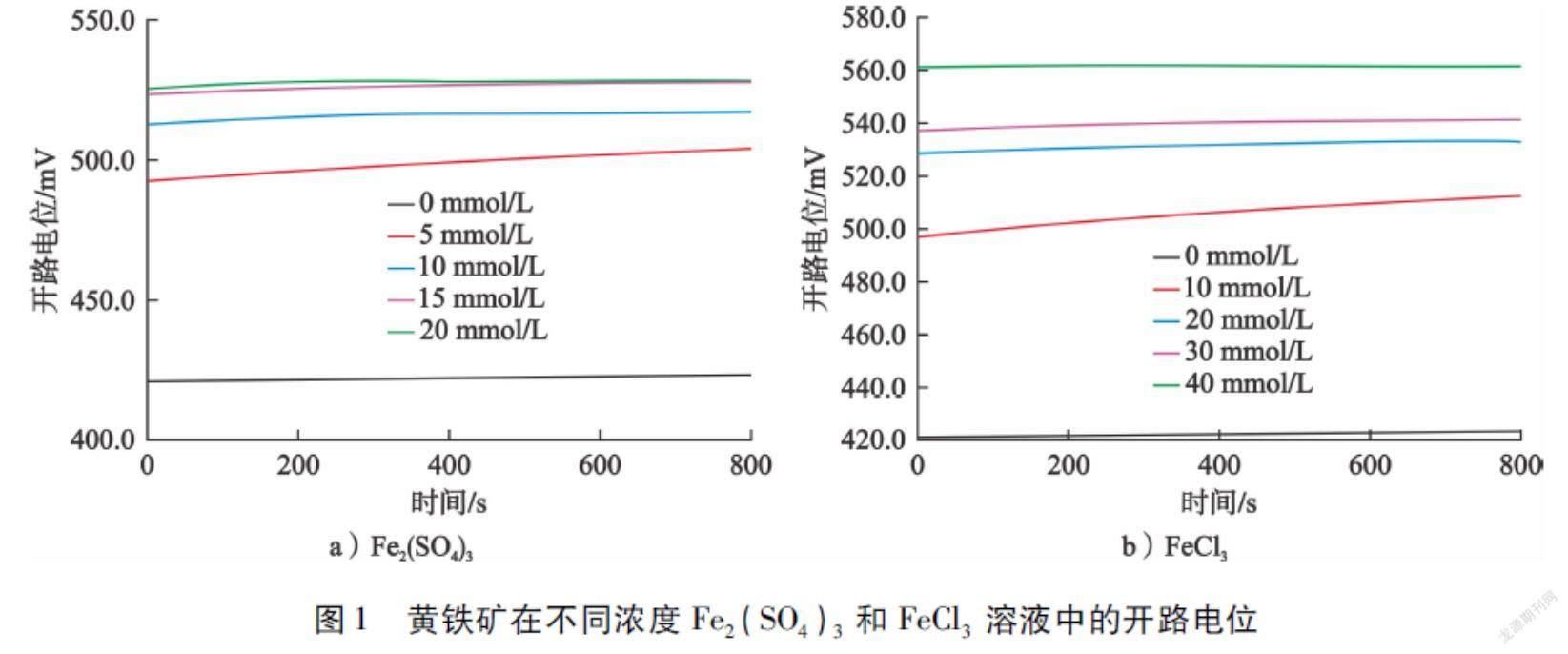
黄铁矿在不同浓度Fe2(SO4)3和FeCl3溶液中的开路电位如图1所示。当所测试的开路电位(Eocp)在测试时间内的波动小于5 mV时,即认为黄铁矿在该溶液中达到稳定[5]。
从图1可以看出:黄铁矿的开路电位随着Fe2(SO4)3和FeCl3浓度的升高逐渐增大。其中,黄铁矿在0 mmol/L、5 mmol/L、10 mmol/L、15 mmol/L、20 mmol/L Fe2(SO4)3溶液中的稳定开路电位分别为423.4 mV、504.0 mV、517.3 mV、527.9 mV、528.3 mV,在0 mmol/L、10 mmol/L、20 mmol/L、30 mmol/L、40 mmol/L FeCl3溶液中的稳定开路电位分别为423.4 mV、512.3 mV、532.8 mV、540.9 mV、561.0 mV。
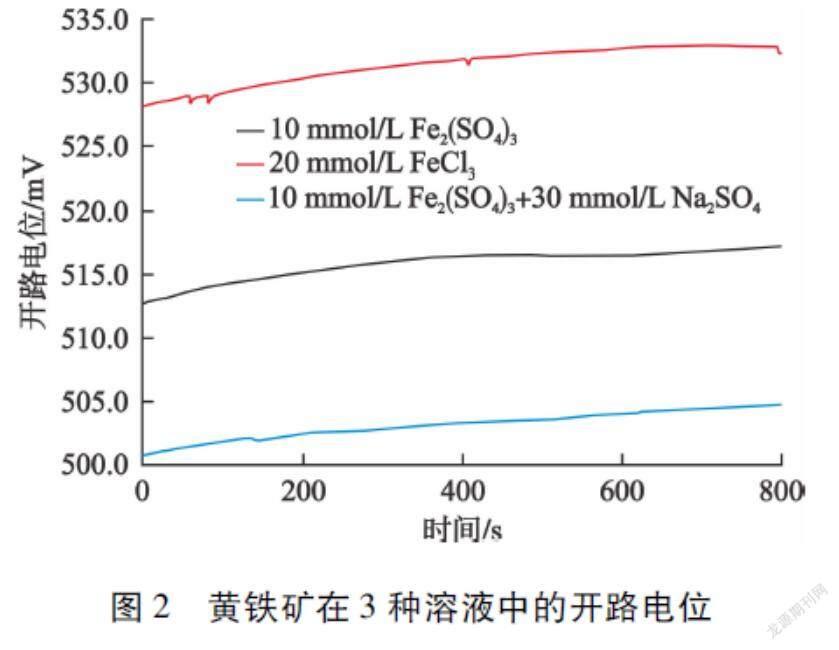
黄铁矿在10 mmol/L Fe2(SO4)3、20 mmol/L FeCl3和10 mmol/L Fe2(SO4)3+30 mmol/L Na2SO4溶液中的开路电位如图2所示。
从图2可以看出:黄铁矿在10 mmol/L Fe2(SO4)3、20 mmol/L FeCl3和10 mmol/L Fe2(SO4)3+30 mmol/L Na2SO4溶液中的稳定开路电位分别为517.3 mV、532.8 mV 和504.8 mV。随着SO2-4浓度的升高,黄铁矿的Eocp减小,造成此现象的原因是SO2-4不仅容易在电极表面与Fe3+形成竞争性吸附,还可能在酸性条件下与Fe3+形成黄钾铁矾类物质使部分Fe3+以沉淀或者絮体形式从溶液中分离,这都会造成电极表面吸附的Fe3+减少,从而导致电极本身的氧化电压下降[6]。
2.2黃铁矿的CV曲线
在pH=1.0,扫描电压为-0.7~ 0.8 V,扫描圈数为3圈,扫描速率为100 mV/s的条件下,进行黄铁矿在不同浓度Fe2(SO4)3和FeCl3溶液中的循环伏安(CV)研究。为了保证试验结果的准确性,本次试验采用第2次循环扫描的数据作图,结果如图3所示。C1、C2 、C1′、C2′—还原峰A1、A2、A3 、A1′、A2′、A3′—氧化峰
从图3可以看出,黄铁矿在Fe2(SO4)3溶液中的反应出现了2个还原峰和3个氧化峰。每个峰代表不同的反应。
还原峰中C1峰的反应可分为2步,一步为黄铁矿自身的还原[7]:
FeS2+2H++2eFeS+H2S(1)
另一步则是黄铁矿表面单质S的还原:
S+2H++2e H2S(2)
C2峰是溶液中Fe3+的还原:
Fe3++eFe2+(3)
氧化峰中A1峰是H2S的氧化:
H2SS+2H++2e(4)
A2峰是Fe2+的氧化[7-11]:
Fe2+Fe3++e(5)
A3峰是生成SO2-4的反应[12-15]:
FeS2+8H2OFe3++2SO2-4+16H++15e(6)
从图3中不难看出,黄铁矿在FeCl3溶液中的CV曲线与在Fe2(SO4)3溶液中并没有明显差别,且出峰位置与所对应的反应相同,即A1′、A2′、A3′、C1′、C2′分别与A1、A2、A3、C1、C2所对应的反应一致。
此外,还可以看出黄铁矿的A1(A1′)峰随着Fe2(SO4)3和FeCl3浓度的增加逐渐减小,这是因为Fe3+有较高的氧化性,使初始负向扫描过程中一些还原产物(如FeS和H2S)被Fe3+氧化,H2S等的减少导致A1(A1′)峰变小[8]。除了A1(A1′)峰外,其他电流峰A2(A2′)、A3(A3′)、C1(C1′)和C2(C2′)均随着Fe2(SO4)3 和FeCl3浓度的增加而增大,其中电流峰C1(C1′)和C2(C2′)的增大是因为电极表面氧化剂(如Fe3+和中间产物S)增多并且发生还原反应导致的;当更多的Fe3+发生还原反应生成Fe2+,电位由负向正转正扫描时,这些Fe2+再次被氧化,导致氧化峰A2(A2′)也增大[8]。
黄铁矿在10 mmol/L Fe2(SO4)3、20 mmol/L FeCl3和10 mmol/L Fe2(SO4)3+30 mmol/L Na2SO4溶液中的CV曲线如图4所示。
从图4可以看出:随着SO2-4浓度的增大,黄铁矿CV曲线图的出峰位置和数量并没有明显变化,依旧在相似位置分别出现3个氧化峰A1″、A2″、A3″和2个还原峰C1″、C2″,说明SO2-4不能改变黄铁矿的氧化机理。此外,随着SO2-4浓度的增大,部分氧化峰、还原峰电流密度的绝对值减小,造成此现象的原因可能是SO2-4吸附在黄铁矿的表面,阻碍了黄铁矿的氧化。在Fe3+为20 mmol/L,变量为阴离子种类(SO2-4和Cl-)时,黄铁矿在FeCl3溶液中的氧化峰、还原峰电流密度的绝对值更大,说明黄铁矿在含Cl-的溶液中氧化速率更快,这是因为Cl-不但可以抑制或减少单质S的生成,还可以与一些金属离子络合而利于黄铁矿氧化。
2.3黄铁矿的Tafel曲线
试验中0 mmol/L溶液的Tafel电压测定范围为0.1~0.7 V,其他浓度溶液的电压测定范围均为0.2~0.8 V,扫描频率为10 mV/s,扫描段数为1段。黄铁矿在不同浓度Fe2(SO4)3和FeCl3溶液中的Tafel曲线如图5所示,相关的Tafel曲线参数分别如表1、表2所示。
从图5可以看出:随着Fe2(SO4)3浓度的增大,腐蚀电位(Ecorr)集中在0.43~ 0.44 V;而随着FeCl3浓度的增大,黄铁矿的腐蚀电位不断正移。从表1可以看出:黄铁矿的腐蚀电位和腐蚀电流密度随Fe2(SO4)3和FeCl3浓度的升高而增大。腐蚀电流密度是判断腐蚀速率的一个标准,试验中其值随着Fe2(SO4)3和FeCl3浓度的升高逐渐增大,表明黄铁矿表面腐蚀速率随着Fe2(SO4)3和FeCl3浓度的升高而加快,黄铁矿在浓度高的Fe2(SO4)3和FeCl3溶液中更容易被腐蚀。而黄铁矿的腐蚀电位与上述试验的开路电位有差异的原因是:对黄铁矿进行Tafel曲线测定的过程中,黄铁矿电极表面会发生强极化的过程,生成一层钝化膜,从而导致腐蚀电位与开路电位的数值不同[6]。
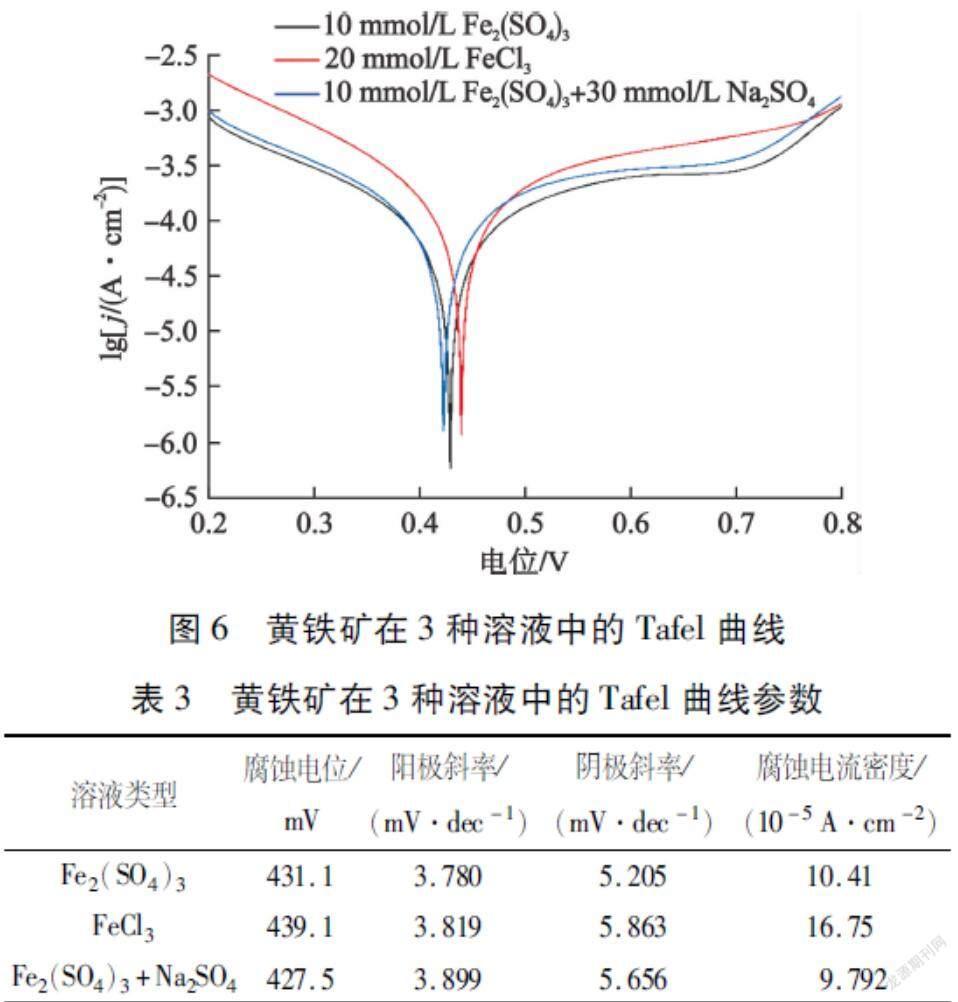
同样,试验也在10 mmol/L Fe2(SO4)3、20 mmol/L FeCl3和10 mmol/L Fe2(SO4)3+30 mmol/L Na2SO4溶液中进行了Tafel曲线的测定,结果如图6所示,相关的Tafel曲线参数如表3所示。
对比表3中数据可以发现:黄铁矿腐蚀电位与腐蚀电流密度随着SO2-4的引入而减小,黄铁矿的阴、阳极斜率随着SO2-4的引入而增大,阴、阳极电子转移系数减小,这意味着SO2-4的引入不利于电子的转移,说明SO2-4浓度的升高会导致黄铁矿表面氧化速率降低。此外,腐蚀电流密度减小也表明黄铁矿表面氧化速率降低。对比20 mmol/L FeCl3和10 mmol/L Fe2(SO4)3+30 mmol/L Na2SO4溶液的Tafel曲线参数,可以发现在Fe3+浓度相同,变量为阴离子种类时,相比黄铁矿在含SO2-4的溶液中,黄铁矿在含Cl-溶液中的腐蚀电位、阴极斜率与腐蚀电流密度更高,而阳极斜率较低。其中,腐蚀电流密度数值更大表明黄铁矿在含Cl-溶液中更易被腐蚀,因为Cl-在一定程度上具有促进黄铁矿表面氧化的功能,而SO2-4主要是降低其表面氧化速率。
2.4黄铁矿的EIS曲线
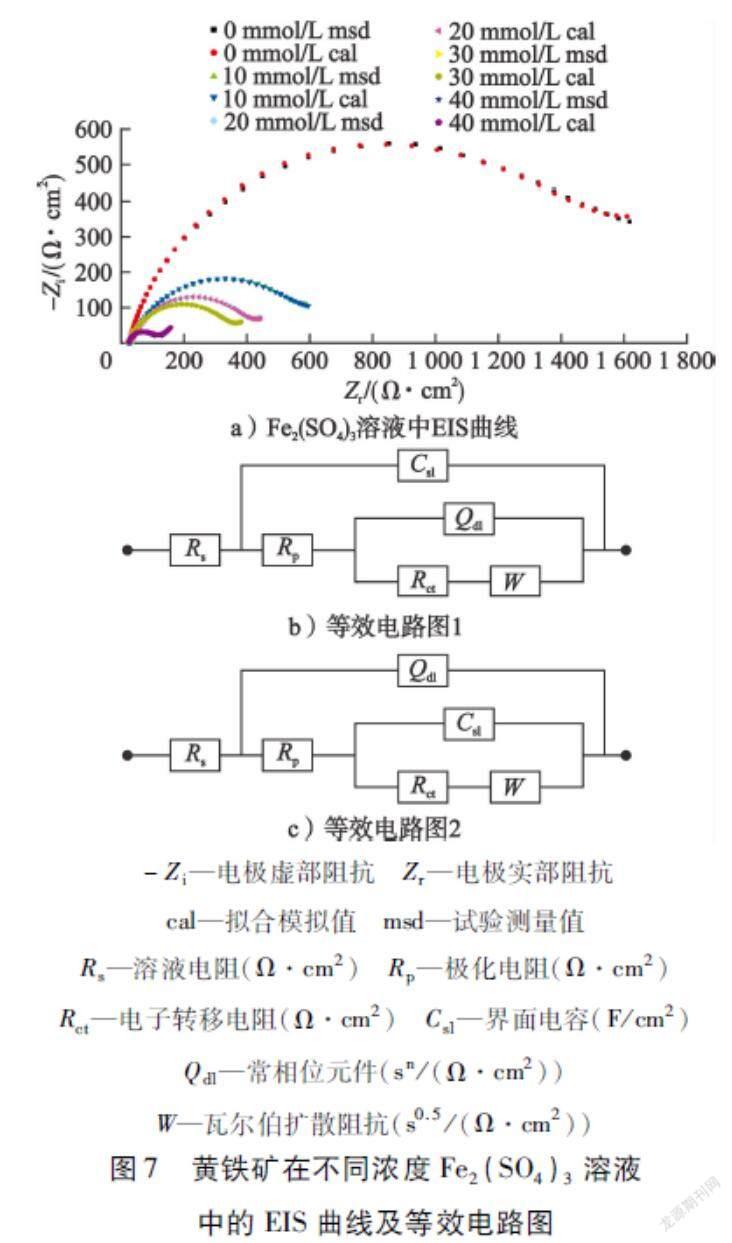
试验对黄铁矿电极分别在0 mmol/L、5 mmol/L、10 mmol/L、15 mmol/L、20 mmol/L Fe2(SO4)3溶液和0 mmol/L、10 mmol/L、20 mmol/L、30 mmol/L、40 mmol/L FeCl3溶液中的电化学阻抗谱(EIS)曲线进行测定,EIS曲线及拟合的等效电路图如图7和图8所示。试验中测定电压为0.5 V,频率为105~10-1Hz,振幅为5 mV。 采用Zsimpwin3.10软件对黄铁矿在不同浓度Fe2(SO4)3和FeCl3溶液中等效电路图中各元件参数进行了计算,结果如表4和表5所示。
从图7、图8可以看出:黄铁矿在不同浓度Fe2(SO4)3和FeCl3溶液中的电化学阻抗谱中低频区出现一个瓦尔伯扩散阻抗(W),表明黄铁矿在该电压下的电化学反应过程存在扩散控制,极有可能是该电压下形成的SL(由Fe1-xS2、S2-n及S组成的混合物)阻碍了反应物扩散至电极表面及氧化产物从电极表面扩散至电解液中[6]。另外,发现中频段的弧形即电子转移电阻(Rct)随着Fe2(SO4)3和 FeCl3浓度的增大而减小,这与表4和表5中的Rct数据一致。
黄铁矿在0 mmol/L、10 mmol/L、15 mmol/L Fe2(SO4)3溶液中的阻抗用等效电路Rs(Csl(Rp(Qdl(RctW))))来描述与拟合,等效电路图如图7-b)所示;在5 mmol/L和20 mmol/L Fe2(SO4)3溶液中的阻抗则用Rs(Qdl(Rp(Csl(RctW))))来描述与拟合,等效电路图如图7-c)所示;而黄铁矿在FeCl3溶液中的阻抗均可用等效电路Rs(Csl(Rp(Qdl(RctW))))来描述与拟合,等效电路图如图8-b)所示。从表4、表5可以看出:电子转移电阻(Rct)随着Fe2(SO4)3与FeCl3浓度的增加而减小,瓦尔伯扩散阻抗(W)随着Fe2(SO4)3与FeCl3浓度的增加而增大。Rct在一定程度上反映出黄铁矿电极表面电化学氧化速率的快慢[16]。Fe2(SO4)3浓度由0 mmol/L增加到20 mmol/L,Rct由1 534 Ω/cm2降低至101.2 Ω/cm2,这说明Fe2(SO4)3浓度增大,电子转移速率加快,黄铁矿表面氧化速率加快,因而Rct逐渐减小。
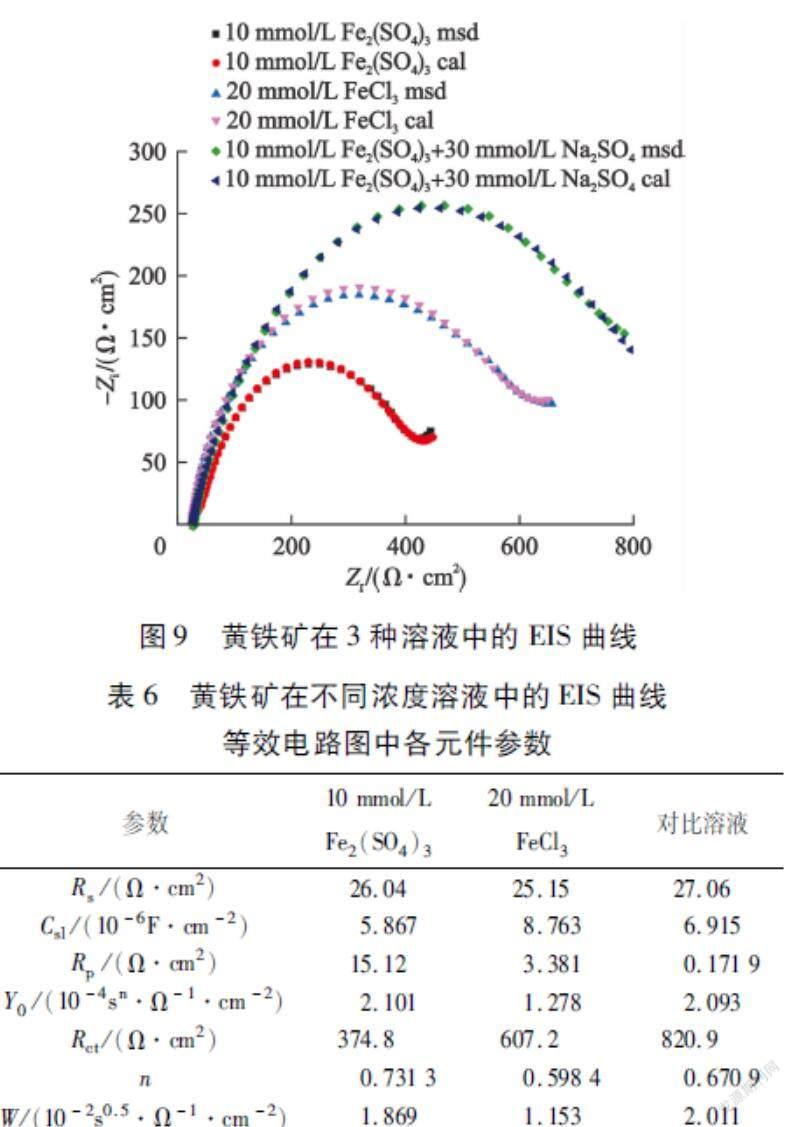
为了研究阴离子种类和浓度的影响,试验亦对黄铁矿在10 mmol/L Fe2(SO4)3+30 mmol/L Na2SO4溶液(对比溶液)中的EIS曲线进行了测定及等效电路图的拟合与各元件参数的计算,结果如图9、表6所示。
从图9可以看出:SO2-4的引入及浓度的增大提高了电子转移电阻(Rct),该结果与表6中的计算结果一致。这表明SO2-4浓度的增大使电子转移电阻增大,从而降低了电子转移速率,最终导致黄铁矿表面氧化速率降低。同时,黄铁矿在该对比溶液中的阻抗用等效电路Rs(Qdl(Rp(Csl(RctW))))来描述与拟合,等效电路图如图7-c)所示,这也说明了SO2-4的引入不会改变黄铁矿氧化机理,但会影响其表面氧化速率。在阴、阳离子浓度相同且变量为阴离子种类的条件下,发现黄铁矿在20 mmol/L FeCl3溶液中的电子转移电阻更小,说明黄铁矿在含Cl-溶液中比在含SO2-4溶液中的氧化速率更快,这是因为Cl-在一定程度上可以加快黄铁矿表面氧化速率,而SO2-4会降低黄铁矿表面氧化速率;另外,表6中的n也反映了这一点,黄铁矿在20 mmol/L FeCl3溶液中的n较小,为0.598 4,而在对比溶液中的n为0.670 9,说明黄铁矿在含Cl-溶液中的氧化速率较快。
3结论
1)从开路电位及Tafel曲线的数据得出,SO2-4可以降低黄铁矿的开路电位(Eocp)和腐蚀电位(Ecorr),可通过增大阴、阳极斜率,减小腐蚀电流密度等方式来降低黄铁矿表面氧化速率。
2)循环伏安曲线和电化学阻抗谱显示,SO2-4不会改变黄铁矿氧化机理,但其引入会造成电子转移电阻的增大,从而导致黄铁矿表面氧化速率降低。
3)根据电化学测试结果可判断出,Fe2(SO4)3与FeCl3的引入能够促进黄铁矿的氧化,且起加快氧化作用的主要是Fe3+和Cl-。
[参 考 文 献]
[1]BIEGLER T,SWIFT D A.Anodic behaviour of pyrite in acid solutions[J].Electrochimica Acta,1979,24(4):415-420.
[2]FENG J L,TIAN H,HUANG Y L,et al.Directional oxidation of pyrite in acid solution[J].Minerals,2018,9(1):1-9.
[3]林森,李和平.黄铁矿在不同pH值硫酸钠溶液中的电化学腐蚀研究[J].矿物岩石地球化学通报,2014,33(4):526-530.
[4]ANTONIJEVI'C M M,DIMITRIJEVI'C M D,ERBULAS M,et al.Influence of inorganic anions on electrochemical behaviour of pyrite[J].Electrochimica Acta,2005,50(20):4 160-4 167.
[5]TU Z H,WAN J J,GUO C L,et al.Electrochemical oxidation of pyrite in pH 2 electrolyte[J].Electrochimica Acta,2017,239:25-35.
[6]涂志红.黄铁矿氧化过程中硫形态转化及其表面氧化电化学研究[D].廣州:华南理工大学,2017.
[7]孙小俊,李建华.黄铁矿在酸性体系下的电化学研究[J].金属矿山,2011(9):72-75.
[8]刘云.黄铁矿氧化机理及表面钝化行为的电化学研究[D].广州:华南理工大学,2011.
[9]王楠.酸性条件下黄铁矿氧化过程的电化学研究[D].广州:华南理工大学,2012.
[10]DUTRIZAC J E.The dissolution of chalcopyrite in ferric sulfate and ferric chloride media[J].Metallurgical Transactions B,1981,12(2):371-378.
[11]王楠,易筱筠,党志,等.酸性条件下黄铁矿氧化机制的研究[J].环境科学,2012,33(11):3 916-3 921.
[12]NICOL M,ZHANG S C,TJANDRAWAN V.The electrochemistry of pyrite in chloride solutions[J].Hydrometallurgy,2018,178:116-123.
[13]RIMSTIDT J D,VAUGHAN D J.Pyrite oxidation:a stateoftheart assessment of the reaction mechanism[J].Geochimica et Cosmochimica Acta,2003,67(5):873-880.
[14]FENG J L,TIAN H,HUANG Y L,et al.Pyrite oxidation mechanism in aqueous medium[J].Journal of the Chinese Chemical Society,2019,66(4):345-354.
[15]KELSALL G H,YIN Q,VAUGHAN D J,et al.Electrochemical oxidation of pyrite(FeS2) in aqueous electrolytes[J].Journal of Electroanalytical Chemistry,1999,471(2):116-125.
[16]ZHANG Y,ZI F T,HU X Z,et al.Mechanism of pyrite oxidation in copper(Ⅱ)-ethylenediamine-thiosulphate gold leaching system[J].Electrochimica Acta,2021,390:138752.
Electrochemical oxidation mechanism of pyrite in ferric sulfate and ferric chlorideMao Wangbin,Li Baizhuang,Li Jiarui,Tang Jiahua,Zhang Yan
(Faculty of Science,Kunming University of Science and Technology)
Abstract:Electrochemical testing techniques including open circuit potential,cyclic voltammetry,Tafel curves and electrochemical impedance spectroscopy were used to study the electrochemical oxidation mechanism of pyrite at pH=1.0 with different concentrations of Fe2(SO4)3 and FeCl3;in addition,the effects of SO2-4 and Cl- on the oxidation mechanism of pyrite at the same Fe3+ concentration were investigated.The experimental results show that Fe2(SO4)3 and FeCl3 can promote the oxidation of pyrite,and Fe3+ and Cl- are the ions that play the role; SO2-4 does not change the oxidation mechanism of pyrite,but the increase of its concentration will increase the electron transfer resistance and thus reduce the surface oxidation rate of pyrite.These findings provide new insights into the oxidation mechanism of pyrite,and are of reference value for the practical application of pyrite.
Keywords:electrochemical oxidation;pyrite;ferric sulfate;ferric chloride;oxidation mechanism
收稿日期:2021-07-12; 修回日期:2021-09-19
基金項目:中国博士后科学基金面上项目(2019M663577);昆明理工大学分析测试基金项目(2019T20182015);昆明理工大学高层次人才科研启动经费项目
作者简介:毛王彬(2001—),男,浙江衢州人,大学本科,研究方向为半导体矿物电化学氧化机理;昆明市呈贡大学城景明南路727号,昆明理工大学理学院,650500;Email:728256460@qq.com
*通信作者,Email:zhangyan_ecnu@163.com,13764751439
