以四氢呋喃为醛基砌块合成(E)⁃α⁃羟乙基⁃α,β⁃不饱和醛
2021-12-16濮伟雯史永森刘建峰柯德宏吴孝兰
濮伟雯,史永森,刘建峰,柯德宏,吴孝兰,许 胜
(1.华东理工大学化学与分子工程学院,上海200237;2.国药集团化学试剂有限公司,上海200002)
α,β-不饱和醛广泛存在于自然界中,其共轭结构导致其具有特殊性质[1,2],而羟基官能团化的α,β-不饱和醛同时含有碳碳双键、醛基和羟基3个可以修饰的官能团,因此化学性质活泼,具有广阔的应用前景.自然界中,许多具有生物或类药物特性的天然产物均含有α-羟乙基-α,β⁃不饱和醛单元(Scheme 1)[3~5],该类化合物可作为原料制备复杂化合物[6].如Kobayashi等[7]以α-羟甲基肉桂醛为原料,经过7步反应,合成了对20S蛋白酶具有选择性抑制作用的Omuralide[8].Miyazawa等[9]将不饱和内酯水解得到羟基醛,转化为叠氮化物,然后关环制得取代的吡咯啉衍生物.
Di等[10]采用α-羟烷基不饱和醛为原料,经Heck反应、氯代反应和傅-克烷基化反应,制备了一类能与S1P受体结合的新型化合物(Scheme 2).
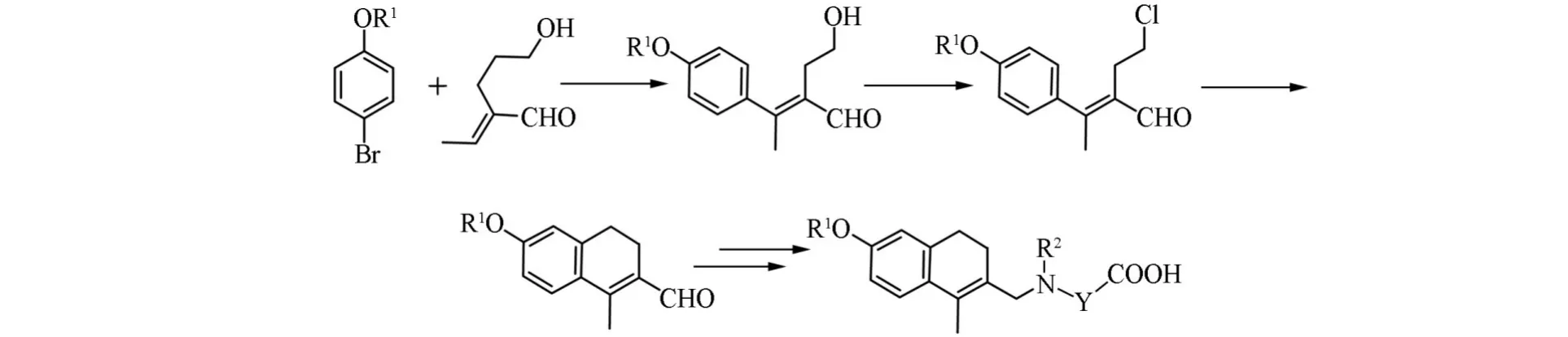
Scheme 2 Synthesis of compounds that bind to receptors of the S1P
迄今,关于该类化合物合成方法的研究报道很少.2003年,Denmark等[11]使用预制备的环硅醚在[(allyl)PdCl]2与CuI双催化体系下与芳基碘化合物反应制备(Z)-β-羟乙基-α,β-不饱和醛[Scheme 3(A)],这是首次合成该类化合物.2007年,Kobayashi等[12]以肉桂醛为原料,经过6步反应制备了(E)-α-羟乙基-α,β-不饱和醛[Scheme 3(B)],总收率约为58%.2010年,Inokuchi等[13]使用4-BzOTEMPOPhI(OAc)2-p-TsOH催化体系,以预制备的二醇为底物,选择性氧化其中一个羟基制备α-羟甲基-α,β-不饱和醛,得到顺反异构混合物[Scheme 3(C)].
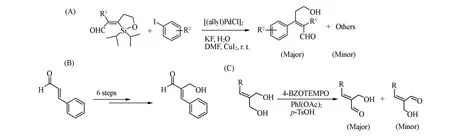
Scheme 3 Preparation of hydroxyalkyl⁃α,β⁃unsaturated aldehyde with Palladium catalyst(A),α,β⁃unsaturated aldehyde with Kobayashi’s method(B)and hydroxyalkyl⁃α,β⁃unsaturated aldehyde by oxidation(C)
由于THF分子中含有醚键,可以作为有机合成原料用于构建一系列功能分子或高分子化合物.其α位氢原子具有一定的活性,在TBHP[14]或其它催化体系[15~17]下均可制备半缩醛形式的2-羟基四氢呋喃,随后开环得到4-羟基丁醛.利用该性质,Zhang等[18]以2-羟基四氢呋喃为原料,开环后与脯氨酸缩合生成烯胺中间体,再与亲电试剂反应关环得到手性呋喃衍生物.本文将苄醇原位氧化为苯甲醛,再与羟基官能团化的脂肪醛的亚胺中间体发生交叉aldol缩合反应,一锅法制得α-羟烷基-α,β-不饱和醛.直接使用THF作为醛基砌块,为该类化合物的合成提供了新思路.
1 实验部分
1.1 试剂与仪器
苯甲醇,间甲基、对甲基、邻甲基、对异丙基、对叔丁基、对苯基,对甲氧基、间甲氧基、对三氟甲基、间三氟甲基、对氟、间氟、对氯、对溴、2,4-二氯和间溴取代苯甲醇,2-吡啶甲醇,2-呋喃甲醇,四氢呋喃(THF),乙醇胺,甲酸,过氧化叔丁醇(TBHP),ZrO2,MnO2,PdCl2,ZnCl2,ZrCl4,MnSO4·H2O,Ni(OAc)2及FeCl2·4H2O等购自国药集团上海化学试剂公司,均为分析纯,使用前未经进一步处理;柱层析所用硅胶为FCP 200~300.
Bruker AVANCEⅢ400MHz型核磁共振波谱仪(NMR),德国Bruker公司,以CDCl3为溶剂,以TMS为内标;4800 plus型质谱仪(MS),新加坡ABS公司,采用EI方式在70 eV下测定.
1.2 实验过程
1.2.1α-羟乙基-α,β-不饱和醛化合物的合成合成路线1(Scheme 4):在反应瓶中加入1.0 mmol化合物1,16 mg(0.08 mmol)Cu(OAc)2,0.1 mL TBHP(1 mmol,质量分数为70%的水溶液),于75℃密封反应2 h;然后加入0.4 mL(5 mmol)THF,23 mg(0.5 mmol)HCOOH,30 mg(0.5 mmol)乙醇胺,补加0.2 mL(2 mmol,质量分数为70%的水溶液)TBHP,密封后继续反应3 h;停止反应,冷却后用10 mL NaHCO3溶液处理,用CH2Cl2(3 mL×5)萃取,合并有机相,用饱和食盐水洗涤(4 mL×5),用无水MgSO4干燥,过滤,减压蒸发脱除溶剂,所得产物用石油醚/乙酸乙酯混合溶液[V(PE)∶V(EA)=5∶1]进行柱层析纯化.
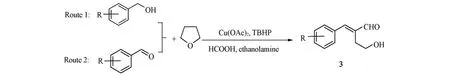
Scheme 4 Synthese routes of compound 3
合成路线2(Scheme 4):在反应瓶中加入10 mg(0.05 mmol)Cu(OAc)2,30 mg(0.5 mmol)乙醇胺,0.4 mL(5 mmol)THF,23 mg(0.5 mmol)HCOOH和0.1 mL TBHP(1.0 mmol,70%水溶液),于75℃密封反应2 h;再加入(1.0 mmol)化合物2,密封后继续反应3 h;停止反应,冷却后用10 mL NaHCO3溶液处理,用CH2Cl2(3 mL×5)萃取,合并有机相,用饱和食盐水洗涤(4 mL×5),用无水MgSO4干燥,过滤,减压脱除溶剂,所得产物用石油醚/乙酸乙酯混合溶液[V(PE)∶V(EA)=5∶1]进行柱层析纯化.
1.2.2 化合物3的合成按照合成路线1合成(E)-2-羟乙基肉桂醛(3a),经柱层析纯化得白色固体93 mg,收率53%,m.p.81~83℃.1H NMR(400 MHz,CDCl3),δ:9.50(s,1H),7.49~7.44(m,2H),7.33(d,J=8.1 Hz,3H),7.16(s,1H),3.74(t,J=6.5 Hz,2H),2.76(t,J=6.5 Hz,2H),1.92(s,1H);13C NMR(101 MHz,CDCl3),δ:196.62,152.62,139.77,134.58,130.12,129.83,129.02,61.49,28.67;EI-HRMS(C11H12O2理论值),m/z:176.0836(176.0837).
按照合成路线1合成(E)-2-羟乙基-3-(2-甲基苯基)丙烯醛(3b),经柱层析纯化得白色固体78 mg,收率41%,m.p.73~75℃.1H NMR(400 MHz,CDCl3),δ:9.67(s,1H),7.61(s,1H),7.41(d,J=7.3 Hz,1H),7.30(dd,J=14.1,6.1 Hz,3H),3.77(t,J=6.4 Hz,2H),3.06(s,1H),2.71(t,J=6.4 Hz,2H),2.36(s,3H);13C NMR(101 MHz,CDCl3),δ:196.46,151.62,140.48,136.77,133.61,130.40,129.45,128.40,125.99,61.12,28.58,19.93;EI-HRMS(C12H14O2理论值),m/z:190.0889(190.0994).
按照合成路线1合成(E)-2-羟乙基-3-(3-甲基苯基)丙烯醛(3c),经柱层析纯化得白色固体85 mg,收率45%,m.p.71~74℃.1H NMR(400 MHz,CDCl3),δ:9.57(s,1H),7.36(d,J=13.2 Hz,4H),7.24(s,1H),3.82(s,2H),2.85(s,2H),2.40(s,3H),2.36(s,1H);13C NMR(101 MHz,CDCl3),δ:196.70,152.90,139.54,138.67,134.51,130.90,130.60,128.86,126.77,61.38,28.66,21.53;EI-HRMS(C12H14O2理论值),m/z:190.0993(190.0994).
按照合成路线1合成(E)-2-羟乙基-3-(4-甲基苯基)丙烯醛(3d),经柱层析纯化得白色固体93 mg,收率49%,m.p.72~74℃.1H NMR(400 MHz,CDCl3),δ:9.63(s,1H),7.59(d,J=7.8 Hz,2H),7.43(s,1H),7.35(d,J=7.6 Hz,2H),3.91(t,J=6.6 Hz,2H),3.10(s,1H),2.96(t,J=6.6 Hz,2H),2.49(s,3H);13C NMR(101 MHz,CDCl3),δ:196.72,152.82,140.73,138.85,131.79,130.02,129.78,61.44,28.68,21.59;EI-HRMS(C12H14O2理论值),m/z:190.0992(190.0994).
按照合成路线1合成(E)-2-羟乙基-3-(4-异丙基苯基)丙烯醛(3e),得浅黄色固体104 mg,收率48%,m.p.68~71℃.1H NMR(400 MHz,CDCl3),δ:9.58(s,1H),7.57(d,J=8.2 Hz,2H),7.39(s,1H),7.35(d,J=8.2 Hz,2H),3.85(t,J=6.7 Hz,2H),2.99(d,J=13.8,6.9 Hz,1H),2.90(t,J=6.8 Hz,2H),1.30(d,J=6.9 Hz,6H);13C NMR(101 MHz,CDCl3),δ:196.69,152.75,151.46,138.68,132.07,130.15,127.09,61.21,34.13,28.61,23.83,23.79;ESI-HRMS(C14H18O2Na理论值),m/z:241.1188(241.1204)(M+Na)+.
按照合成路线1合成(E)-2-羟乙基-3-(4-叔丁基苯基)丙烯醛(3f),经柱层析纯化得黄色固体104 mg,收率45%.1H NMR(400 MHz,CDCl3),δ:9.55(s,1H),7.53(d,J=8.4 Hz,2H),7.46(d,J=8.5 Hz,2H),7.36(s,1H),3.82(t,J=6.7 Hz,2H),2.87(t,J=6.7 Hz,2H),2.62(s,1H),1.33(s,9H);13C NMR(101 MHz,CDCl3),δ:196.71,153.76,152.67,138.81,131.72,129.92,125.98,61.25,34.99,31.20,28.64;EI-HRMS(C15H20O2理论值),m/z:232.1464(232.1463).
按照合成路线1合成(E)-2-羟乙基-3-(4-苯基苯基)丙烯醛(3g),经柱层析纯化得白色固体131 mg,收率51%,m.p.83~84℃.1H NMR(400 MHz,CDCl3),δ:9.61(s,1H),7.71~7.62(m,6H),7.49~7.38(m,4H),3.87(t,J=6.5 Hz,2H),2.91(t,J=6.5 Hz,2H),2.20(s,1H);13C NMR(101 MHz,CDCl3),δ:196.47,152.08,142.66,139.86,139.22,133.36,130.45,128.98,128.01,127.43,127.06,61.02,28.59;ESI-HRMS(C17H16O2Na理论值),m/z:275.1045(275.1048)(M+Na)+.
按照合成路线1合成(E)-2-羟乙基-3-(4-甲氧基苯基)丙烯醛(3h),经柱层析纯化得白色固体91 mg,收率44%,m.p.77~79℃.1H NMR(400 MHz,CDCl3),δ:9.51(s,1H),7.55(d,J=8.8 Hz,2H),7.29(s,1H),6.95(d,J=8.8 Hz,2H),3.84(s,3H),3.80(t,J=5.8 Hz,2H),2.85(t,J=6.7 Hz,2H),2.50(s,1H);13C NMR(101 MHz,CDCl3),δ:196.60,161.21,152.58,137.24,132.09,127.21,114.44,61.08,55.46,28.56;ESI-HRMS(C12H14O3Na理论值),m/z:(229.0841)(M+Na)+.
按照合成路线1合成(E)-2-羟乙基-3-(3-甲氧基苯基)丙烯醛(3i),经柱层析纯化得白色固体105 mg,收率51%,m.p.75~77℃.1H NMR(400 MHz,CDCl3),δ:9.54(s,1H),7.37~7.32(m,2H),7.16(s,1H),7.14(s,1H),6.95(d,J=9.1 Hz,1H),3.82(s,3H),3.80(t,J=6.6 Hz,2H),3.09(s,1H),2.83(t,J=6.6 Hz,2H);13C NMR(101 MHz,CDCl3),δ:196.54,159.72,152.48,139.77,135.75,129.92,122.15,115.56,115.10,61.16,55.44,28.58;EI-HRMS(C12H14O3理论值),m/z:206.0945(206.0943).
按照合成路线1合成(E)-2-羟乙基-3-(4-三氟甲基苯基)丙烯醛(3j),经柱层析纯化得白色固体190 mg,收率78%,m.p.88~90℃.1H NMR(400 MHz,CDCl3),δ:9.59(s,1H),7.67(s,4H),7.42(s,1H),3.79(t,J=6.5 Hz,2H),2.77(t,J=6.5 Hz,2H);13C NMR(101 MHz,CDCl3),δ:196.04,150.39,141.42,130.27(q,J=32.8 Hz),128.70,127.49,124.68(q,J=3.81 Hz),122.77(q,J=272.18 Hz),61.02,28.47;EI-HRMS(C12H11F3O2理论值),m/z:244.0712(244.0711).
按照合成路线1合成(E)-2-羟乙基-3-(3-三氟甲基苯基)丙烯醛(3k),经柱层析纯化得白色固体168 mg,收率69%,m.p.83~85℃.1H NMR(400 MHz,CDCl3),δ:9.64(s,1H),7.84(s,1H),7.80(d,J=7.7 Hz,1H),7.67(d,J=7.9 Hz,1H),7.59(t,J=7.7 Hz,1H),7.45(s,1H),3.87(d,J=11.8,6.2 Hz,2H),2.80(t,J=6.3 Hz,2H);13C NMR(101 MHz,CDCl3),δ:196.03,195.99,150.42,150.39,141.21,135.30,132.52,131.58,131.26,129.50,126.51,126.47,126.42,126.38,125.23,122.52,61.12,28.47;ESI-HRMS(C12H11O2NaF3理论值),m/z:267.0609(267.0597)(M+Na)+.
按照合成路线1合成(E)-2-羟乙基-3-(4-氟苯基)丙烯醛(3l),经柱层析纯化得 淡黄色固体118 mg,收率61%.m.p.76~79℃.1H NMR(400 MHz,CDCl3),δ:9.55(s,1H),7.59(d,J=8.7,5.4 Hz,2H),7.35(s,1H),7.13(t,J=8.7 Hz,2H),3.81(t,J=6.5 Hz,2H),2.81(t,J=6.5 Hz,2H),2.39(s,1H);13C NMR(101 MHz,CDCl3),δ:196.32,163.58(d,J=251.9 Hz),151.29,139.30(d,J=1.4 Hz),131.94(d,J=8.5 Hz),130.74(d,J=3.5 Hz),116.15(d,J=21.8 Hz),61.12,28.44;EI-HRMS(C11H11FO2理论值),m/z:194.0742(194.0743).
按照合成路线1合成(E)-2-羟乙基-3-(3-氟苯基)丙烯醛(3m),经柱层析纯化得白色固体151 mg,收率78%.1H NMR(400 MHz,CDCl3),δ:9.64(s,1H),7.84(s,1H),7.80(d,J=7.7 Hz,1H),7.67(d,J=7.9 Hz,1H),7.59(t,J=7.7 Hz,1H),7.45(s,1H),3.87(d,J=11.8,6.2 Hz,2H),2.80(t,J=6.3 Hz,2H);13C NMR(101 MHz,CDCl3),δ:196.03,195.99,150.42,150.39,141.21,135.30,132.52,131.58,131.26,129.50,126.51,126.47,126.42,126.38,125.23,122.52,61.12,28.47;ESI-HRMS(C12H11O2NaF3理论值),m/z:267.0609(267.0597)(M+Na)+.
按照合成路线1合成(E)-2-羟乙基-3-(4-氯苯基)丙烯醛(3n),经柱层析纯化得淡黄色固体149 mg,收率71%,m.p.77~78℃.1H NMR(400 MHz,CDCl3),δ:9.52(s,1H),7.51(d,J=8.5 Hz,2H),7.37(d,J=8.5 Hz,2H),7.31(s,1H),3.76(t,J=6.6 Hz,2H),3.02(s,1H),2.77(t,J=6.6 Hz,2H);13C NMR(101 MHz,CDCl3),δ:196.19,151.02,139.93,136.07,132.94,131.06,129.20,61.02,28.47;EI-HRMS(C11H11ClO2理论值),m/z:210.0449(210.0448).
按照合成路线1合成(E)⁃2⁃羟乙基-3-(3,5-二氯苯基)丙烯醛(3o),经柱层析纯化得橘色固体159 mg,收率65%,m.p.83~86℃.1H NMR(400 MHz,CDCl3),δ:9.67(s,1H),7.62(d,J=8.4 Hz,1H),7.56(s,1H),7.50(d,J=2.0 Hz,1H),7.32(d,J=8.4,2.1 Hz,1H),3.80(t,J=6.2 Hz,2H),2.67(t,J=6.2 Hz,2H);13C NMR(101 MHz,CDCl3),δ:195.83,147.66,141.69,136.15,135.03,131.48,131.12,129.92,127.46,61.08,28.61;EI-HRMS(C11H10Cl2O2理 论 值),m/z:244.0055(244.0058).
按照合成路线1合成(E)-2-羟乙基-3-(4-溴苯基)丙烯醛(3p),经柱层析纯化得淡黄色固体212 mg,收率83%,m.p.80~83℃.1H NMR(400 MHz,CDCl3),δ:9.54(s,1H),7.54(t,J=8.5 Hz,2H),7.43(d,J=24.2,8.4 Hz,2H),7.32(d,J=7.7 Hz,1H),3.79(t,J=6.6 Hz,2H),2.99(s,1H),2.81~2.76(m,2H);13C NMR(101 MHz,CDCl3),δ:196.31,151.18,139.90,132.21,131.67,128.67,121.45,64.51,28.46;EI-HRMS(C11H11BrO2理论值),m/z:255.9927(255.9942).
按照合成路线1合成(E)-2-羟乙基-3-(3-溴苯基)丙烯醛(3q),经柱层析纯化得浅黄色固体224 mg,收率88%.1H NMR(400 MHz,CDCl3),δ:9.54(s,1H),7.53(d,J=8.5 Hz,2H),7.46(d,J=8.5 Hz,2H),7.32(s,1H),3.79(t,J=6.6 Hz,2H),2.99(s,1H),2.80(t,J=6.6 Hz,2H);13C NMR(101 MHz,CDCl3),δ:196.31,151.18,139.90,132.21,131.67,128.67,121.45,64.51,28.46;EI-HRMS(C11H11BrO2理论值),m/z:255.9922(255.9942).
按照合成路线2合成(E)-2-羟乙基-3-(2-吡啶基)丙烯醛(3s),经柱层析纯化得黄色固体103 mg,收率58%.1H NMR(400 MHz,CDCl3),δ:9.64(s,1H),8.61(d,J=4.7 Hz,1H),7.82(td,J=7.7,1.7 Hz,1H),7.47(d,J=7.8 Hz,1H),7.40(s,1H),7.35(d,J=7.5,5.0 Hz,1H),5.93(s,1H),3.90—3.84(t,2H),3.00~2.94(t,2H);13C NMR(101 MHz,CDCl3),δ:195.12,152.76,149.00,148.14,143.86,137.77,126.29,124.61,61.86,27.43;EI-HRMS(C10H11NO2理 论 值),m/z:177.0788(177.0790).
按照合成路线2合成(E)-2-羟乙基-3-(2-呋喃基)丙烯醛(3t),经柱层析纯化得淡黄色固体93 mg,收率56%.1H NMR(400 MHz,CDCl3),δ:9.46(s,1H),7.60(d,J=1.6 Hz,1H),7.03(s,1H),6.82(d,J=3.5 Hz,1H),6.53(d,J=3.5,1.8 Hz,1H),3.72(t,J=6.7 Hz,2H),2.94(t,J=6.7 Hz,2H);13C NMR(101 MHz,CDCl3),δ:195.15,151.04,146.04,136.87,135.66,118.01,112.82,61.45,28.63;EI-HRMS(C9H10O3理论值),m/z:166.0636(166.0630).
2 结果与讨论
2.1 化合物3的合成
苯甲醇是一种常见的芳香醇类化合物,性质比苯甲醛稳定,能够在铜催化下氧化为苯甲醛,进一步与4-羟基丁醛进行交叉aldol缩合反应制备目标产物.但4-羟基丁醛极易发生分子内缩合,商业上难以获得,因此目前还未见文献报道此方法.本文使用有机胺对醛进行缩合反应得到亚胺,通过亚胺捕捉不稳定的4-羟基丁醛,从而提高了4-羟基丁醛的稳定性,使得交叉aldol反应能够进行下去.实验中对影响反应的因素进行了考察.
2.1.1 胺、金属催化剂、氧化剂、酸碱及反应温度对反应的影响考察了不同的有机胺对反应的影响,结果见表1.
由表1可见,加入伯胺后可顺利得到产物,收率在29%~53%之间(表1中Entries 2~9).这些伯胺中乙醇胺的效果最好(表1中Entry 5);苯胺只能得到微量目标产物,可能是苯胺与苯甲醛(苯甲醇原位氧化得到)或4-羟基丁醛(2-羟基四氢呋喃开环得到)生成的亚胺活性中间体过于稳定,不能进行后续反应所致;甲胺不能得到目标产物,其原因可能是甲胺生成的亚胺不太稳定.加入仲胺脯氨酸和四氢吡咯、叔胺四甲基乙二胺或三乙胺(表1中Entries 11~14),均未检测到目标产物的生成,这可能是因为仲胺与醛难以形成活性中间体,而叔胺不与醛反应.上述结果表明,有机胺是反应的关键添加物.
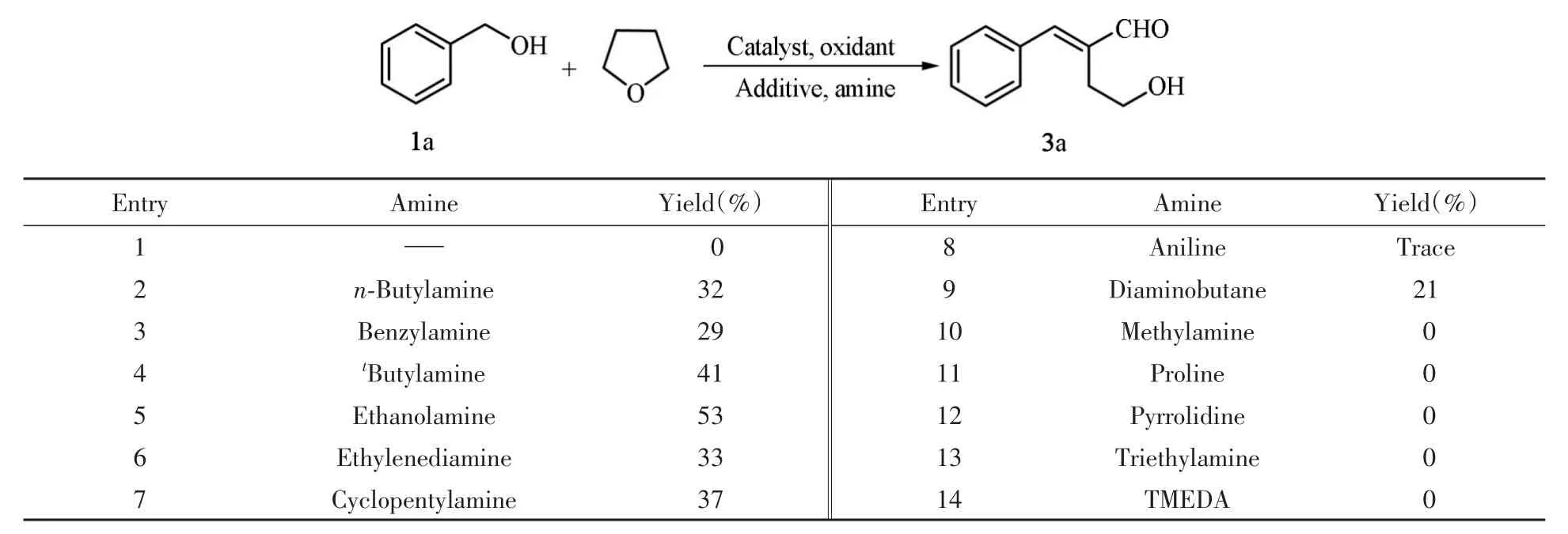
Table 1 Effect of organic amines on the reaction*
催化剂的筛选结果列于表2.不加催化剂时无产物生成(表2中Entry 1),表明金属催化剂在反应中起决定性作用;在各种铜催化剂(表2中Entries 2~8)中Cu(OAc)2可以得到53%的目标产物,其它铜催化剂产率略有降低.其它金属催化剂如ZrO2,MnO2和PdCl2只能得到微量产物(表2中Entries 9~11);而ZrCl4,ZnCl2,ZrCl4,MnSO4·H2O,Ni(OAc)2和FeCl2·4H2O不能得到目标产物(表2中Entries 12~16).考虑MnO2对醇的氧化性能[19],尝试使用MnO2与Cu(OAc)2双催化体系促进反应,但产率并未提高(表2中Entry 17),表明反应中真正有效的催化剂为铜.
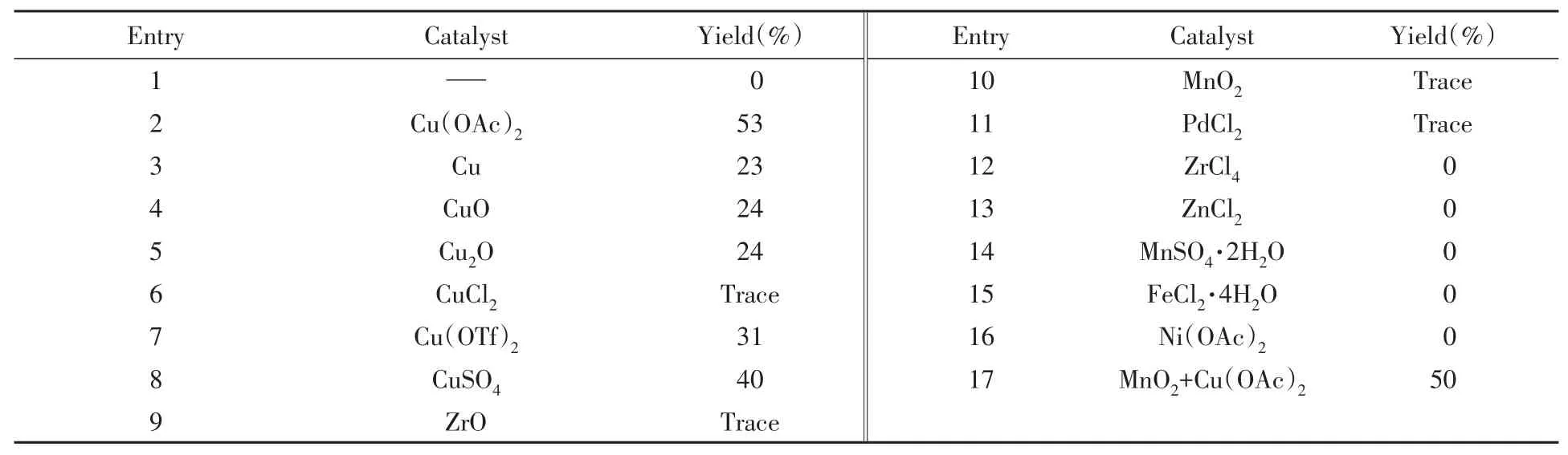
Table 2 Effect of metal catalysts on the reaction*
氧化剂的筛选结果如表3所示.分别考察了无水TBHP、H2O2、二叔丁基过氧化物(DTBP)、间氯过氧苯甲酸(mCPBA)、过氧化二苯甲酰(BPO)和偶氮二甲酸二乙酯(DEAD)等(表3中Entries 1~8)对反应的影响,发现使用无机氧化剂如K2S2O8不能得到目标化合物(表3中Entry 9).过氧化物中仅TBHF有活性,与含水TBHP相比,无水TBHP的产率略微降低,表明微量的水可以促进反应.作为本反应的氧化剂,一方面要能够将苯甲醇氧化为苯甲醛,而不能过度氧化成苯甲酸;另一方面,氧化剂要能够氧化THF产生2-羟基四氢呋喃.实验结果表明,常用的TBHP产率最好.
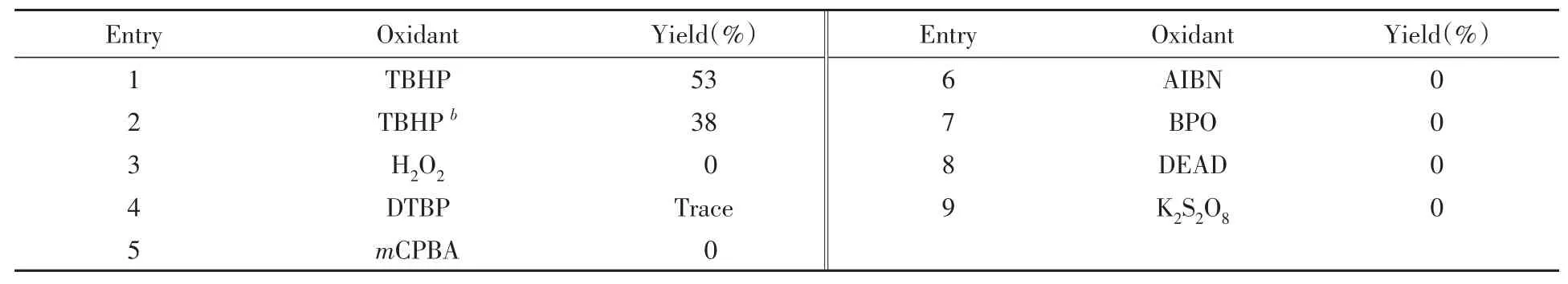
Table 3 Effect of oxidants on the reactiona
酸碱添加剂的筛选结果如表4所示.可见,不加酸时仅能得到31%的产物(表4中Entry 1).考虑到酸碱有利于半缩醛开环和随后的aldol缩合反应,因此筛选了一系列的酸碱,考察其对反应的影响.结果表明,有机酸有利于提高产率(表4中Entries 2~3),最佳的为甲酸.有机碱可以得到微量的产物(表4中Entries 5~6),而无机酸碱不能得到产物(表4中Entries 7~10).以上结果表明,有机酸有利于半缩醛形式的2-羟基四氢呋喃开环形成4-羟基丁醛,也有利于aldol缩合反应脱水形成更稳定的不饱和醛.
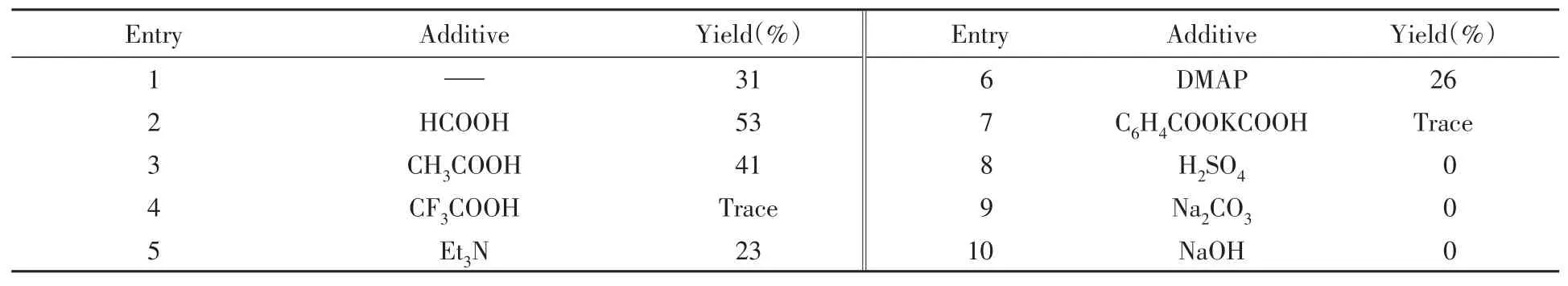
Table 4 Effect of additives on the reaction*
温度的影响结果如表5所示,可见在25°C时反应不能进行(Entry 1),可能是因为温度较低时不足以达到反应的能垒;50°C时可以得到微量产物;随着反应温度的升高,收率逐渐增加,75°C时得到最高的收率(表5中Entries 2~4);继续升高温度可能导致副反应增加,收率不再增加(表5中Entry 5).
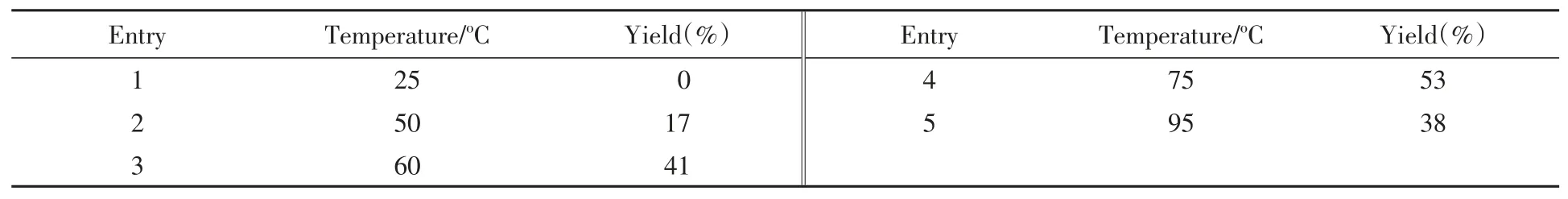
Table 5 Effects of temperature on the reaction*
2.1.2 反应底物的普适性研究在最佳反应条件下(表1中Entry 5),对官能团的兼容性进行了研究.实验结果列于Scheme 5,可以发现,苯环上取代基无论是给电子或吸电子基团均可得到相应的α-羟乙基-α,β-不饱和醛(最高达88%).当取代基为甲基、异丙基和叔丁基时,产率依次降低.当取代基为如氟、氯、溴及三氟甲基等吸电子基团产率显著提高,原因可能是吸电子取代基降低了苯环电子云密度并活化羰基,使其更容易被亲核试剂进攻并发生缩合反应.对比化合物3b,3c和3d发现,取代基的位置对于该反应有较大的影响,对位时产率最高.
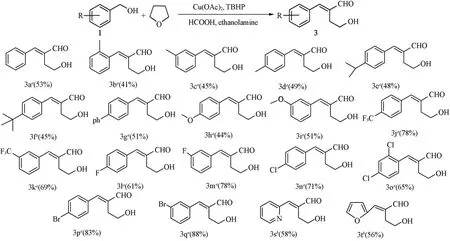
Scheme 5 Study of substrate scope
研究结果表明,本文方法的底物普适性较为宽广,采用芳香杂环醛底物同样能够得到目标产物.
2.2 化合物3的构型
对所合成的化合物采用1H NMR,13C NMR和HRMS进行表征,确认了其化学组成.通过COSY谱对烯烃的顺反构型进行确认.图1给出其化合物3d的COSY谱,可见4号位和5号位的氢为相关峰,3号氢与6号碳原子上的氢为相关氢,确认产物为反式(E)构型,说明该反应立体性专一得到(E)-α-羟乙基-α,β-不饱和醛.
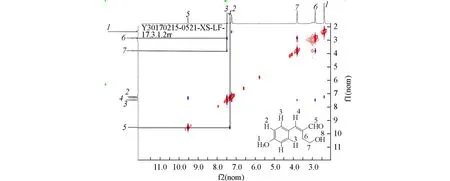
Fig.1 COSY correlation for compound 3d
2.3 反应机理研究
2.3.1 THF的氧化THF在Cu(OAc)2和TBHP的共同作用下生成半缩醛形式的2-羟基四氢呋喃,此反应可能涉及自由基历程,因此加入自由基捕捉剂四甲基哌啶氮氧化物(TEMPO)应该能减少甚至终止反应.按照合成路线1进行实验,在反应体系中加入2倍量的TEMPO,反应过程中始终未检测到目标产物,表明该反应涉及自由基.还有另外一种可能,苄醇氧化为苯甲醛也是自由基反应,因此加入TEMPO同样能够终止反应.
推测THF氧化反应的中间体可能为2-羟基四氢呋喃(HTHF).参考文献[20]方法制备了2-羟基四氢呋喃.按照路线1进行实验,使用2-羟基四氢呋喃代替THF进行反应,产物收率为69%,表明反应的中间体可能是2-羟基四氢呋喃,TBHP的作用是氧化THF生成2-羟基四氢呋喃.
2.3.2 苯甲醇的氧化推测苯甲醇在TBHP和Cu(OAc)2的共同作用下原位氧化生成苯甲醛,然后苯甲醛再参与反应.按照路线2进行实验,以苯甲醛替代苯甲醇进行反应,发现产率提升到68%;如果同时将THF换成HTHF,收率进一步提高到85%.因此,确认苄醇先氧化为苯甲醛再参与反应.
2.3.3 胺的作用表1结果表明,只有使用伯胺才能得到目标产物.推测伯胺先与原位氧化得到的醛生成亚胺中间体,然后发生交叉aldol缩合反应得到产物[21].
2.3.4 铜盐的作用实验结果表明,铜是必须添加的(表2中Entries 1和2).为了确认在苄醇氧化过程中到底是空气中的O2还是TBHP作为氧化剂发挥氧化作用,按照路线1进行实验,以O2代替TBHP,发现无产物生成,也未能检测到苯甲醛,表明促使苄醇氧化的物质是TBHP.
根据以上实验结果,提出了可能的反应机理.如Scheme 6所示,首先THF在Cu(OAc)2和TBHP的共同作用下氧化生成HTHF,随后开环得到4-羟基丁醛A,在酸性条件下与乙醇胺反应得到亚胺B,互变异构生成烯醇式结构C,C作为亲核试剂进攻苯甲醛生成偶联产物D,D在酸性条件下消除乙醇胺后得到E,E脱水生成目标产物3a.上述机理中,席夫碱中间体B的生成极大降低了4-羟基丁醛分子内缩合成HTHF的几率,同时提高了从B到C的反应速率,使得反应得以循环进行.由于该反应机理涉及游离基,加入TEMPO能够终止反应;苯甲醛和HTHF是反应中间产物,因此使用芳香醛和HTHF代替苄醇和THF能够有效减少反应步骤,提高反应收率;上述平衡中乙醇胺有效促进了HTHF→A→B→C的移动;此外,铜盐对于苄醇氧化为苯甲醛和THF转化为HTHF是决定性因素.
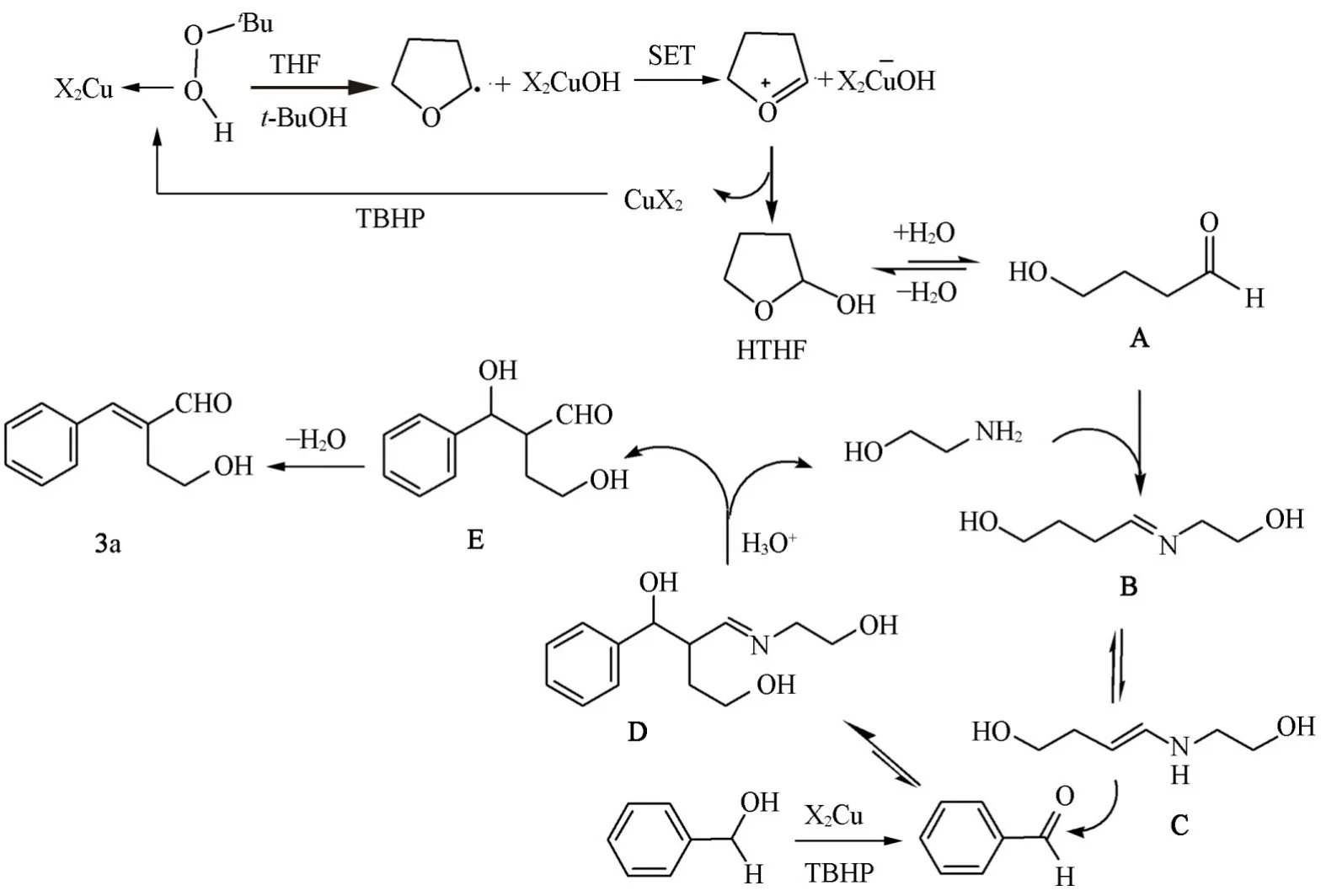
Scheme 6 Proposed reaction mechanism
3 结 论
研究了一种多米诺反应,在TBHP与Cu(OAc)2的共同作用下,苯甲醇原位氧化成苯甲醛;经THF氧化、开环后得到4-羟基丁醛,在酸催化作用下与乙醇胺反应得到亚胺中间体,互变异构为烯胺后作为亲核试剂与苯甲醛发生缩合反应,随后脱除乙醇胺、脱水生成α-羟乙基-α,β-不饱和醛.研究发现,该反应产物为立体专一的E-构型.对该反应的底物进行了拓展,发现芳香杂环甲醇同样适用本方法.本文以THF为砌块,为一锅法合成α-羟乙基-α,β-不饱和醛提供了新思路.
