杨梅素-丙烯醛加合物抗氧化及捕获丙烯醛活性
2020-12-31卢永翎章鼎敏肖留榜吕丽爽
卢永翎,章鼎敏,肖留榜,吕丽爽,*
(1.南京师范大学食品与制药工程学院,江苏 南京 210023;2.南京晓庄学院共青团南京晓庄学院委员会,江苏 南京 211171)
丙烯醛是一种具有高活性的不饱和醛,广泛存在于各种食品中,如香肠[1]、肉排[2]、酒精性饮料[3]、油炸植物油[4]、甜甜圈[5]等,其含量范围为10~11 300 μg/kg[6]。食品中的丙烯醛主要来源于油脂过氧化反应[7]和美拉德反应[8]。内源性脂质过氧化和多胺代谢也会产生丙烯醛[9]。2017年世界卫生组织国际癌症研究机构已将丙烯醛列入三类致癌物[10],长期吸入或通过饮食摄入富含丙烯醛的食物会诱发心血管疾病、糖尿病、肺癌、肾病、阿尔茨海默症[11-15],同时丙烯醛具有较高的细胞毒性,可导致DNA损伤,引起细胞凋亡[16]。因此,抑制食品中丙烯醛的形成,减少其对人体健康的危害具有研究价值。
杨梅素是一种多羟基黄酮醇类化合物,广泛存在于杨梅科、葡萄科、豆科、菊科等植物中,具有很强的抗氧化活性[17],欧美国家已将其应用于食品、医药、保健品及化妆品。本实验室前期研究表明杨梅素具有很高的丙烯醛清除活性,其作用机制为捕获丙烯醛形成加合物,并制备得到了杨梅素与丙烯醛的一加合物(mono-acrolein,MA)和二加合物(di-acrolein,DA-1)(图1)。通过对该加合物进行理化分析,发现其具有非常高的热稳定性和酸碱稳定性,由此引发对其性能的进一步探讨。目前多项研究报道了黄酮类化合物如槲皮素[18]、根皮素[19]、橙皮素[20]等具有捕获丙烯醛并形成相应加合物的能力,但有关黄酮-丙烯醛加合物的稳定性、安全性和功能活性鲜有研究[21],国外多篇综述也提出黄酮加合物的研究存在空区[22]。鉴于MA和DA-1结构中B环依然存在碳负离子(C-2’、C-6’)活性位点及多个酚羟基(C-3’、C-4’、C-5’)活性位点[23],推测加合物可能依然具有丙烯醛清除活性及抗氧化活性。本实验基于杨梅素加合物的结构特点,结合杨梅素应用于食品中的后续变化,拟对杨梅素与丙烯醛的加合物进行功能活性评价。

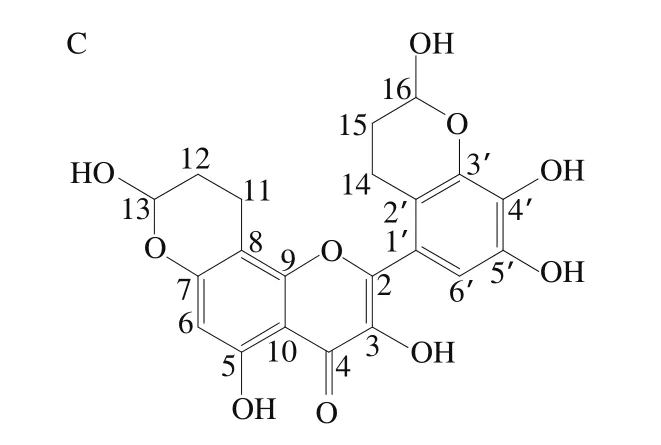
图1 杨梅素(A)、MA(B)和DA-1(C)的结构Fig.1 Structures of myricetin (A) and MA (B) and DA-1 (C)myricetin adducts
本实验对照杨梅素考察了MA和DA-1的总还原能力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、油脂抗氧化能力;研究MA和DA-1捕获丙烯醛的活性,以及在卵白蛋白-葡萄糖模型体系中,菜籽油热处理和蛋糕实际体系中对丙烯醛形成的抑制效率,为研究杨梅素及其加合物在食品加工过程中抑制丙烯醛的作用机制提供理论支撑。
1 材料与方法
1.1 材料与试剂
MA和DA-1(纯度均≥95%)由南京师范大学食品化学实验室自制;未添加抗氧化剂的菜籽油、低筋面粉、复合膨松剂、鸡蛋、砂糖为市售。
杨梅素(纯度为97%) 上海阿拉丁生化科技股份有限公司;丙烯醛(质量分数98%) 山东西亚化学工业有限公司;2,4-二硝基苯肼盐酸盐(纯度>98%)日本东京化成工业株式会社;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、卵白蛋白美国Sigma-Aldrich公司;乙腈(色谱纯) 上海国药集团化学试剂有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
1260 高效液相色谱仪 美国Agilent公司;743 Rancimat油脂氧化仪 瑞士Metrohm公司;UV-6100A紫外-可见分光光度计 上海元析仪器有限公司;ZQTY-70台式振荡培养箱 上海知楚仪器有限公司;CentriVap离心浓缩仪 美国Labconco公司;HH-S恒温油浴锅金坛市医疗仪器厂;BUD 302搅拌机、YXP 101-2商用电烤炉 上海早苗食品有限公司。
1.3 方法
1.3.1 杨梅素与丙烯醛加合物MA、DA-1的抗氧化活性测定
1.3.1.1 总还原能力的测定
参照罗磊等[24]的铁氰化钾法并稍作修改。量取1.0 mL不同浓度(0.01、0.05、0.1、0.5 mmol/L)的MA、DA-1、杨梅素、VC的甲醇溶液,分别加入2.5 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(0.2 mol/L、pH 6.6)和2.5 mL 1.0 g/100 mL的铁氰化钾溶液,漩涡混匀后在50 ℃水浴中反应20 min,加入2.5 mL 10.0 g/100 mL的三氯乙酸溶液,混匀,10 000 r/min离心10 min。取5.0 mL上清液,加入5.0 mL蒸馏水和1.0 mL 0.1 g/100 mL的FeCl3溶液,混匀后静置10 min,于700 nm波长处测定吸光度。以甲醇溶液作为空白,VC作为阳性对照。
1.3.1.2 DPPH自由基清除率的测定
参照Goupy等[25]的方法并稍作修改。量取3.0 mL的DPPH溶液(0.2 mmol/L,溶于乙醇中),分别加入不同浓度(0.01、0.05、0.1、0.5 mmol/L)的MA、DA-1、杨梅素、VC的乙醇溶液1.0 mL,漩涡混匀,室温避光静置30 min,以无水乙醇调零,于517 nm波长处测定吸光度A1;同时测定1.0 mL不同浓度的样品溶液与3.0 mL无水乙醇的混合液在517 nm波长处吸光度A2;测定1.0 mL空白样品与3.0 mL DPPH的混合液在517 nm波长处的吸光度A0。以VC作为阳性对照,按公式(1)计算DPPH自由基清除率。
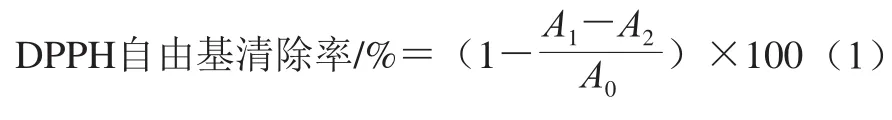
1.3.1.3 油脂抗氧化能力的测定
参照Wang Jun等[26]的方法,分别称取5.0 g未添加抗氧化剂的菜籽油于Rancimat油脂氧化稳定性测定仪的反应池中,再分别添加MA、DA-1、杨梅素使其最终浓度均为1.0 mmol/L,以未添加样品的菜籽油组作为空白对照,超声10 min使其完全溶解。分别量取50.0 mL超纯水于对应的测量池中,设置空气流速为20 L/h,温度为180 ℃,测定菜籽油的诱导时间/min。
1.3.2 杨梅素与丙烯醛加合物MA、DA-1抑制丙烯醛的活性测定
1.3.2.1 杨梅素与丙烯醛加合物捕获丙烯醛能力的测定
量取浓度为0.5 mmol/L的丙烯醛溶液0.5 mL(由0.1 mol/L、pH 7.0的PBS配制),分别加入0.5 mL不同浓度的MA、DA-1、杨梅素溶液(0.05、0.10、0.25、0.50 mmol/L),漩涡混匀,100 ℃反应30 min,参考本实验室方法[18],取0.5 mL反应液,以2,4-二硝基苯肼为衍生化试剂,高效液相色谱法测定丙烯醛的含量Aj,用PBS代替杨梅素及其加合物作为对照测定丙烯醛含量Ai,按公式(2)计算对丙烯醛的抑制率。
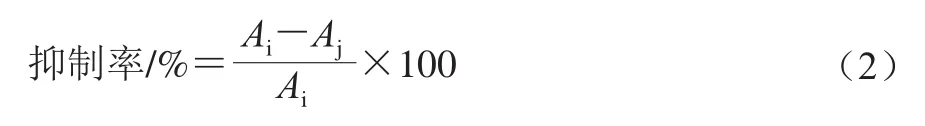
1.3.2.2 杨梅素与丙烯醛加合物对卵白蛋白-葡萄糖模型中丙烯醛形成的影响
用0.05 mmol/L、pH 8.0的PBS配制卵白蛋白、葡萄糖溶液,在耐高温玻璃瓶中依次加入2.5 mL卵白蛋白溶液(质量浓度8.0 mg/mL)、1.25 mL葡萄糖溶液(质量浓度80.0 mg/mL)和1.25 mL PBS溶液,漩涡混匀后于110 ℃油浴中分别反应0、5、10、15、20、30、45、60 min,取0.5 mL反应液参考文献[18]测定丙烯醛含量,研究该体系中丙烯醛的形成过程。
在耐高温玻璃瓶中,依次加入2.5 mL卵白蛋白溶液(质量浓度8.0 mg/mL)、1.25 mL葡萄糖溶液(质量浓度80.0 mg/mL)和1.25 mL不同浓度(0.05、0.1、0.5、1.0 mmol/L)的MA、DA-1、杨梅素溶液,漩涡混匀后于110 ℃油浴中反应30 min,取0.5 mL反应液按上述方法测定丙烯醛含量,以PBS代替杨梅素及其加合物作为对照,按公式(2)计算对丙烯醛的抑制率。
1.3.3 杨梅素与丙烯醛加合物MA、DA-1对油脂中丙烯醛形成的影响
分别称取5.0 g未添加抗氧化剂的菜籽油于Rancimat油脂氧化稳定性测定仪的反应池中,量取50.0 mL超纯水于对应的测量池中,设置空气流速为20 L/h,温度为180 ℃,分别反应0、15、30、60、120、240 min,取0.5 mL测量池中样液参考文献[18]测定丙烯醛含量,研究菜籽油加热过程中丙烯醛的形成过程。
分别称取5.0 g未添加抗氧化剂的菜籽油于反应池中,再分别添加MA、DA-1、杨梅素溶液使其最终浓度分别为0.25、0.5、1.0 mmol/L,超声10 min使其完全溶解。分别量取50.0 mL超纯水于对应的测量池中,设置空气流速为20 L/h,温度为180 ℃,反应60 min后取0.5 mL测量池中样液,按上述方法测定丙烯醛含量,以PBS代替杨梅素及其加合物作为对照,按公式(2)计算对丙烯醛的抑制率。
1.3.4 杨梅素与丙烯醛加合物MA、DA-1对蛋糕中丙烯醛形成的影响
1.3.4.1 蛋糕的制作工艺流程
参考张伟君等[27]重油蛋糕的制作方法,称取黄油、细砂糖、全蛋液和低筋面粉各100 g、盐1 g、复合膨松剂2 g,在蛋液中分别加入含量为0.2、0.4、1.2 μmol/g(相对于配方总质量)的MA、DA-1和杨梅素。黄油切小块后室温软化,加入细砂糖打发至膨发状态,蛋液分3 次加入,每次需迅速搅拌至完全融合,最后加入混合粉翻拌均匀形成面糊。将面糊转入裱花袋中,挤入模具内(七分满),170 ℃烘烤30 min。
1.3.4.2 蛋糕中丙烯醛抑制率的测定
称取0.5 g粉碎的蛋糕样品,加入5.0 mL蒸馏水,漩涡混合3 min,8 000 r/min离心10 min,取上清液。加入5.0 mL体积分数50%的甲醇溶液,漩涡混合后超声萃取20 min,8 000 r/min离心10 min,取上清液,将两次获得的上清液合并混匀,8 000 r/min离心15 min,取3.0 mL上清液参考文献[18]测定丙烯醛含量,以PBS代替杨梅素及其加合物作为对照,按公式(2)计算对丙烯醛的抑制率。
1.4 数据处理与分析
所有实验均重复3 次,采用Excel 2010、SPSS17.0软件分析实验数据,结果以平均值±标准差表示。采用单因素方差分析模式分析,显著性差异采用Duncan检验,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 杨梅素与丙烯醛加合物MA、DA-1的抗氧化活性
2.1.1 总还原能力

图2 MA、DA-1和杨梅素的总还原能力Fig.2 Concentration dependent reducing power of MA and DA-1 myricetin adducts and myricetin
由图2可知,杨梅素与丙烯醛的加合物依然具有较强的还原能力,在浓度为0.01~0.1 mmol/L时,MA和DA-1的还原能力与VC之间没有显著性差异(P>0.05),略低于杨梅素。当浓度增加至0.5 mmol/L时,杨梅素的还原能力显著增强(P<0.05),MA、DA-1的还原能力略低于VC。由此可知,杨梅素与丙烯醛加合物依然具有一定的还原能力。
2.1.2 DPPH自由基清除率
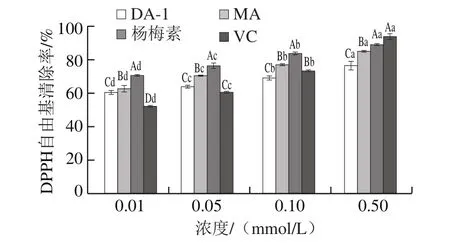
图3 MA、DA-1和杨梅素的DPPH自由基清除率Fig.3 Scavenging effects of MA and DA-1 myricetin adducts and myricetin on DPPH free radicals
由图3可知,随着浓度的增加,杨梅素与丙烯醛加合物对DPPH自由基的清除率逐渐升高。MA(0.01~0.1 mmol/L)和DA-1(0.01~0.05 mmol/L)对DPPH自由基的清除率均强于VC,清除率均可达到60%以上,表明杨梅素捕获丙烯醛后依然具有较强的DPPH自由基清除活性,MA和DA-1结构上保留的羟基可以提供质子,还原具有氧化性的自由基。在0.01~0.5 mmol/L浓度范围内,杨梅素及其加合物对DPPH自由基的清除率存在显著性差异(P<0.05),但MA和DA-1依然显示出较强的DPPH自由基清除能力。
2.1.3 油脂抗氧化能力
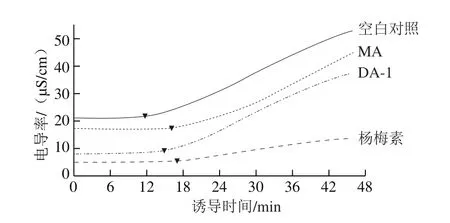
图4 MA、DA-1和杨梅素对菜籽油氧化诱导时间的影响Fig.4 Effect of MA and DA-1 myricetin adducts and myricetin on the oxidation induction time of rapeseed oil

表1 菜籽油添加杨梅素和丙烯醛加合物氧化诱导时间的变化Table 1 Changes in oxidation induction time of rapeseed oil added with different antioxidants
本实验采用Rancimat法,加速油样氧化,将氧化产生的醛、酮、酸等物质导入蒸馏水中,测定蒸馏水的电导率突变点为诱导时间。诱导时间越长,证明油样的抗氧化稳定性越强。从图4和表1中可以看出,空白对照组的菜籽油氧化诱导时间为11.41 min,MA和DA-1在高温下可将菜籽油的氧化诱导时间延长至约1.3~1.4 倍,与杨梅素将氧化诱导时间延长至约1.5 倍的效果相近,均可一定程度上提高菜籽油的氧化稳定性,减缓菜籽油的氧化酸败。推测可能是由于这3 种化合物中的酚羟基均可提供氢质子与自由基结合,破坏了脂肪酸氧化的链式反应,同时通过螯合油样中的金属离子也有助于发挥抗氧化作用[28]。
2.2 杨梅素与丙烯醛加合物MA、DA-1对丙烯醛活性的影响
2.2.1 杨梅素加合物捕获丙烯醛的能力
如图5所示,当浓度在0.05~0.25 mmol/L时,DA-1、MA和杨梅素3 种化合物对丙烯醛的抑制率存在显著性差异(P<0.05),MA对丙烯醛的抑制率是DA-1的2 倍左右。当浓度增大至0.5 mmol/L时,DA-1对丙烯醛的抑制率大幅度增强,达60.7%,MA与杨梅素较为接近,高达80.5%。MA和DA-1对丙烯醛的高清除活性说明两种加合物仍有继续捕获丙烯醛的能力。
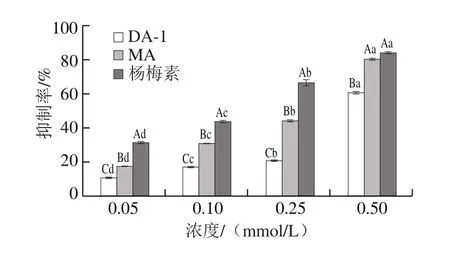
图5 MA、DA-1和杨梅素对丙烯醛的抑制率Fig.5 ACR inhibitory rates of MA and DA-1 myricetin adducts and myricetin
2.2.2 杨梅素加合物对卵白蛋白-葡萄糖体系中丙烯醛形成的影响
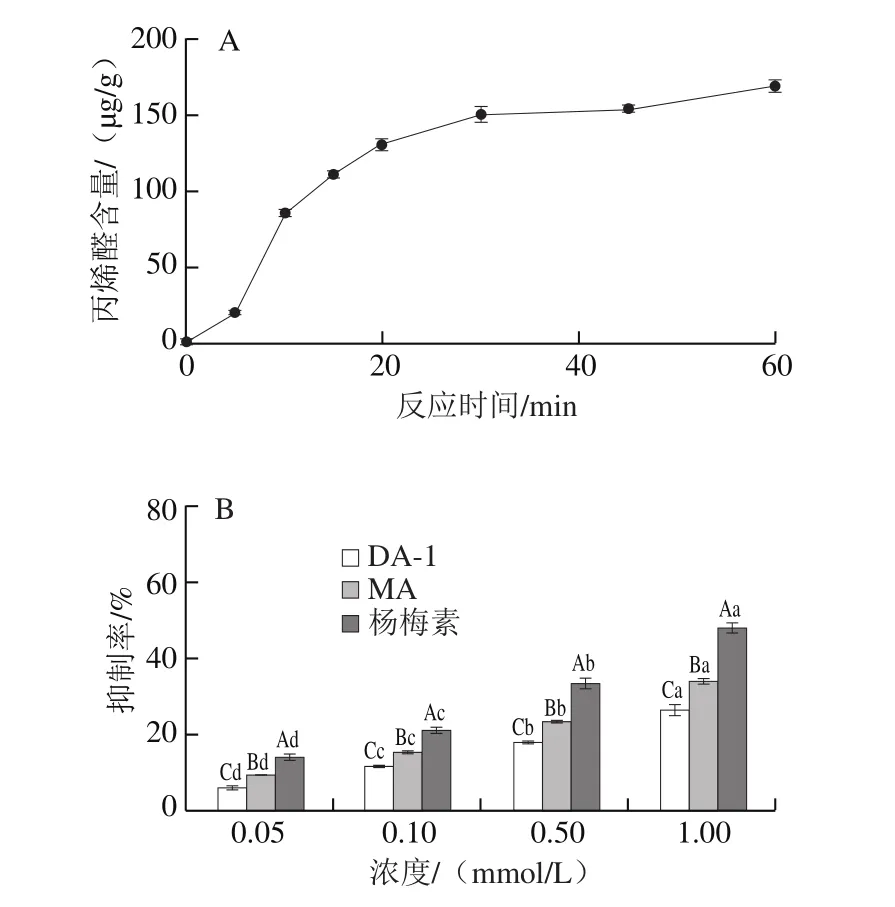
图6 反应时间对卵白蛋白-葡萄糖体系中丙烯醛含量的影响(A)及MA、DA-1和杨梅素对体系中丙烯醛的抑制率(B)Fig.6 Effect of reaction time on the production of ACR in ovalbuminglucose system (A) and ACR inhibitory rates of MA and DA-1 myricetin adducts and myricetin (B)
鸡蛋含有丰富的营养物质,氨基酸比例适合人体生理需要,易吸收,是重要的食品原料之一。本实验通过构建卵白蛋白-葡萄糖模型,考察体系中丙烯醛形成过程的浓度变化。从图6A中可以看出,随着反应时间的延长,体系中丙烯醛的含量逐渐增加,在反应初期(5~10 min)反应速率最大,体系中丙烯醛含量迅速上升,在30 min时产生大量丙烯醛(149.9 μg/g),随后体系中丙烯醛的含量维持在一定范围内,因此选择30 min(平台期)作为后续实验的反应时间。由图6B可知,杨梅素及丙烯醛加合物可降低该体系中丙烯醛的含量,且随着浓度的增加,抑制率显著提高(P<0.05)。当浓度为1.0 mmol/L时,DA-1和MA的抑制率分别为26%和34%,杨梅素的抑制活性较高,可以清除48%的丙烯醛,接近半抑制率。
2.3 杨梅素与丙烯醛加合物MA、DA-1对菜籽油中丙烯醛形成的影响
大量研究显示,油脂在热加工过程中发生氧化反应是食源性丙烯醛的主要来源之一[29]。菜籽油相较于其他种类的油脂其亚麻酸含量较高,使得在热加工过程中产生较多的丙烯醛[30]。本实验选择菜籽油为考察对象,由图7A可知,0~60 min内,由于体系中亚麻酸含量高,丙烯醛生成量迅速增加,随着反应的进行亚麻酸被破坏分解,在60~120 min内丙烯醛含量增长缓慢至最大值(87.4 μg/g)。继续加热(120~240 min),体系中丙烯醛的含量呈下降趋势,其原因可能为:1)丙烯醛热稳定性较差,在高温下会分解成丙二醛等化合物[30];2)在较高的温度下,随着反应时间的延长菜籽油中的三酰甘油会形成三酰甘油聚合物,而不是氧化产生丙烯醛[31]。鉴于加热60 min时丙烯醛含量接近最大值,后续实验选择60 min作为反应时间。由图7B可知,DA-1、MA和杨梅素对菜籽油热加工过程中产生的丙烯醛均有一定的抑制效果,且随着浓度的增加呈明显上升趋势。当浓度为0.25 mmol/L时,DA-1和MA对体系中产生的丙烯醛抑制效果较弱,抑制率不到20%;当浓度升高至1.0 mmol/L时,DA-1可清除体系中34%以上的丙烯醛,MA抑制率为43.4%。以上结果表明,杨梅素与丙烯醛的加合物在油脂加热过程中仍可发挥清除丙烯醛的功效,推测其作用机制可能是化合物捕获丙烯醛与抗氧化活性的共同作用。
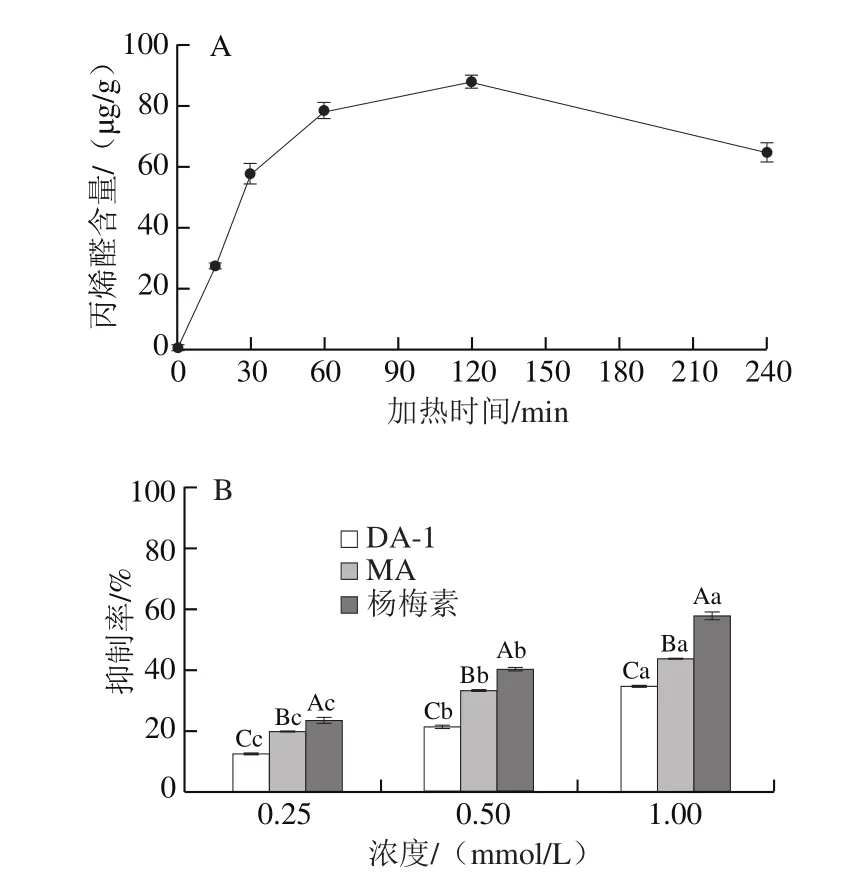
图7 加热时间对菜籽油中丙烯醛含量的影响(A)及MA、DA-1和杨梅素对体系中丙烯醛的抑制活性(B)Fig.7 Effect of heating time on the production of ACR in rapeseed oil (A) and ACR inhibitory rate of MA and DA-1 myricetin adducts and myricetin (B)
2.4 杨梅素与丙烯醛加合物MA、DA-1对蛋糕加工中丙烯醛的抑制率
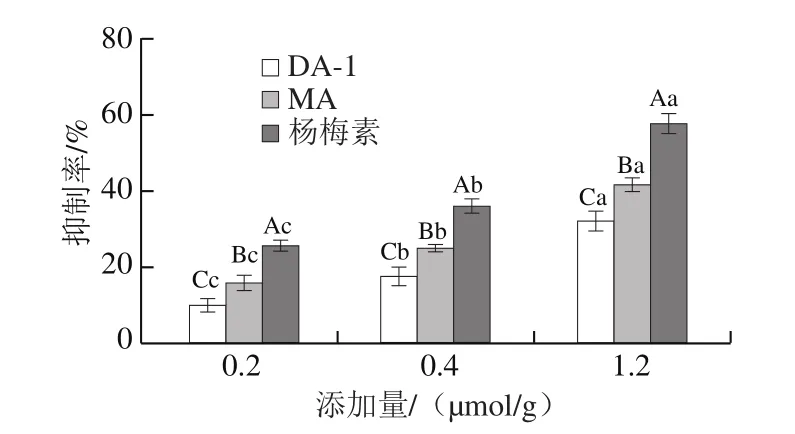
图8 MA、DA-1和杨梅素对重油蛋糕中丙烯醛的抑制活性Fig.8 ACR inhibitory rate of MA and DA-1 myricetin adducts and myricetin in pound cakes
重油蛋糕中添加的黄油脂肪含量较高,脂质在烘焙过程中发生氧化反应从而生成丙烯醛,此外,原料中含有较高含量的蛋白质和碳水化合物,其所发生的美拉德反应和碳水化合物裂解也是蛋糕中丙烯醛的主要来源。由图8可知,杨梅素与丙烯醛加合物对蛋糕烘焙过程中产生的丙烯醛有一定的抑制活性,当添加量从0.2 μmol/g增加至1.2 μmol/g时,DA-1对体系中丙烯醛的抑制率从10.1%显著提高至31.9%,MA从15.8%显著提高至41.4%(P<0.05)。相同添加量时,抑制率从小到大依次为DA-1<MA<杨梅素。推测在蛋糕烘焙过程中一方面MA和DA-1仍具有捕获丙烯醛的活性位点,对于已产生的丙烯醛可将其捕获;另一方面,加合物发挥后续抗氧化作用,减缓了脂质的氧化速率[32],抑制了丙烯醛的产生,从而有效降低蛋糕中丙烯醛的含量。
3 结 论
杨梅素与丙烯醛加合物依然具有抗氧化清除自由基的活性,且抗氧化能力随着浓度的增大而增强,在浓度0.01~0.1 mmol/L范围内,MA和DA-1的总还原能力及对DPPH自由基的清除率接近甚至高于VC,并且可以将菜籽油的氧化诱导时间延长至1.3~1.4 倍,与杨梅素效果相近,能够减缓氧化酸败速率,具有较高的体外抗氧化活性。MA和DA-1结构中的活性位点使得其可通过直接捕获降低体系中丙烯醛的含量,抑制活性较高,最高抑制率分别为80.5%和60.7%,并可有效抑制卵白蛋白-葡萄糖模型中丙烯醛的产生。在进一步建立的菜籽油热处理体系中,浓度为1.0 mmol/L的MA、DA-1和杨梅素可分别抑制43.4%、34.5%和57.6%的丙烯醛;在蛋糕体系中,添加量为1.2 μmol/g的MA和DA-1可分别抑制41.4%和31.9%的丙烯醛,而杨梅素抑制率为57.6%,推测一方面加合物可以直接捕获体系中已产生的丙烯醛;另一方面加合物的抗氧化活性可以减缓体系中脂质在高温下的氧化速率,从而减少丙烯醛的产生。可见杨梅素在捕获有害物质丙烯醛后,形成的加合物依然具有较强的后续抗氧化性和抑制丙烯醛的能力,体现了杨梅素反应的持续活性和长效性,从而有利于保证食品在加工和贮藏过程中的安全性。
鉴于以上杨梅素及其加合物的优良功能活性,下一步将对其毒理性和安全性做深入系统的研究。
