一种新型Pd2+荧光探针:合成,表征及计算
2021-12-16何盈春李佳锐刘矩苇
苏 柯,何盈春,刘 利,李佳锐,刘矩苇,杨 颖,雍 芮
(1.四川文理学院 化学化工学院,四川 达州 635000;2.阿坝师范学院 资源与环境学院,四川 阿坝 623002;3.四川职业技术学院 能源化工学院,四川 遂宁 629099)
0 引 言
自21世纪以来,工业技术发展迅速,人民的生活水平得到了很大的提高,但同时,人类与环境都付出了十分惨痛的代价.[1]由于工业“三废”不节制排放,许多重金属及其化合物被排放到大自然中,严重地污染了自然环境.[2]其中,重金属污染[3]问题往往首当其冲,在土壤之中富集的重金属,可能会使土壤的质地发生不可能逆转的破坏,使得农作物污染且导致产量下降,给农业带来巨大的负面影响;其次重金属污染环境并聚集到植物体中,然后通过食物链逐级富集,最终进入人体.重金属在体内不仅会破坏金属离子浓度的平衡,当超过最大存在浓度就会造成重金属中毒,比如钯中毒、汞中毒等,而且,还不会被代谢排出体外.
当前重金属离子浓度检测的方法有很多种,[4]包括有电化学法、原子吸收光谱和分光光度分析法等.但是大多数方法都存在着一些弊端,[5]比如说:实验条件十分苛刻、仪器设备特别昂贵和样品的预处理程序非常复杂等.所以,如今找到一种简洁且方便、快速并抗干扰能力强的检测重金属离子的浓度方法尤为重要.[6]
研究发现,作为可以简便且快速地检测重金属离子的浓度的方法——荧光探针化学传感器,相较于经典方法,该方法检测速度更快、操作比较简单、成本也更加低廉.[7]目前,该方法已经在生物医药、化学化工、材料科学、水质环境等多个领域得到初步应用,已成为一种重要的分析检测手段.[8]但是目前,部分已研究的荧光探针[9]还存在一些不足,比如合成步骤繁琐难度大、灵敏度弱、检测溶剂往往依赖于有机溶剂,因此设计合成新型小分子探针,并使得它们有更加优异的综合性能,具有重要意义.
纵览文献,[10]噻二唑类化合物具有较大的共轭体系与电子推拉结构,并且其结构式中的氮和硫原子结构上都具有孤对电子,可以形成多齿的配位点,理论上可以特异性的与某些金属离子进行螯合作用.本文以糠酸为原料,一步缩合,得到一种呋喃与噻二唑互联的双环荧光化合物2.通过多种表征技术对其进行了结构表征和荧光性能研究.结合实验数据和guassian09计算结果,对其荧光探针机理进行了初步的讨论.
1 实验
1.1 实验试剂及仪器
硅胶板(三色分开):青岛海洋化工厂分厂;糠酸:绵阳达高特试剂公司;盐酸氨基硫脲:成都西亚试剂公司;三氯氧磷,氢氧化钠甲醇和乙醇:成都科隆化工;反渗透水(RO):自制.所有试剂均为分析纯(AR).
x-4数显显微熔点测定仪:巩义市予华仪器有限责任公司(温度计未再校正);集热式恒温加热磁力搅拌器(DF-101S):上海临科实业科技有限公司;真空干燥箱(DZF-6050AB) :北京中兴伟业仪器有限公司;电子天平(HZK-FA210):福州华志科学仪器有限公司;旋转蒸发仪(RE52CS-1):上海亚荣生化仪器厂;三用紫外分析仪(ZF-1):杭州齐威仪器有限公司;循环水真空泵(SHB-B95A):北京中兴伟业仪器有限公司;荧光光谱仪(LS55):美国珀金埃尔默仪器公司;紫外可见分光光度计(UV-1800PC):上海美谱达仪器有限公司;傅里叶变换红外光谱仪(Spectrum 100):美国Perkin Elmer仪器公司;液相色谱-质谱联用仪(1200L):美国Varian公司;超导核磁共振波谱仪(Bruker Avance III 600):瑞士Bruker公司.
1.2 互联双环类化合物的合成
一般来说,羧酸可以在强酸如硫酸、盐酸、三氯氧磷或氯化磷等的作用下进行缩合反应构建噻二唑环.所以,本文以糠酸为原料,氨基硫脲为缩合试剂,在三氯氧磷的作用下,一锅生成5-氨基-2-呋喃基-1,3,4-噻二唑.请注意,本实验具一定的危险性,应该采取科学的实验保护措施,此外三氯氧磷的量必须过量,以确保硫脲完全溶解于反应体系中,才能获得较高的化合物2的产率,反应结束后,除去过量的三氯氧磷,否则淬灭时危险性较高.目标产物通过紫外-可见光(UV-Vis)、傅里叶-红外(FT-IR)、液相质谱(LC-MS)、核磁(1H-NMR)进行了结构表征.
在装有磁子、温度计和冷凝管的反应瓶(100 mL)中,加入2.240 g糠酸(化合物1,20 mmol),氨基硫脲(1.820 g,20 mmol),再缓慢加入30 mL三氯氧磷.在搅拌时,将反应物缓慢加热到75 ℃,直至固体完全溶解,使其保持反应5 h.冷却至室温后,减压蒸馏除去过量的三氯氧磷.在所得剩余物中缓慢滴加60 mL RO水,加热回流,并且搅拌5 h,由薄层色谱(TLC)确定反应终点,冷却,冰水浴中用10 mol/L氢氧化钠溶液中和反应至pH =8,析出黄褐色的固体.过滤析出固体,水洗,干燥,甲醇重结晶,得到2.492g的亮黑色晶体,收率为74.6%, m.p.>300℃.
1.3 光学性能和反应机理研究
通过荧光发射光谱仪和紫外可见光分光光度计测定化合物2的荧光和紫外性能,研究不同金属离子对其荧光和紫外性能的影响及其规律. 将化合物2 和多种金属离子配制为ppm级别的溶液,分别取相等摩尔的化合物2和对应的金属离子溶液充分混合,测试荧光发射光谱、紫外吸收光谱并用肉眼观察溶液颜色变化,探索金属离子与化合物2的反应特性.对能与化合物2特征性作用的金属Pd2+离子,利用紫外与荧光滴定,jobs方程确定荧光物质与金属离子的配比,通过Stern-Völmer 方程计算化合物2对Pd2+离子检测限.此外,结合化合物2的金属Pd2+离子的配比,通过guassian09,使用密度泛函理论,对它们的理论机构进行模拟计算,并初步分析化合物2与金属离子的作用机理.
2 结果与讨论
2.1 化合物的表征数据
化合物2的UV-Vis图谱是将化合物2溶于水中,在紫外可见光分光光度计中测试得到的(图2(a)),化合物2的FT-IR图谱是将化合物2与无水KBr充分研磨混合压片,在红外光谱仪测试而得(图2(b)).在UV-Vis图谱中,我们可以看到,化合物2在200-350 nm间的波长范围内出现吸收峰,λmax为305 nm,此外245 nm 处还伴随有肩峰.由FT-IR图可以看出,在化合物2 中,氨基中N-H伸缩振动峰在 3298.1 cm-1处左右;芳烃的C-H伸缩振动峰在3085.2 cm-1左右,氨基中N-H的伸缩振动峰2952.1cm-1左右;C=C和C=N的伸缩振动峰在1620.1 cm-1处左右,N-H弯曲振动峰1496.3 cm-1处,N-H伸缩振动峰在1149.2 cm-1处左右.

(a)

(b)
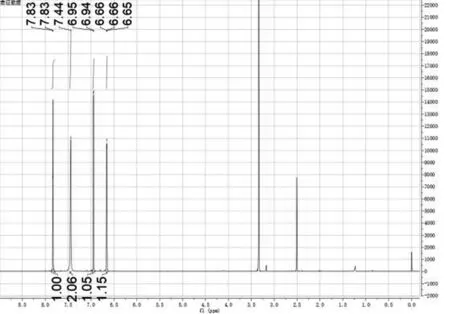
化合物2的MS图3(a)是将化合物2溶于甲醇后进样,采用ESI正离子模式,在液质联用质谱仪中测试而得,化合物2的NMR图谱是将化合物2溶于氘代DMSO中,在扫描分辨率为600 MHz条件下,在超导核磁共振波谱仪测试而得.通过chemdraw计算可知化合物2的分子量是167.0,图3(a)中168.0处的离子碎片峰为该化合物的[M+H]+分子离子峰.化合物2的1H-NMR谱图(图3(b)),分析可知7.83 ppm (d,1H),6.94 ppm(d,1H)和6.66 ppm处的三种氢质子的化学位移为呋喃环的三种氢的核磁信号,然后,噻二唑环不具有氢质子,故噻二唑环上没有化学位移峰,而噻二唑环上的伯氨基具有7.44 ppm处的氢信号 (s,2H).总体而言,核磁信号中出峰的化学位移,裂分情况与化合物2化学结构中四组氢相匹配,也与其氢的位置结构相符合.

(a)
(b)
2.2 光学性能结果与讨论
2.2.1紫外光谱性质
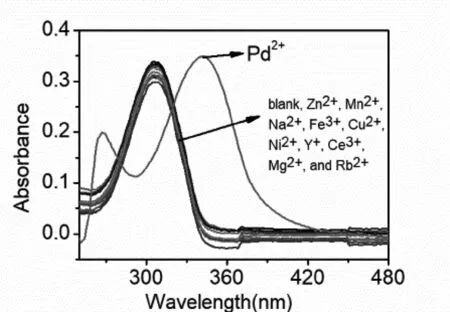
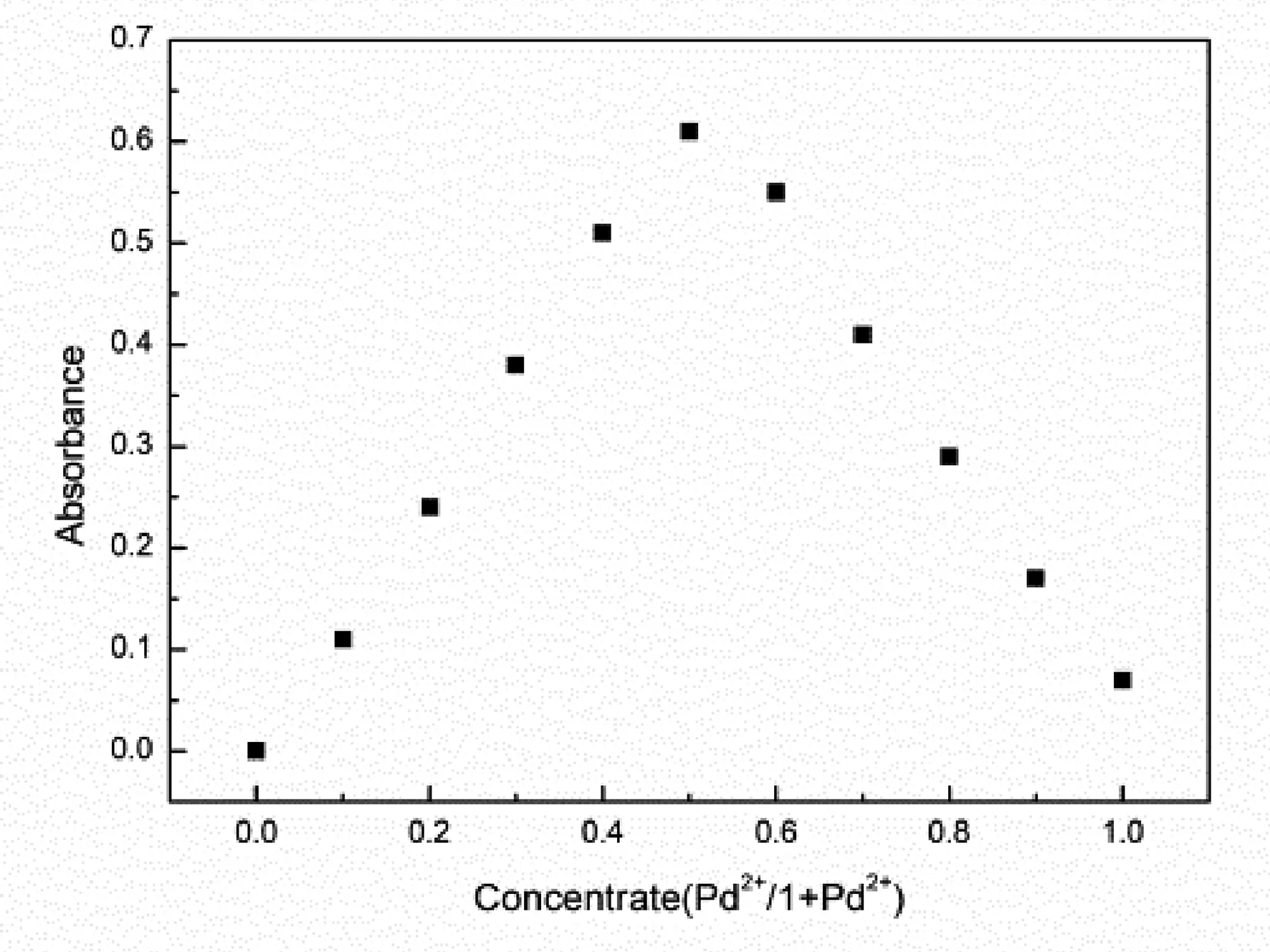
图4(a)为化合物2的水溶液在有无不同金属离子作用下的紫外-可见光谱图. 如图所示,化合物2的最大吸收波长为305 nm,其最大吸收波长不受Zn2+、Mn2+、Mg2+、Pd2+、Ca2+、Ni2+、Ce3+、Rb+、Y3+、La3+和Cu2+等金属离子的影响.但是当引入金属Pd2+波长还从305nm 红移到了350nm 左右,发生了红移,这可能是由于化合物2可以时,我们可以看到化合物2发生了明显的的红移,并且在最大吸收波长下吸光度(A)有了明显的增加,这可能是由于化合物2与Pd2+形成配位化合物,降低了它的共轭程度,导致其发生红移. 将化合物2和金属Pd2+的浓度之和固定为10-2M,改变组成比例,得到job’s图3(b),由图可知,化合物2和Pd2+的化学计量比为1:1.
(a)
(b)
2.2.2荧光光谱光谱
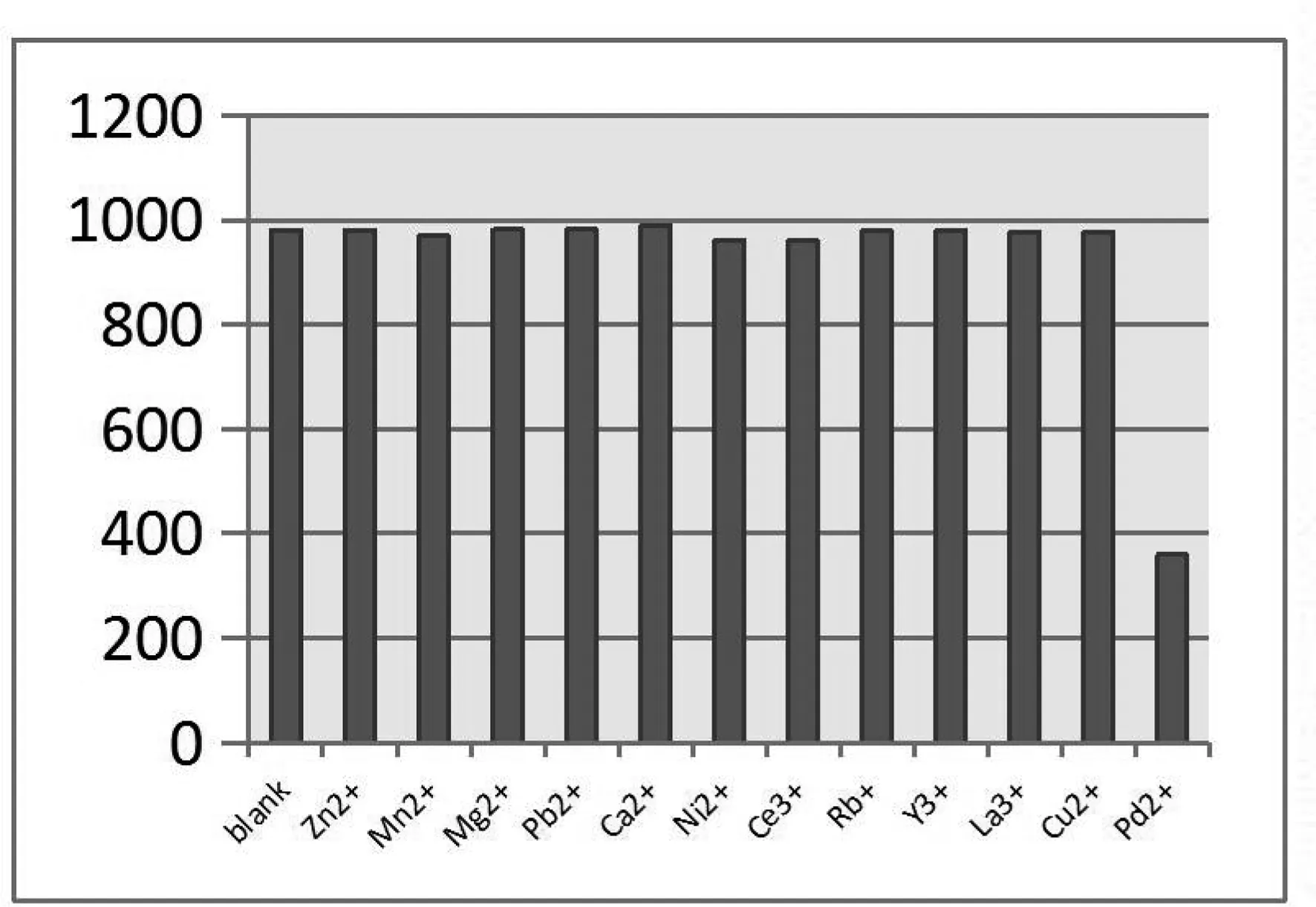
图5(a)为化合物2的水溶液在有无不同金属离子作用下的荧光发射强度图, 数据表明,化合物2具有很强的荧光,当一当量的Zn2+、Mn2+、Mg2+、Pd2+、Ca2+、Ni2+、Ce3+、Rb+、Y3+、La3+或Cu2+金属离子溶液与化合物2充分混合后,化合物2荧光发射光谱强度几乎没有改变.然而,一当量的Pd2+却可以将化合物2的荧光强度淬灭一半以上.这可能是因为化合物2和Pd2+的配位形成了非荧光络合物.这一特性表明,化合物2可作为选择性检测Pd2+的化学传感器.为了进一步探究化合物2与金属Pd2+的作用情况,在PBS(pH = 7.4)中对化合物2进行荧光滴定实验.由图4(b)可知,化合物2在最大发射波长425 nm处的发光强度随着金属钯浓度的增加而逐步降低.当分子摩尔比达到1:1时,化合物2的荧光强度降到原来的1/3以下.再增加Pd2+的量,荧光强度几乎没有改变,荧光滴定实验发现,化合物2对Pd2+具有选择性,也再一次证明化合物2与Pd2+之间形成的配位比为1:1.
(a)
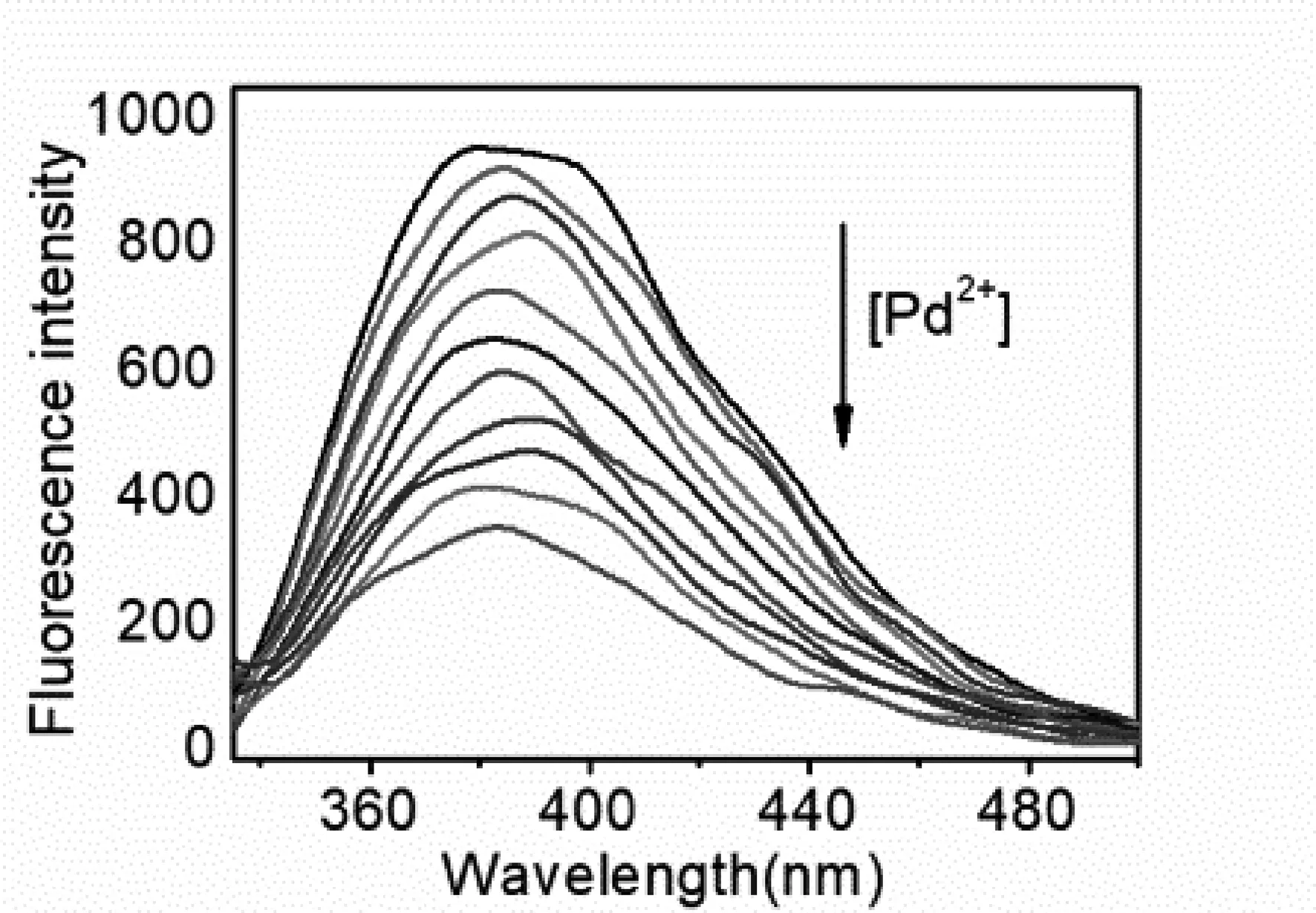
(b)
2.2.3应用潜力探讨
通过荧光滴定数据探究了化合物2的灵敏度(图6(a).由图可见,加入Pd2+浓度在0.01 μM-0.1 μM之间时,化合物2的荧光发射强度与加入的Pd2+浓度呈负相关关系.通过Stern-Völmer方程计算可知,化合物2对Pd2+离子的检出限低至4.35×10-7mol/L.此外,荧光化合物中荧光团的荧光性能往往受到溶液pH作用,从而干扰金属离子的检测.因此,研究了水溶液中pH浓度对化合物2的Pd2+识别作用效果.在6.0-9.0的pH范围,化合物2的荧光发射强度几乎不变.有趣的是,如图所示,在加入1eq Pd2+后,在所有pH范围内化合物2的荧光淬灭严重,表明化合物2可以用于6.0-9.0的pH范围内检测Pd2+.本文在PBS(磷酸盐缓冲盐水)的pH=7.4处进行了进一步的荧光实验,以期日后开发其生物系统中的潜在应用.

(a)

(b)
2.3 荧光淬灭机理讨论
通过上述实验我们发现化合物2和金属Pd2+离子的配位比为1:1,为了研究其作用机制,本文利用Guassian09 软件,采用用密度泛函理论(DFT),优化了化合物2配位前后的结构(C,H,O,N和S元素选用b3lyp/6-311+g基组,Pd元素选择lanl2dz基组)的.注:感谢李良春博士对计算机仿真实验的支持.有趣的是,Pd2+和化合物2中的呋喃环上的O噻二唑环上的N之间形成了配位键,形成稳定结构.由图7可见,Pd2+的引入,破坏了化合物2的共平面性,降低了它的的共轭度,使其荧光淬灭.

图7 化合物2配位前后的优势构象示意图
为了进一步了解络合后的光学变化原因,进一步计算了化合物2在配位前后优势构象的前沿轨道形状和能量(图8).在化合物2中,HOMO和LUMO电荷分布均匀,但在络合物中的电荷主要位于金属Pd2+附近上.由此推断Pd2+的配位阻碍了化合物2的分子内电荷(ICT)转移,导致荧光猝灭.此外,络合物的HOMO和LUMO之间的能级差比化合物2的要小一些,这与之前的紫外与荧光滴定过程中的红移一致.
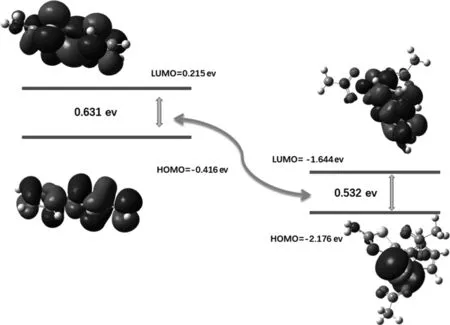
图8 化合物2配位前后的分子轨道示意图
3 总结与展望
综上所述,本文以糠酸为原料,合成了一种新型的呋喃并噻二唑的双环荧光化合物2,该化合物具有良好的荧光性能和对Pd2+的高选择性识别.pH对Pd2+识别的影响表明,化合物2可以用于在6.0-10.0的很宽的pH范围内检测Pd2+.PBS中Pd2+化合物2(磷酸缓冲盐pH=7.4)荧光滴定表明,Pd2+检测极限为4.35×10-7M(0.114ng/L).化合物2可以实现简单、快速、方便的现场检测,而无需复杂、昂贵的设备.荧光滴定和紫外jobs图表明, Pd2+与化合物2的配位摩尔比为1:1,以及化合物2中的3′N和呋喃环上O原子是可能的配位位点.密度函数理论表明,Pd2+的配位使化合物2的共平面度和共轭性降低,导致荧光淬灭.此外,络合后,LUMO和HOMO之间能隙更小,这与Pd2+对化合物2的紫外-可见滴定中的红移结果吻合. 化合物2具有高灵敏度、短响应时间、好选择性、高准确度等优点,可用于检测Pd2+.此外化合物2作为一个呋喃并噻二唑的有机小分子荧光探针,合成容易不同于传统荧光探针分子,具有后续开发潜力.
