食源性DPP-IV抑制肽降血糖作用机制研究进展
2021-12-16赵嘉妮刘光明林家仕曹敏杰
赵嘉妮,陈 宏,翁 凌,刘光明,林家仕,曹敏杰,
(1.集美大学体育学院,福建厦门 361021;2.集美大学食品与生物工程学院,福建厦门 361021)
糖尿病(Diabetes mellitus,DM)是一种以慢性血糖水平增高为特征的代谢性疾病,主要由胰岛素分泌和(或)作用缺陷所引起。近年来,随着全球糖尿病患者数目不断攀升,糖尿病及其并发症已成为重要的公共健康问题,根据国际糖尿病联盟(The International Diabetes Federation, IDF)报告,2019年全球约有4.63亿人患糖尿病,预计到2030年,全球糖尿病患者将达到 5.78 亿,到 2045 年,将达到约 7 亿[1−2]。II-型糖尿病(Type two diabetes mellitus,T2DM)是糖尿病的主要类型,占糖尿病发病率的90%~95%[3],主要表现为胰岛素抵抗和(或)胰岛β细胞受损。高体重指数(Body mass index, BMI)值、久坐不动的生活方式、高热量饮食、衰老和遗传是增加其发病率的主要因素[4−5]。糖尿病不仅损害全身多个器官,而且会引起多种并发症,包括肥胖、高血压、高胆固醇、心血管疾病和肾功能衰竭等,严重影响身体健康以及生活质量[6]。因此,有效的治疗Ⅱ-型糖尿病的策略不仅要解决高血糖问题,还要防止疾病的进一步发展并预防其相关并发症[7]。
二肽基肽酶-IV(Dipeptidyl peptidase-IV, DPPIV)属于二肽基肽酶(Dipeptidyl peptidase, DPP)家族,是细胞表面的一种外切酶,在肾脏、肝脏、胰腺、胎盘、胸腺等处均有表达[8]。作为一种外切酶,DPPIV能特异性地从多肽和蛋白质的N端切去X-Pro、X-Ala二肽,并按Pro、Ala和Ser的优先顺序对其作为N端第二个氨基酸残基的多肽和蛋白质进行切割[9]。胰高血糖素样肽-1(Glucagon-like peptide-1,GLP-1)和葡萄糖依赖性促胰岛素释放肽(Glucosedependent insulinotropic polypeptide, GIP)都是以葡萄糖依赖的方式刺激胰岛素分泌的肠促胰岛素,它们通过刺激胰岛素分泌和抑制胰高血糖素分泌发挥糖调节作用[10−11]。作为 DPP-IV的天然底物,GLP-1和GIP极易被DPP-IV降解而失去活性,从而失去降糖作用。抑制DPP-IV可防止80%~97%的GLP-1被降解,并将其半衰期延长至2~40 h[12]。研究发现,DPP-IV抑制剂的最初作用可能是通过GLP-1介导的,当血糖控制开始得到改善,GIP的作用逐渐显现并进一步降血糖[13]。因此,临床使用的抗糖尿病药物,如西格列汀(Sitagliptin)、利格列汀(Linagliptin)、沙格列汀(Saxagliptin)和阿格列汀(Alogliptin)等的作用机理都是通过抑制DPP-IV的活性而实现降血糖效果的[12]。
目前,针对Ⅱ-型糖尿病的药物主要有磺脲类(Sulfonylureas, SUs)、噻唑烷二酮类(Thiazolidinediones, TZDs)、胰高血糖素样肽-1(Glucagon like peptide-1, GLP-1)受体激动剂、钠-葡萄糖共转运蛋白 2(Sodium-glucose co-transporter 2, SGLT-2)抑制剂和二肽基态酶(DPP-IV)抑制剂[14−15]。由于DPPIV抑制剂不仅可以有效降低血糖,且无低血糖风险,很多学者都将DPP-IV作为治疗Ⅱ-型糖尿病的靶点[16−17]。在单用二甲双胍不能使血糖降到标准浓度的Ⅱ-型糖尿病患者中,DPP-IV抑制剂可以降低糖化血红蛋白(Glycated haemoglobin, HbA1c)水平[18]。此外,作为肠促胰岛素类药物,DPP-IV抑制剂还可以口服给药,避免皮下注射[12]。但是,关于DPPIV抑制剂对心血管疾病、胰腺炎等影响的不确定性仍然存在[16,19−21]。美国食品药品监督管理局(Food and Drug Administration, FDA)发现,使用高选择性的DPP-IV抑制剂——捷诺维(JANUVIA),即西格列汀片治疗的患者可能出现上呼吸道感染、鼻咽炎和头痛等不良反应。
人工合成的治疗糖尿病药物普遍存在一定的副作用。实际上,除了药物控制,许多T2DM病例可以通过改变生活方式来预防,其中一项就是健康的饮食[22]。与合成药物相比,功能性食品的副作用较小[23]。因此,寻找天然、副作用小的功能性食品成为人们关注并不断努力的方向[24]。本文综述了食品源,特别是水产动物食品源DPP-IV抑制肽的制备方法及其效果,以期为功能性食品的开发提供一定的理论参考。
1 生物活性肽及其制备方法
生物活性肽是对身体功能或状况有积极影响并可能影响健康的特定蛋白质片段,它是由蛋白质经酶水解而成的分子量大小不一的多功能化合物[25−26]。生物活性肽根据其序列不同,可表现出具有抗菌、抗血栓、抗高血压、抗氧化、抗糖尿病和免疫调节等功能[26],甚至可能作为辅助性佐剂用于治疗/预防新型冠状病毒[27]。
食源性生物活性肽是指来源于食物蛋白并经蛋白酶水解后获得的各种具有不同生物活性的肽片段,通常长度为2~20个氨基酸残基[23]。现代营养学研究发现,膳食中的蛋白质经消化酶作用后,大多是以低聚肽形式吸收利用的,以游离氨基酸形式吸收的比例并不高,且肽比游离氨基酸更容易被吸收,表明肽的生物效价和营养价值比游离氨基酸更高[28]。因此,生物活性肽被认为是新一代生物活性调节剂,用于各种疾病的预防与治疗,从而提高人们的生活质量。探索开发基于这些肽的新型食品添加剂或功能性食品已成为科学界和食品工业界的热门课题[26]。
生物活性肽如抗高血压肽、抗氧化肽、抗糖尿病肽等的常见来源是乳制品、肉制品和谷类[25,29]。POWER等[7]认为食物蛋白水解物可作为DPP-IV抑制肽的来源,用于预防Ⅱ-型糖尿病。NONGONIERMA等[30]总结了50种对DPP-IV半抑制浓度(half maximal inhibitory concentration, IC50)值小于 100 μmol/L 的肽,其长度均在2~17个氨基酸残基之间。这些有效的DPP-IV抑制肽广泛来源于奶(牛、骆驼和马)、猪、鱼、小麦和大型藻类(棕榈藻)等食物蛋白。POWER等[31]发现,乳清蛋白水解物可以抑制DPP-IV活性,UENISHI等[32]从豪达奶酪的水溶性提取物中分离并最终合成对DPP-IV有抑制作用的肽LPQNIPPL,之后的小鼠动物实验进一步验证了该肽的效果。利用动物皮胶原蛋白制备的明胶富含Pro,其水解物同样有DPP-IV抑制活性。此外,豆类、藜麦、燕麦、苋菜等植物也是制备DPP-IV抑制肽的良好蛋白质来源[33]。
制备生物活性肽的常用方法如图1所示,包括直接提取、食物蛋白的酶解、发酵或化学合成[4,34]。其中,用于酶解的蛋白酶通常包括中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、菠萝蛋白酶、风味蛋白酶、胃蛋白酶和胰蛋白酶等。蛋白酶水解可以单酶水解,也可以多种酶复合水解,但水解的条件(如温度、pH等)要进行优化以达到获得最佳产物的效果。对蛋白进行酶解之后是活性肽的分离、测序和表征。分离是根据水解产物的性质和分子量等特性来进行的,常用的技术有:超滤、离子交换、亲和层析、凝胶过滤和反相高效液相色谱[34]。肽鉴定和表征包括确定其氨基酸序列、分子量、细胞生物学和动物学试验。活性肽的抑制潜力通常用抑制百分比或IC50来衡量。

图1 生物活性肽的制备及分离和鉴定流程图[4,34]Fig.1 Flow diagram for the preparation, separation and identification of bioactive peptides[4,34]
2 DPP-IV抑制剂(肽)的抗糖尿病机制
摄食特定的食物或食物成分与糖尿病发病率之间存在一定的相关性。合理的膳食可对Ⅱ-型糖尿病的防治起到重要作用,主要原因是食物中的蛋白组分经消化酶消化后具备抑制DPP-IV的能力,即食物组分经消化后产生具有抑制DPP-IV活性的肽[33]。
2.1 抗糖尿病活性测定
分离得到的DPP-IV抑制肽的抗糖尿病活性测定一般分为体外测定和体内测定两个方面。体外研究通常使用纯化肽或合成肽对DPP-IV的抑制活性以及该肽在模拟胃肠液作用下的稳定性等指标来评估;体内研究则是以糖尿病大鼠或者人(受试者)为研究对象,通常采用口服给药的方法,检查所得产物的有效性[4,35]。在体内研究方面,ZHU等[36]开展了海洋鱼胶原蛋白肽对T2DM患者治疗作用的研究,共招募了100名糖尿病患者和50名健康对照者。糖尿病患者随机分为治疗组和对照组,治疗组患者连续3个月每天口服13 g胶原蛋白肽,对照组服用安慰剂。经过3个月的治疗,患者的空腹血糖、糖化血红蛋白、空腹血胰岛素、总甘油三酯等指标显著改善,表明海洋鱼胶原蛋白肽可以改善T2DM患者的糖脂代谢,并有助于控制高血糖[36−37]。
2.2 DPP-IV抑制剂的作用机制
食物摄入体内以后,首先会引起肠促胰岛素的分泌增加,进而诱导胰岛素的分泌增加[30]。GLP-1促进胰岛素释放的作用机制如图2所示,GLP-1以葡萄糖依赖性方式刺激胰岛素分泌[38]。GLP-1与β细胞表面的GLP-1受体结合,通过刺激G蛋白激活腺嘌呤核苷三磷酸(Adenosine triphosphate, ATP),在腺苷酸环化酶(Adenylate cyclase, AC)的作用下形成环磷酸腺苷(Cyclic adenosine monophosphate,cAMP)。随后激活蛋白激酶 A(Protein kinase A,PKA)和cAMP调节的鸟嘌呤核苷酸交换因子Ⅱ(cAMP-GEFⅡ或Epac2),从而引发一系列级联效应,包括离子通道活性改变、细胞内Ca2+浓度变化(Ca2+内流)和胰岛素颗粒的胞吐增强[38]。GLP-1对β细胞有营养作用,它不仅能促进β细胞增殖,而且也能增强胰管上皮中来自祖细胞的β细胞的分化,GLP-1还可抑制β细胞的凋亡。所以,当细胞暴露在高血糖和高脂血症的毒性作用下,β细胞凋亡增加时,GLP-1可能会产生抑制凋亡的积极作用。此外,GLP-1还能抑制胃肠道分泌和运动,尤其是胃排空,抑制食欲,从而减少食物摄入[39]。

图2 GLP-1促进胰岛素释放作用机制[38]Fig.2 The mechanism of GLP-1 promoting insulin release[38]
然而,GLP-1是DPP-IV的天然底物,在人体内会被迅速降解(图3),半衰期仅两分钟,极其短暂[40]。GLP-1可与DPP-IV的活性位点相结合形成GLP-1与DPP-IV复合体。复合体形成后,活性GLP-1(7~37位)的 N 端 2、3位氨基酸(Ala和 Glu)之间的肽键将被削弱,之后迅速被降解,失去活性的GLP-1(9~37位)从活性位点解离,进而导致其胰岛素活性丧失[7,40−41]。因此,DPP-IV抑制剂可以保护肠促胰岛素不受酶的破坏,延长活性激素GLP-1的半衰期,从而起到控制血糖的作用。

图3 DPP-IV降解GLP-1的机理[7]Fig.3 Mechanism of GLP-1 degradation by DPP-IV[7]
DPP-IV抑制剂的作用机制可分为竞争性抑制和非竞争性抑制,典型的竞争性酶抑制剂可与DPPIV的天然底物竞争活性位点,但其存在剂量依赖性[7]。研究发现,许多肽都是DPP-IV的竞争性抑制剂,尤其是含有Pro的肽,如Ile-Pro[42]。竞争性抑制的第二种作用机制涉及到酶-抑制剂复合物的形成,即底物样抑制剂结合到DPP-IV的活性位点形成酶-抑制剂复合物[43]。与标准竞争性抑制剂相比,该抑制剂从活性位点解离的速度较慢,从而导致更长的DPPIV抑制时间(如维格列汀)[7]。非竞争性抑制剂可以与DPP-IV分子天然结构中的二级结合位点(如受体位点和底物识别位点)相互作用,这种结合改变了DPP-IV的底物特异性和催化活性[7]。已证明较长的肽(30~50个氨基酸)可作为非竞争性抑制剂,其作用机理主要是通过在二聚界面形成相互作用并阻止DPP-IV活性二聚体的形成[44]。此外,有研究表明这些肽也可以通过混合抑制模式发挥功能[45]。
虽然蛋白肽发挥其抗糖尿病作用的机制尚未完全阐明,但研究认为,体内关键氨基酸的餐后变化是一个促成因素。其中,Gln、Ala、Arg、Leu、Phe、Val、Ile、Lys等氨基酸具有较强的促胰岛素分泌活性;Glu、Ala、Ser、Gln、Gly、Asp、Leu、Met等氨基酸能刺激肠细胞释放GLP-1[46]。
3 海洋生物来源的DPP-IV抑制肽
富含蛋白质的食物是生物活性肽的主要来源,食物中的蛋白质经消化酶酶解后产生的肽具有多种生物活性,有益于人体健康。海洋生物种类占全球物种的80%以上,是食品和药品原料的重要来源,被誉为“蓝色粮仓”。由于海洋生物自身生长环境的特殊性(高渗、高盐、低温和低氧),它们的基因组、代谢规律,及酶系途径等都与陆产动植物存在显著差别,形成了一系列结构各异且品种繁多的天然产物。故来源于海洋生物的蛋白质是制备DPP-IV抑制肽、改善Ⅱ-型糖尿病患者身体健康的重要资源[47]。其中,生物活性多肽是海洋活性物质中发现最多的化合物[48]。大量研究表明,从海洋生物中制备的多肽具有抗疲劳、抗氧化、提高免疫力、降血压和降血糖等功效[49]。
HUANG等[35]用蛋白酶XXIII和orientase 90N对金枪鱼蒸煮液进行酶解,之后通过凝胶过滤色谱和高效液相色谱进一步分离,最终鉴定并合成得到3个具有DPP-IV抑制活性的肽:PGVGGPLGPIG PCYE、 CAYQWQRPVDRIR和 PACGGFWISGR PG,它们的IC50值分别为116.1、78.0和96.4 μmol/L。经过体外模拟胃肠液消化后,这三个肽的DPP-IV抑制活性都有升高,其中PGVGGPLGPIGPCYE和CAYQWQRPVDRIR的抑制活性显著升高。这说明经过消化后,这两个肽形成了新的、分子量更小的具有DPP-IV抑制活性的肽,且比原始肽具有更强的肠渗透力。
LI等[50]通过碱性蛋白酶、风味蛋白酶以及菠萝蛋白酶对大西洋鲑鱼皮明胶进行酶解、分离、鉴定得到两种对DPP-IV有抑制作用的肽GPAE(372.4 Da)和GPGA(300.4 Da)。这两种肽对DPP-IV的IC50值分别为49.6和41.9 μmol/L,显示出很强的DPP-IV抑制活性,这2种肽的N端第二个氨基酸均为Pro。一般地,具有DPP-IV抑制活性寡肽的N端第二个残基为 Pro、Trp、Ala、Val、Lys和 Asp,其中 Pro 是最优选的[9]。DPP-IV可以特异性地从肽的N端切割二肽X-Pro或X-Ala。研究认为,N端第二个氨基酸为Pro的DPP-IV抑制肽,由于其类似底物的性质,可能以竞争性抑制的方式发挥作用[51]。动物实验证明,口服大西洋鲑鱼皮明胶水解物可以改善大鼠的口服糖耐量、抑制血浆DPP-IV活性、提高血浆GLP-1活性、增加胰岛素分泌、降低胰高血糖素水平[37]。这表明大西洋鲑鱼皮明胶水解物不仅在体外有很强的DPP-IV抑制活性,在糖尿病大鼠中也能表现出DPP-IV抑制活性,显示出良好的降糖效果,具有良好的应用前景,有望进一步发展为治疗糖尿病的功能性食品。
HARNEDY等[46]研究表明,用碱性蛋白酶和风味蛋白酶对鲑鱼明胶进行水解,水解物在体外表现出显著的抗糖尿病(胰岛素、GLP-1分泌和DPP-IV抑制)能力,其中鲑鱼皮明胶水解物和鲑鱼碎屑水解物中均存在具有DPP-IV抑制活性的肽段。
WANG等[9]用风味蛋白酶分别酶解比目鱼和罗非鱼鱼皮明胶,得到比目鱼皮水解物(halibut skin hydrolysate, HSGH)和罗非鱼皮明胶水解物(tilapia skin gelatin hydrolysate, TSGH)。动物实验表明,TSGH对DPP-IV的抑制作用和对GLP-1分泌的促进作用均大于HSGH,血浆胰岛素水平同样显示出TSGH的优越性,TSGH对糖尿病大鼠具有与西格列汀相同的抗高血糖作用,且对正常大鼠没有降低血糖的副作用。之后将水解物进行超滤,选择DPP-IV抑制活性较高的部分进行肽鉴定,从HSGH中分离得到三种肽:SPGSSGPQGFTG、GPVGPAGNPGA NGLN和 PPGPTGPRGQPGNIGF,IC50值分别为101.6、81.3和 146.7 μmol/L;从 TSGH 中分离得到三种肽:IPGDPGPPGPPGP、LPGERGRPGAPGP和GPKGDRGLPGPPGRDGM,IC50值分别为65.4、76.8和89.6 μmol/L。TSGH的抗糖效果好于HSGH,这可能是因为罗非鱼(温水鱼)皮水解产物中的亚氨基酸含量高于比目鱼(冷水鱼),而Pro又是唯一的一个亚氨基酸,这进一步说明了Pro在DPP-IV抑制肽中的重要性。
ZHANG等[51]研究了鲢鱼蛋白水解液的DPPIV抑制活性,发现中性蛋白酶水解液对DPP-IV的抑制作用最强。对蛋白酶水解液进行超滤、薄层色谱法(Thin-layer chromatography, TLC)、反相-高效液相色谱(Reversed-phase high performance liquid chromatography, RP-HPLC),并从中分离鉴定出4个肽:AGPPGPSG、APGPAGP、LPIIDI和 ALAPSTM,其中LPIIDI和APGPAGP具有较强的DPP-IV抑制活性,这2种肽均表现为竞争/非竞争混合型DPPIV抑制模式。在鲢鱼肌肉中,胶原蛋白虽然含量较低,但由于其丰富的Pro/Hyp含量,被认为是DPPIV抑制肽的优良来源。这说明DPP-IV抑制肽的生物活性取决于蛋白质结构,特别是不同水解产物中释放的肽的性质[35,50−51]。
HARNEDY等[52]用碱性蛋白酶和风味蛋白酶对蓝鳕肌肉蛋白进行水解,水解物在体外显示出DPP-IV抑制作用,同时还可刺激胰岛素分泌、增加GLP-1的释放和脂肪细胞对葡萄糖的摄取,在模拟胃肠液消化后,水解物对DPP-IV的抑制作用以及对胰岛素的刺激作用无明显变化,而GLP-1的释放显著增加。此外,在正常健康小鼠中观察到蓝鳕鱼水解物的急性(90~120 min)和持续性(4 h)降糖作用。这些结果表明,蓝鳕鱼蛋白水解物在体外的降糖作用可能同样适用于体内。
JI等[53]用Corolase PP酶解南极磷虾,再经过超滤、凝胶色谱柱、阴离子交换柱以及RP-HPLC,最终成功分离出对DPP-IV和血管紧张素转换酶(angiotensin-converting enzyme, ACE)都有抑制活性的两种肽:KVEPLP和PAL,这两种肽对DPP-IV的IC50值分别为0.73和0.88 mg/mL。
上述研究表明,许多食物蛋白经酶解后都存在具有DPP-IV抑制作用的肽,这为进一步的研究提供了理论依据。同时,一种生物活性肽可能具有抑制两种甚至多种酶活性的功能,提示多功能肽有望成为一个新的研究方向。
有关DPP-IV抑制肽的结构与其生物活性的关系尚未完全阐明,对上述成功分离出的几种多肽整理发现,具有DPP-IV抑制活性的肽通常在其N端第一或第二位都有Pro的存在(表1)。此外,在蜡样芽孢杆菌培养滤液中鉴定出来的Ile-Pro-Ile是迄今为止所报道的最有效的DPP-IV抑制肽[30,54],进一步证实了Pro是其具有DPP-IV抑制作用的关键所在。LACROIX等[55]用硅化法对9种食品中的34种蛋白质作为DPP-IV抑制肽前体的潜力进行了评估。在所研究的34个蛋白中,共发现2256个肽段序列与文献报道的具有DPP-IV抑制活性的肽段序列一致,其中Gly-Ala、Gly-Pro和Pro-Gly是出现频率最高的序列。经模拟胃肠道消化后,许多肽仍具有DPP-IV抑制活性,说明它们可能是具有DPP-IV抑制特性的潜在功能成分,有望用于治疗或控制Ⅱ-型糖尿病的发生与发展。
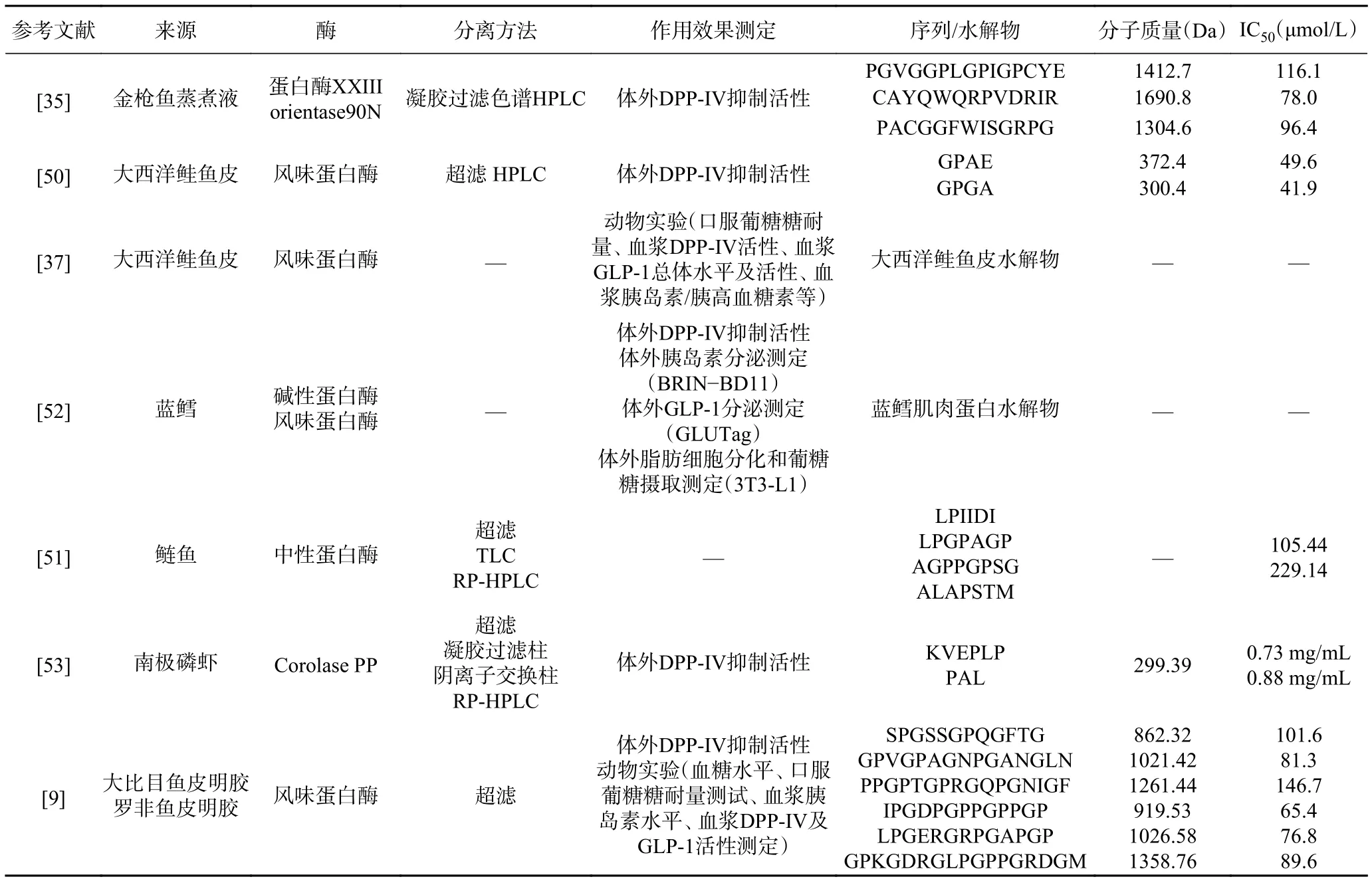
表1 海洋动物来源的DPP-IV抑制肽Table 1 Marine sources of DPP-IV inhibitory peptides
4 结语与展望
目前,许多体外研究以及动物实验都证明了食源性肽可作为DPP-IV抑制剂的潜在来源。有些食源性肽不仅具有DPP-IV抑制活性,还具有抑制ACE等其他生物活性,有可能发展为多功能肽。然而,蛋白质水解物对人体血浆DPP-IV活性的影响尚待评估,需要更详细的人体研究来全面评估其疗效、安全性和效力。迄今为止,已鉴定的DPPIV食品蛋白衍生肽抑制剂尚未显示出与合成药物抑制剂同等的效力。因此,这些抑制剂可能最适合于糖尿病前期或轻度糖尿病患者的联合治疗或作为营养干预策略的一部分[7]。同时,这也对科学家们提出了新的挑战,如何强化食源性DPP-IV抑制肽的作用,使其达到不仅天然、安全,而且高效,甚至达到相当于药物的治疗效果。随着对食源性肽研究的更加深入,它们将来有望作为一种新的手段来治疗Ⅱ-型糖尿病。
