多黏菌素类药物诱导神经毒性的机制研究进展
2021-12-15曲星伊刘笑芬
曲星伊, 刘笑芬, 张 菁,*
20世纪70年代,多黏菌素类药物因其严重的肾毒性和神经毒性,逐渐在临床上少用或不用,截止2016年国内尚无全身使用的该类药物。革兰阴性耐药菌检出率的剧增导致重症感染患者面临无药可用的局面,而多黏菌素类药物对上述耐药菌具有良好的抗菌活性,因此被重新用于临床[1]。相较于肾毒性,多黏菌素诱导神经毒性的机制研究较少[2]。神经系统中多元不饱和脂肪含量及氧需求量更高,容易受到药物损伤[3]。临床上多黏菌素类药物诱导的神经毒性主要表现为意识模糊、头晕、面部和外周感觉异常、视觉障碍、肌无力、幻觉、眩晕、痫性发作和共济失调等[2,4],常在治疗5 d内出现[5-6],通常可逆[7]。2020年Wagenlehner等[8]统计多黏菌素类药物诱导的神经毒性总发生率约为3%,相较于上世纪文献报道的27%显著较低[9],这可能归结于临床用药方案的改进[2,8]。但临床上多黏菌素类药物神经毒性的实际发生率常被低估[2,10-11],轻微神经毒性不良反应未受重视、昏迷或镇静状态的重症患者神经功能异常难以被察觉等是被低估的可能原因[8]。与既往的综述报道不同[2,12],近年来因多黏菌素类药物致呼吸肌麻痹从而产生呼吸衰竭的严重不良反应病例,仅2011—2020年就报道了至少10例[7,13-20]。呼吸衰竭常在药物输注中发生,如果处理不及时会严重威胁到患者的生命。因此多黏菌素类药物的神经毒性仍然需要引起临床用药的重视。
临床应用的多黏菌素类药物包括硫酸黏菌素(多黏菌素E)(仅国内有品种)、多黏菌素甲磺酸盐(前药,活性成分为多黏菌素E)、多黏菌素B三种[21],其中多黏菌素B神经毒性的发生率高于多黏菌素E,但无显著差异[11]。在特定人群中,囊性纤维化患者[4,22]和女性患者[2,5]发生神经毒性的概率更高,具体原因尚不清楚。囊性纤维化患者神经毒性可能与多黏菌素B具有一定关联[22]。研究多黏菌素类药物诱导神经毒性的分子机制,有利于避免毒理机制相似的药物同时使用,对于临床制定合理给药方案、避免不必要的不良反应和通过药物缓解多黏菌素类药物的神经毒性具有重要作用。
1 多黏菌素类药物在血脑屏障和神经细胞中的转运
由于健康人血脑屏障内皮细胞间紧密相连,多黏菌素类药物很难透过血脑屏障进入中枢神经系统,脑脊液中药物浓度很低[23]。革兰阴性细菌细胞膜的脂多糖(LPS)可破坏血脑屏障,提高多黏菌素的转运水平[24-25]。除此之外,连续静脉给药导致的多黏菌素在脑膜炎患者脑实质中的蓄积[26-28],可能还与多黏菌素类药物在大脑中的长半衰期有关[29]。外排转运体P-糖蛋白(P-gp)对多黏菌素在血脑屏障的转运影响极小[30],但发现肾小管细胞通过寡肽转运蛋白(PEPT)和有机阳离子转运蛋白1(OCTN1)摄取多黏菌素进入细胞[31-32],脑微血管细胞中也表达这两种转运蛋白[33],它们可能参与了多黏菌素类药物进入脑实质的过程[27],但是中枢神经系统毒性是否与这两种转运体有关仍需进一步确定。
相较于中枢神经系统,多黏菌素周围神经系统毒性的发生率更高,并以外周感觉异常为主[2,8],主要与周围神经细胞缺乏血脑屏障的保护,对多黏菌素的暴露可能更敏感有关[34]。然而多黏菌素的周围神经系统毒性的机制[35],仍有待进一步研究[3]。
2 多黏菌素类药物诱导氧化应激和线粒体功能障碍
多黏菌素类药物诱导的神经毒性与活性氧(reactive oxygen species, ROS)水平升高,抗氧化酶如超氧化物歧化酶(superoxidase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽转移酶(glutathione transferase, GST)活性降低有关[36-38]。多黏菌素类药物处理的大鼠脑内氧化应激主要标志物发生显著变化,丙二醛(MDA)水平及DNA损伤片段含量呈剂量依赖性增加,15 mg/kg给药组谷胱甘肽(GSH)水平降低一半、Caspase-3含量升高12倍[38]。
线粒体在维持细胞氧化还原稳态和髓鞘轴突的结构完整性中具有关键作用[39-40]。多黏菌素类药物诱导线粒体功能障碍主要表现为细胞色素C(cytochorme C,CytC)释放、Bax/Bcl-2蛋白升高和线粒体膜电位下降[28,36,41-42]。多黏菌素会使PC-12、N2a细胞受到氧化损伤,出现纺锤体样收缩和树突破碎等形态学改变[36,43]。
静脉注射多黏菌素后,小鼠出现大脑皮层、脊髓和坐骨神经细胞线粒体肿胀和电生理异常[3,28,44]、坐骨神经脱髓鞘和轴突变性的现象与氧化应激有关[44]。Islam[45]认为共济失调也与氧化应激和线粒体功能障碍相关,但目前没有研究证明多黏菌素类药物在其中的作用。
3 多黏菌素类药物诱导细胞凋亡和相关的自噬通路
经多黏菌素类药物处理后,细胞出现大量染色质浓缩和DNA损伤片段,提示诱导细胞凋亡[36]。自噬对多黏菌素诱导的细胞凋亡早期可能具有调节作用[46],自噬阻断或延迟了细胞凋亡的产生,而凋亡相关caspase的激活则关闭了自噬的过程[47-48]。
p53在细胞凋亡和自噬中起关键作用,Zhang等[49]和Lu等[50]对p53在多黏菌素类药物在细胞凋亡中发挥的诱导和抑制双重作用作了阐述。尽管多黏菌素可以上调PC-12细胞中p53、DRAM、PUMA、Bax的表达水平[51],但p53在多黏菌素诱导的神经毒性中的具体作用仍有待研究,不能作为神经毒性的保护靶点[50]。与p53的双重作用类似,JNK的早期激活促进PC-12细胞自噬,而持续性激活则诱导细胞凋亡[52-53]。有研究表明,JNK参与多黏菌素诱导的神经毒性,并与ROS和p53形成正反馈环,共同调节细胞的自噬和凋亡[52]。
Akt信号通路是调节中枢和外周神经系统信号通路的关键因子[54],抑制Akt的表达可明显增强多黏菌素类药物的细胞毒性,提示Akt在多黏菌素的诱导神经毒性中具有保护作用[55-56]。体外细胞实验中,多黏菌素可以抑制N2a、PC-12和RSC96 Schwann细胞中Akt和mTOR的mRNA的水平[49,55-56],而Akt及其下游基因mTOR可以调节外周神经系统髓鞘的形成[57-58],提示多黏菌素类药物诱导的外周神经系统毒性可能与Akt信号通路有关。
葡萄糖调节蛋白(Grp78)是一种细胞伴侣和钙结合蛋白,在内质网应激导致异常蛋白积累时表达增高[59]。多黏菌素明显增加小鼠大脑皮质中的Grp78的表达,说明内质网凋亡通路参与多黏菌素诱导的神经毒性[31,55]。在大鼠肾小管细胞中发现了多黏菌素B与内质网和线粒体存在共定位[60],在神经细胞中暂无相关研究。
4 多黏菌素类药物诱导炎症介质异常
多黏菌素通过诱导NF-κB和TNF-α等促炎症介质生成[61-62],在大脑中诱导神经炎症[63-64]。多黏菌素还使脑内神经型一氧化氮合酶(nNOS)含量升高,过量产生一氧化氮(NO),而NO通过诱导神经元细胞产生活性氮介导神经毒性[62]。NF-κB、TNF-α、NO等介质的作用可能导致神经元细胞死亡,产生神经毒性和认知障碍[45],与多黏菌素类药物诱导的意识模糊、共济失调等神经毒性可能相关。
此外,多黏菌素使小鼠神经元的感觉神经传导速度(sensory nerve conduction velocity, SNCV)降低和感觉功能异常[26],多表现为瘙痒感[65],可能与组胺有关[66],推测组胺释放可能在多黏菌素类药物诱导的外周感觉异常(包括瘙痒)中发挥重要作用[2,26,67]。
5 多黏菌素类药物诱导神经递质紊乱
静脉注射多黏菌素使小鼠大脑皮层中谷氨酸、γ-氨基丁酸(GABA)增加,GABA受体表达增强[27]。当联合应用多黏菌素和谷氨酸时,可导致周围神经变性萎缩[68]。多黏菌素类药物可能通过NMDA通路,降低钙调素的表达并提高鸡皮质神经元内游离钙浓度[42]。高浓度的谷氨酸使NMDA受体过度激活,导致Na+和Ca2+内流增加,诱导线粒体氧化应激的产生及caspase的激活[69-71]。然而,多黏菌素类药物诱导细胞凋亡与谷氨酸及其受体水平变化之间的确切关系还有待进一步确认[27]。
除了谷氨酸和GABA外,多黏菌素类药物能够以剂量依赖性的方式增加胆碱能、单胺能、嘌呤能神经递质的释放,引起大鼠脑内血管扩张和细胞核凝聚[27]。而多黏菌素抑制神经细胞释放乙酰胆碱,导致的乙酰胆碱在细胞内积聚,曾被认为是多黏菌素诱导神经肌肉阻滞,产生呼吸暂停不良反应的重要原因之一[2]。而多种神经递质的释放增加可能打破脑内原有的兴奋-抑制平衡,引起一系列中枢神经系统症状,如癫痫[72]、视觉障碍[73]等。多黏菌素类药物诱导神经毒性的分子机制见图1。
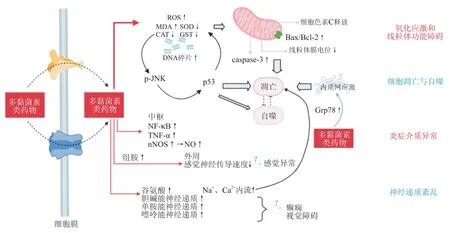
图1 多黏菌素类药物诱导神经毒性的分子机制图Figure 1 Molecular mechanism of polymyxins-induced neurotoxicity
6 多黏菌素类药物神经毒性的缓解
一些研究者推荐使用静脉注射钙剂、抗组胺药对抗多黏菌素B的神经毒性[74],也有研究者认为肝素可以降低多黏菌素E诱导实验小鼠呼吸暂停导致的死亡率[75]。近年来已经报道多种药物可以通过对抗氧化应激和细胞凋亡、炎症反应及调节神经递质含量等方式,缓解多黏菌素E诱导神经毒性。
姜黄素是提取自姜科植物根茎中的二酮类化合物,细胞和动物水平的研究均表明姜黄素可以通过减轻氧化应激、炎症和细胞凋亡而减轻多黏菌素E的神经毒性[61,76-78]。其他中草药提取物如红景天苷[56]、人参皂苷[79]、芦丁[80]等也具有缓解多黏菌素神经毒性的作用。上述中草药提取物具有一定的抗菌作用,多黏菌素与之联合应用可能会有额外的临床获益,但还需要更多的体外及临床前研究数据。免疫抑制剂雷帕霉素[55]和抗生素米诺环素[37]通过对抗多黏菌素诱导的氧化应激、线粒体功能障碍和细胞凋亡缓解其神经毒性,其中米诺环素与多黏菌素联合应用具有协同抗菌作用且有利于减缓耐药性发展[81-82]。此外,具有还原性的抗坏血酸[83]和神经保护剂神经生长因子[35]也可以减轻多黏菌素的神经毒性。
7 结论
多黏菌素类药物是目前临床上治疗多重耐药革兰阴性菌感染的重要抗菌药物,临床用药时,尤其是同时使用其他已知肾毒性或神经毒性药物的情况下,应当注意监测患者的肾功能和神经状态,根据临床情况进行治疗药物监测,尽可能减少不良反应的发生。对危重患者出现呼吸无力或呼吸暂停的现象要具有高度的察觉能力[7],当出现呼吸暂停等严重不良事件时立刻采取停药、加速药物清除和适当的支持性治疗。尽管使用鞘内注射或脑室内注射多黏菌素类药物的方法既可以达到脑内的有效浓度又可以避免外周浓度过高导致的肾毒性和外周神经毒性,临床给药仍需注意给予合适的剂量并关注不良反应的发生[84]。总之,尽管多黏菌素类药物神经毒性的分子机制研究尚不明确,但已有的研究仍可以为临床方案制定和风险防范提供一些参考,如避免合用具有相似神经毒性的药物,联合应用有缓解神经毒性作用的药物等。
