度洛西汀通过调控JNK和NF-κB信号通路对急性心肌梗死大鼠心功能的影响
2021-12-15孙云谷慧平
孙云,谷慧平
急性心肌梗死(AMI)是流向心脏的血流减少或完全停止,是导致世界范围内死亡或致残的主要疾病之一[1]。在AMI后,氧自由基等活性氧物质的产生增加,激活多种信号通路导致炎性反应和心肌细胞凋亡,最终引起心功能受损和心室重构,严重影响预后[2]。在AMI后心肌损伤过程中,主要的通路是c-Jun氨基末端激酶,(JNK)通路和核因子(NF)-κB,这两种信号转导通路的激活均会诱导其靶基因的过表达,包括白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等[3,4]。度洛西汀是一种抗抑郁和调控周围神经功能的药物,最新研究显示度洛西汀可缓解心肌缺血再灌注后的心律失常,提示其具有保护心功能的作用[5]。也有研究显示度洛西汀有显著的抗炎作用[6],据此推测度洛西汀可能通过抑制炎性反应缓解AMI后的心肌损伤,从而提高心功能。本次研究主要分析度洛西汀通过调控JNK和NF-κB信号通路对AMI动物模型心功能的影响,探究作用机制,为治疗AMI提供新思路。
1 材料与方法
1.1 主要实验材料SD大鼠(SPF级,雄性,220~250 g,上海斯莱克实验动物中心,中国)。度洛西汀(江苏恩华,H20130056)。小动物呼吸机(Inspira ASV,哈佛仪器公司,美国)。BL-420F小动物生物功能实验系统(成都泰盟科技有限公司,中国)。Mayer's苏木精和0.5%曙红水溶液(H8070,DH0050,北京Solarbio公司,中国)。酶联免疫吸附(ELISA)试剂盒、TUNEL凋亡试剂盒(碧云天公司,中国)。酶标仪(Model 680,Bio-Rad,美国)。组织匀浆机(Thermo Fisher Scientific公司,美国)。Trizol试剂购自美国Invitrogen公司。逆转录cDNA试剂盒和SYBR Green PCR Master Mix qPCR试剂盒购自瑞士Roche公司。RIPA裂解缓冲液(中国,北京,Beyotime)。BCA试剂盒(武汉博士德生物技术有限公司,中国)。抗体购自美国Abcam公司。PVDF膜(Bio-Rad公司,美国)。显微镜(Olympus 公司,日本)。
1.2 动物分组、建模和干预40只大鼠随机分为4组(n=10):Sham组、AMI组和AMI+低剂量度洛西汀(AMI+L)组和AMI+高剂量度洛西汀(AMI+H)组。AMI组、AMI+L组和AMI+H组大鼠按照参考文献进行结扎建立AMI模型[7],通过腹腔注射1%戊巴比妥(剂量为3 ml/kg)使大鼠麻醉,染后仰卧固定在无菌操作板上,将针电极皮下插入四肢,使用12导联心电图通过四肢导线进行监测。消毒剃毛后在第三、四肋间隙处剪开,将大鼠插管并连接呼吸机(潮气量3 ml/kg,呼吸频率60~70 次/ min)。切开并暴露左胸腔,打开心包,使用6/0线结扎左前降支,心脏表面立即变为深红色,心电图ST段抬高。保持结扎30 min;取出丝线行再灌注,缝合胸腔,术后肌注80万单位青霉素防止感染。Sham组大鼠在行相同操作但不结扎。建模后AMI+L组和AMI+H组大鼠均腹腔注射度洛西汀,根据人与大鼠的体重换算,剂量分别为40 mg/kg和80 mg/kg。Sham组和AMI组大鼠使用等量溶剂腹腔注射作为对照,1/d,连续7 d,干预后对大鼠进行后续研究。
1.3 观察指标及方法
1.3.1 心功能指标通过BL-420F生物功能实验系统检测心功能,该系统的2个通道用于检测左室收缩末期压力(LVESP)和左室舒张末期压力(LVEDP),通过4通道显示2通道心室收缩期间左心室压力的最大上升和下降速率(±dP/dt max)。
1.3.2 HE染色检测心肌梗死面积和心肌组织损伤情况大鼠吸入过量的二氧化碳麻醉后断头处死,取出心脏沿结扎线分为两半,以保留结扎线和心尖之间的区域。将组织用4%多聚甲醛固定并用梯度醇脱水,包埋在石蜡中,制成厚度5 μm的组织玻片标本。加入Mayer's苏木精在室温下赋孵育10 min,加入0.5%曙红溶液室温下赋予3 min。根据HE染色结果,测定心肌组织左心室壁厚度(LVWT),室间隔厚度(IVST),内外膜弧长和疤痕内外周长,使用Image Pro Plus 6.0软件计算心肌梗死面积。梗死面积=(内膜的弧长+外膜的弧长)/(疤痕的内周+疤痕的外周)×100%。
1.3.3 TUNEL染色检测心肌细胞凋亡按照1.3.3的方法制备心肌组织玻片标本,经脱蜡、抗原修复处理后用密封液封闭。将切片在37℃的混合工作溶液(20 μg/ml蛋白酶K溶液PH=7.5~8.0)中孵育并修复15 min。加入50 μl的TUNEL反应溶液,37℃下孵育1 h,使用PBST洗涤切片,加入100 μl的二氨基联苯胺在37℃下孵育30 min,用PBST洗涤,最后在显微镜下观察样品。随机选择每个组织的四个视野观察,计算凋亡指数=凋亡核数/(凋亡核数+正常细胞核数)×100%。
1.3.4 酶联免疫吸附法(ELISA)大鼠麻醉后处死,采集心脏内的血液样本,离心(2000 rpm,20 min)后收集上层血清。根据试剂盒说明书分别加入抗体和显色剂,通过酶标仪检测450 nm处吸光度,根据标准曲线计算IL-6、TNF-α、超氧化歧化酶(SOD) 、丙二醛(MDA)的浓度。
1.3.5 实时荧光定量PCR(qPCR)使用Trizol获得心肌组织中总RNA并检测检测RNA的浓度和纯度。使用逆转录cDNA试剂盒逆转录1 μg RNA用于合成cDNA(42℃下60 min,70℃下5 min,4℃保存)。 使用SYBR Green PCR Master Mix和PCR检测系统进行qPCR实验(95℃/10 min,40个循环,94℃/15 s,60℃/1 min, 60℃/1 min,4℃保存)。比较循环阈值(ΔΔCt)用于分析RNA的表达。GAPDH和U6用于标准化。
1.3.6 蛋白质印迹(Western blot)将心肌组织用匀浆机均匀研磨。蛋白浓度通过双BCA试剂盒测量。分别取总量为40 μg的总蛋白使用10%的聚丙烯酰胺凝胶进行电泳(PAGE)(80~120 V,90 min)。在100 mV的恒定电压下与PVDF膜进行湿转移。在5%牛血清白蛋白(BSA)中于室温孵育1 h。将1:500稀释的anti-Nrf2、anti-HO-1添加到分离的蛋白质中,并在4℃下孵育过夜。洗涤后在室温下添加二抗孵育1 h,加入化学发光试剂显影。GAPDH用作内部参考,用Image J软件分析目标条带的灰度值。
1.4 统计学分析统计分析使用SPSS 19.0软件。数据以平均值±标准差表示。多组间比较进行单因素方差分析,两两比较使用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 度洛西汀对AMI大鼠心功能指标比较四组间的心功能指标比较差异显著(P<0.05),其中AMI组的LVESP、±dP/dt max显著低于Sham组而LVEDP显著高于Sham组(P<0.05),AMI+L组和AMI+H组的LVESP、±dP/dt max显著高于AMI组而LVEDP显著低于AMI组(P<0.05),且对于LVESP、±dP/dt max,AMI+H组显著高于AMI+L组(P<0.05);对于LVEDP,AMI+H组显著低于AMI+L组(P<0.05),表1。
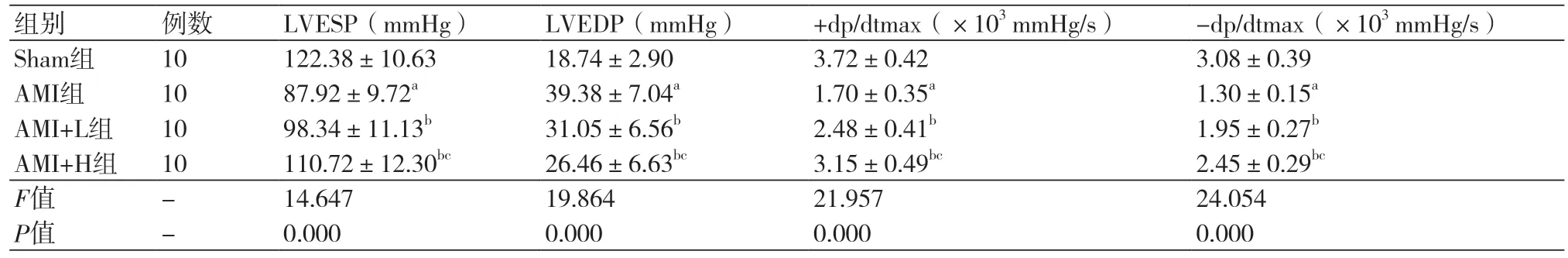
表1 度洛西汀对AMI大鼠心功能指标比较
2.2 度洛西汀对AMI大鼠心肌梗死面积的影响四组间的心肌梗死面积比较差异显著(P<0.05)。其中Sham组无心肌梗死,AMI组的梗死面积为(2.41±0.39 mm2),P<0.05;AMI+L组的梗死面积为(2.02±0.42 mm2),显著小于AMI组(P<0.05);AMI+H组的梗死面积为(1.69±0.41 mm2),显著小于AMI组和AMI+L组(P<0.05),见图1和表2。
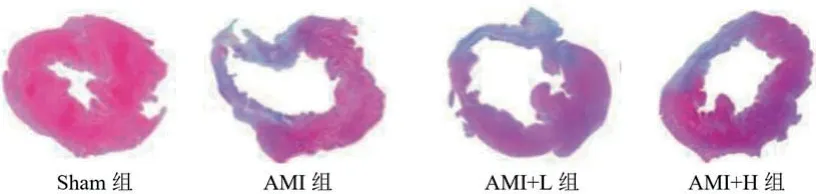
图1 HE染色检测度洛西汀对AMI大鼠心肌梗死面积的影响
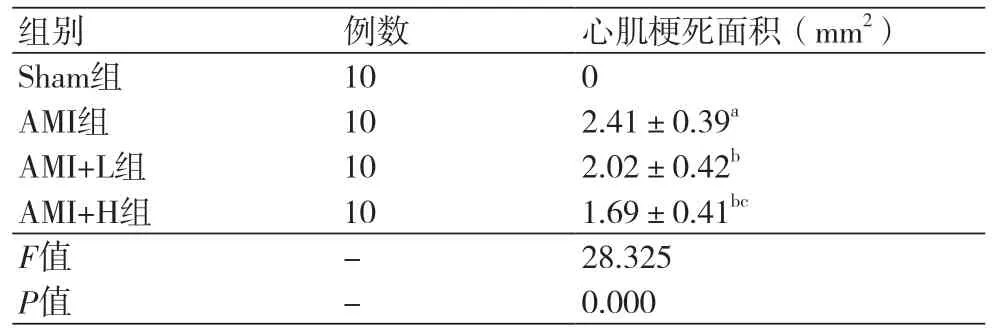
表2 度洛西汀对AMI大鼠心肌梗死面积的影响
2.3 度洛西汀对AMI大鼠心肌组织损伤的影响Sham组的心肌细胞成纤维状有序排列,细胞质和细胞核染色均匀,细胞核饱满;AMI组大鼠心肌细胞染色不均匀,排列紊乱,并出现炎性浸润;AMI+L组的心肌组织也出现了炎性浸润,但细胞排列基本正常;AMI+H组的心肌细胞染色不均匀,但排列有序,有少量炎性损伤(图2)。
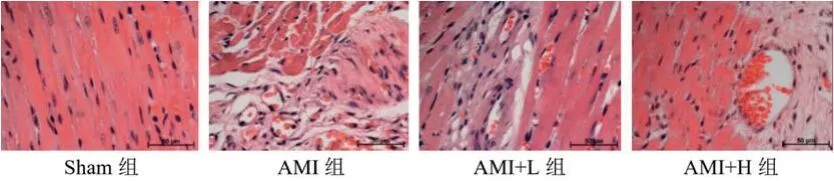
图2 HE染色检测度洛西汀对AMI大鼠心肌组织损伤的影响
2.4 度洛西汀对AMI大鼠心肌细胞凋亡的影响四组间的心肌凋亡指数比较差异显著(P<0.05)。其中Sham组的心肌凋亡指数为(3.80±0.56%),AMI组的凋亡指数为(32.75±3.67%),显著高于Sham组(P<0.05),AMI+L组的凋亡指数为(21.12±2.74%),显著小于AMI组(P<0.05);AMI+H组的凋亡指数为(16.64±3.11%),显著小于AMI组和AMI+L组(P<0.05),见图3及表3。

表3 度洛西汀对AMI大鼠心肌细胞凋亡的影响
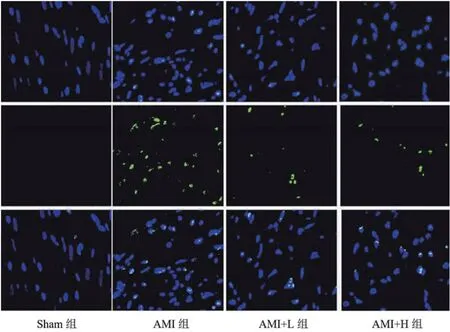
图3 TUNEL染色检测度洛西汀对AMI大鼠心肌细胞凋亡的影响
2.5 度洛西汀对AMI大鼠血清炎性因子和氧化应激因子的影响四组间的炎性因子和氧化应激因子水平比较差异显著(P<0.05)。AMI组的IL-6(19.52±3.84 pg/ml)、TNF-α(16.03±2.69 pg/ml)、MDA(14.98±1.83 nmol/ml)显著高于Sham组,SOD(55.37±9.63 U/ml)显著低于Sham组(P<0.05)。AMI+L组的IL-6(15.77±2.21 pg/ml)、TNF-α(11.83±2.04 pg/ml)、MDA(11.08±1.47 nmol/ml)显著低于AMI组,SOD(65.14±12.74 U/ml)显著高于AMI组(P<0.05);AMI+H组的IL-6(12.02±2.34 pg/ml)、TNF-α(8.73±1.97 pg/ml)、MDA(8.26±1.25 nmol/ml)显著低于AMI+L组,SOD(79.53±13.01 U/ml)显著高于AMI+L组(P<0.05),表4。
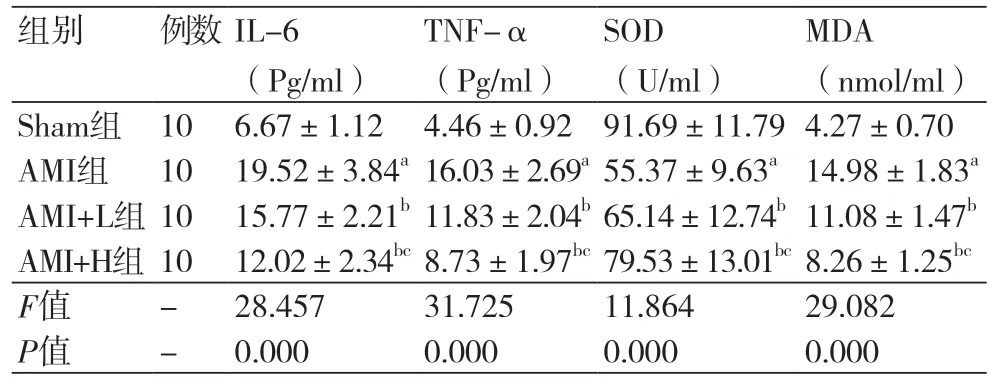
表4 度洛西汀对AMI大鼠血清炎性因子和氧化应激因子的影响
2.6 度洛西汀对AMI大鼠心肌组织中JNK和NF-κB mRNA的影响四组间的JNK和NF-κB mRNA水平比较差异显著(P<0.05)。AMI组的JNK和NF-κB mRNA的水平显著高于Sham组(P<0.05)。AMI+L组的JNK和NF-κB mRNA的水平显著低于AMI组(P<0.05);AMI+H组的JNK和NF-κB mRNA的水平显著低于AMI+L组(P<0.05),表5。
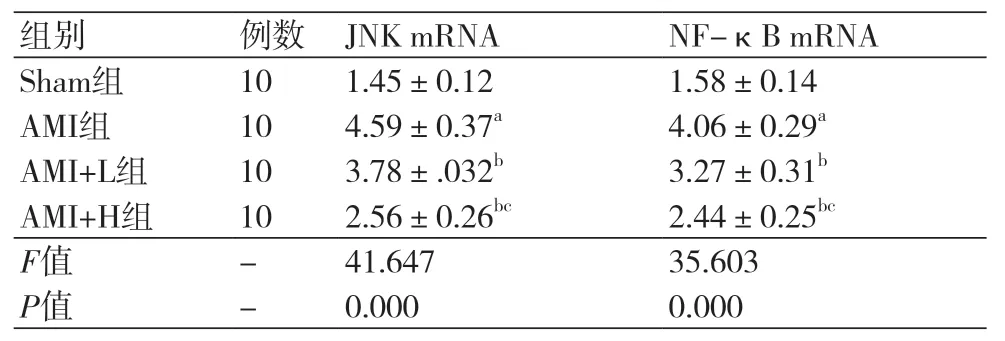
表5 度洛西汀对AMI大鼠心肌组织中JNK和NF-κB mRNA的影响
2.7 度洛西汀对AMI大鼠心肌组织中JNK和NF-κB蛋白的影响四组间的JNK和NF-κB通路水平比较差异显著(P<0.05)。AMI组的JNK和NF-κB蛋白的水平显著高于Sham组(P<0.05)。AMI+L组的JNK和NF-κB蛋白的水平显著低于AMI组(P<0.05);AMI+H组的JNK和NF-κB蛋白的水平显著低于AMI+L组(P<0.05),见图4及表6。
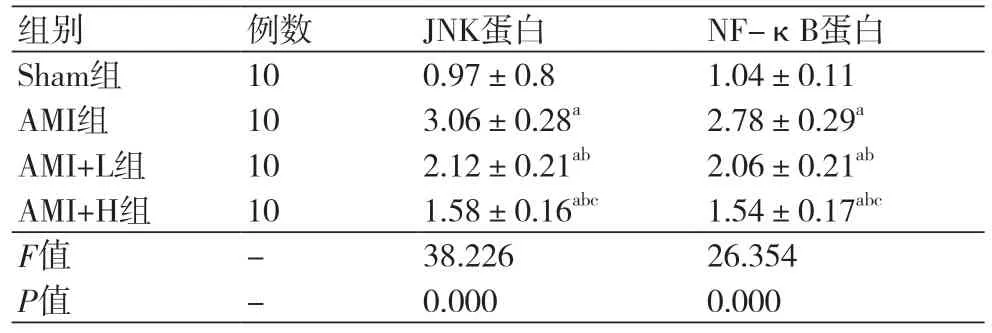
表6 度洛西汀对AMI大鼠心肌组织中JNK和NF-κB蛋白的影响
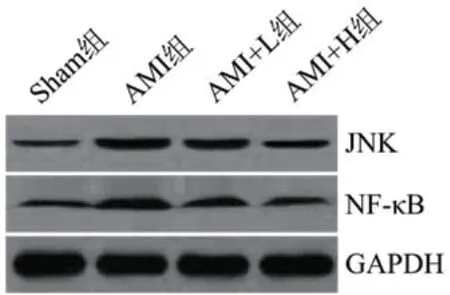
图4 Western blot检测度洛西汀对AMI大鼠心肌组织中JNK和NF-κB通路的影响
3 讨论
心血管疾病是世界人口死亡的主要原因,在我国缺血性心脏病尤其是AMI的发生率和致死、致残率逐年上升[8]。近年来,炎症在心肌梗死中的重要性已引起广泛关注。在AMI后再灌注中,会造成氧化应激反应和炎性反应,促进心肌细胞凋亡,从而永久影响心功能。临床通过介入手术或其他手术方法可进行血运重建恢复心肌灌注,但术后再灌注造成的损伤则加重促炎反应,无法预防局部缺血引起的进行性心肌纤维化[9]。在AMI后2~7 d心肌细胞出现大量的凋亡和炎性损伤,但这种凋亡是可逆的,有效抑制心肌细胞炎性损伤和凋亡对提高预后具有重要意义[10]。目前尚无针对AMI后再灌注造成的心肌细胞损伤的有效额干预手段。
度洛西汀是一种新型抗抑郁药物,具有抑制炎性反应、改善神经损伤的作用[11]。一项最新研究显示度洛西汀可改善AMI大鼠模型的心电图异常,提高心功能,并对后续的心律失常有很好的抑制作用[5]。对于冠心病患者,度洛西汀可明显抑制炎性因子[12]。本研究通过结扎的方法构建AMI模型,通过灌胃低剂量和高剂量度洛西汀进行干预,结果显示在1周后,AMI组大鼠的心功能受到显著抑制,且心脏梗死面积、心肌细胞凋亡指数显著升高。度洛西汀可剂量依赖性的减少心肌梗死面积和凋亡指数,并剂量依赖性的提高心肌功能。Toda等[13]研究显示度洛西汀可明显抑制脑缺血再灌注损伤,保护神经元,并在脑组织缺血后,抑制凋亡诱导因子的表达,保护神经元功能,缓解缺血再灌注后的损伤[14]。提示在AMI大鼠模型中,度洛西汀会剂量依赖性的抑制梗死后的心肌细胞凋亡减少梗死面积,从而提高心功能,但关于度洛西汀缓解AMI心肌细胞凋亡和促进心功能的机制需进一步研究。
为进一步分析度洛西汀缓解AMI的机制,我们检测了氧化应激水平、JNK和NF-κB信号通路以及下游炎性因子的水平。在早期急性缺血中,心肌细胞凋亡是心肌梗死的主要形式,但在梗死后2~7 d的继发性凋亡也是影响AMI预后的主要原因,改善氧化应激反应和抑制急性心肌缺血后的细胞凋亡是治疗AMI的主要策略[15]。缺血及再灌注会直接引起多种活性氧自由基升高,直接激活JNK和NF-κB信号通路,JNK和NF-κB具有转录调控作用,JNK和NF-κB会直接促进炎性基因的转录和蛋白的表达水平[16,17]。研究已经证实了JNK和NF-κB信号转导的激活会直接促进IL-6和TNF-α的转录,并促进氧化应激反应,进而诱导心肌细胞的凋亡。本次研究结果也显示AMI组的JNK和NF-κB mRNA和蛋白的水平均显著升高,且血清IL-6和TNF-α和氧化应激水平也升高,而AMI+L组和AMI+H组的JNK和NF-κB mRNA和蛋白的水平均显著低于AMI组,血清IL-6和TNF-α和氧化应激水平也低于AMI组,度洛西汀对JNK和NF-κB mRNA和蛋白的抑制作用具有剂量依赖性。研究显示5-羟色胺去甲肾上腺素再摄取抑制剂具有明显的抑制JNK及下游MAPK通路的作用[18]。在化学疗法诱导的周围神经病动物模型中,度洛西汀可显著抑制JNK通路和NF-κB转录因子的激活和核易位,从而减少炎性因子的表达[19]。Zhou等[20]研究结果显示度洛西汀会抑制NF-κB蛋白的表达。提示在AMI大鼠模型中,通过度洛西汀灌胃会明显抑制缺血及再灌注引起的JNK和NF-κB相关通路的激活,从而抑制炎性因子的表达,抑制凋亡保护心功能。
综上所述,度洛西汀可能通过抑制JNK和NF-κB通路抑制AMI大鼠心肌细胞凋亡,从而发挥保护心功能的作用。但关于度洛西汀对AMI的治疗作用和安全性仍需动物实验和临床实验分析,其调控JNK和NF-κB的机制值得深入研究。
