十二卷属花卉糯玉露组培体系建立试验初报
2021-12-09李晓王婷婷陈惠哲廖智慧于兰芳陈志军
李晓 王婷婷 陈惠哲 廖智慧 于兰芳 陈志军

摘 要 以十二卷属花卉糯玉露叶片、基部分株叶片、花序做为外植体,以MS为基本培养基,研究植物激素组合和浓度对其诱导分化、增殖培养、生根的影响,试图建立起糯玉露组培快繁体系。结果表明,最佳外植体为其花序,其诱导率最高为74%;最佳增殖培养基为MS+0.7 mg·L-16-BA+0.1 mg·L-1NAA,增殖率为650%;最适的生根培养基为MS+0.3 mg·L-16-BA+0.3 mg·L-1NAA,平均生根数为5.36条,生根率为100.00%。
关键词 十二卷属;多肉植物;组织培养;快繁体系
中图分类号:S682 文献标志码:B DOI:10.19415/j.cnki.1673-890x.2021.27.025
玉露(Hamworthia cooperi M. B. Bayer)为天门冬目阿福花科十二卷属下的中小型、多年生多肉植物[1]。糯玉露作为栽培品种,植株矮小、紧凑扁平、叶片肉质、粗短饱满、顶端半透明且窗型巨大,深受广大消费者的喜爱。糯玉露生长周期长,自交不亲和,种子繁殖困难,传统采用分株繁殖和种子繁殖,繁殖系数低、扩繁速度慢,难以满足庞大的市场需求。其他栽培品种,如“姬玉露”“冰灯玉露”“毛玉露”“帝玉露”及“宫灯玉露”等的组织培养已有报道,但是关于糯玉露的相关报道较少。
通过不同外植体的选择、不同培养阶段、不同激素的组合的研究,探索糯玉露组培与快繁体系,以满足乡村振兴和农业供给侧改革的技术需求。
1 材料与方法
1.1 实验时间、地点和材料
实验在2020年7月开始,实验地点在衡水职业技术学院花艺实训室。供试材料来自衡水市邓庄农业科技示范园温室。选择株型好、无病虫害、生长健壮具有花序的糯玉露植株为母本,选取糯玉露叶片、基部分株叶片、花序3种器官组织作为外植体进行实验。
1.2 实验方法
1.2.1 培养材料的选择与准备
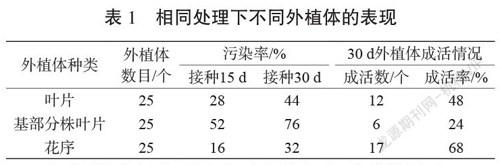
将糯玉露整个植株从基部小心切下,在流水下冲洗20 min,无菌操作下,将叶片、基部分株叶片和花序从植株上切下,用75%酒精浸泡20 s,再用0.1%HgCl2进行10 min振荡消毒处理,并在无菌培养皿中分割成适宜接种的小块,然后用无菌水冲洗5次,将3种组织分别接种于MS培养基上,每个组织接种25瓶,每瓶1个外植体。接种后15 d统计外植体的污染率和成活率,分析外植体的最优选择。
1.2.2 愈伤组织诱导培养
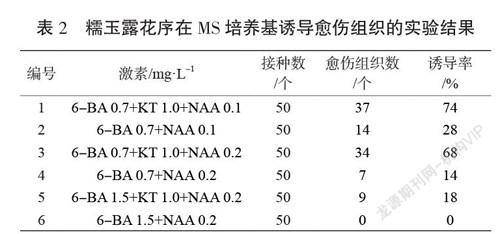
选取未污染的糯玉露愈伤组织,接种至1~6号培养基中(见表2),研究细胞分裂素(6-BA,KT)和生长素NAA对糯玉露诱导愈伤组织的影响。每个处理设置50个外植体开展实验。接种15 d后观察愈伤组织诱导情况,统计愈伤组织数目。
1.2.3 增殖培养
糯玉露花序在不同激素组合的培养基上进行愈伤组织诱导培养,15 d表现为花序一端开始膨大为愈伤组织;愈伤组织在形成后,继续在原培养基中培养,20 d开始,表面上方或周围出现绿色芽点,之后在突起处形成1~2个叶形不定芽,45 d时长成可分为3~10枝的丛生小苗。将诱导形成的不定芽取出并分割成单个芽苗,转入7~12号6种培养基上进行增殖培养,分别统计数量。
1.2.4 生根培养
将增殖培养的丛生芽进行分割,选取较健壮的芽苗插入13~21号9种培养基中,置光照培养架上培养30 d,观察不定根的生长情况。
1.2.5 培養条件及培养基
培养室条件为:温度25(±2) ℃,湿度50%~
60%,照度2 500 lx,每天光照时间12 h[2];培养基除特别注明外均为MS培养基,蔗糖0.3%,琼脂0.8%,pH值5.8±0.1。
2 结果与分析
2.1 糯玉露组培体系外植体的选择
由表1可知,在接种15 d后,3种外植体的培养物表现差异很大。其中以花序作为外植体的培养物的污染率最低;而基部分株叶片的灭菌效果最差,容易污染;叶片作为外植体表现居中,其中有2块叶片外植体未染菌,但是枯萎死亡,可能是由于糯玉露叶片本身水分含量过多导致的[3]。综合考虑,在建立糯玉露组培快繁体系时,以其花序作为外植体是相对最优选择,且不推荐选用基部分株叶片作为快繁外植体。
2.2 不同激素组合及浓度对愈伤组织形成的影响
糯玉露花序愈伤组织在不同激素组合的培养基上进行愈伤组织诱导培养,15 d表现为花序一端开始膨大,形成黄绿色不规则疏松突起;30 d天左右形成大块愈伤组织。从表2可知,糯玉露花序在6种MS培养基中的5种上都产生了愈伤组织,在MS+1.5 mg·L-16-BA+0.2 mg·L-1NAA培养基上,所有的组织均褐变并死亡,没有产生足够强壮的愈伤组织。在其他5种组合中,1号培养基表现得最好,愈伤组织诱导率达到74%。所以,MS+0.7 mg·L-16-BA+1.0 mg·L-1KT+0.1 mg·L-1NAA是糯玉露愈伤组织诱导的最适培养基。
2.3 不同激素组合及浓度对不定芽增殖的影响
从表3可知6-BA对愈伤组织的刺激作用明显,添加了6-BA的培养基诱导出了更多的丛生芽,同时KT对丛生芽的增殖有抑制作用。从迅速扩大种植规模的角度考虑,MS+0.7 mg·L-16-BA+0.1 mg·L-1NAA是糯玉露花葶愈伤组织分化丛生芽的相对最优培养基[4]。
2.4 不同激素浓度对糯玉露生根的影响
将增殖培养产生的丛生苗分割,转接到生根培养基上(13~21号,见表4),在15 d后观察发现有根萌生,在30 d进行生根数目和植株状态情况统计,当培养基为MS+0.3 mg·L-16-BA+0.3 mg·L-1NAA时,生根率最高,达100%,是最佳的生根培养基。在生根苗长到5片叶子以上,叶片肥厚,根系粗壮时就可以揭开封口膜,在组培室进行炼苗培养。
2.5 驯化移栽
在揭开封口膜5 d后,取出植株,在流动的自来水下洗净琼脂培养基。将洗净的植株放在铺有灭菌干燥报纸的搪瓷盘上,放在通风阴凉处放置12 h,然后栽种在灭菌好的基质中(蛭石和草炭体积比1∶3)[5]。为防止烂根,应避免积水,在保持基质湿润的前提下,见干见湿,不干不浇。为防止糯玉露幼苗晒伤,应将植株放置在受控光照环境下,避免阳光直射。每月施1次薄肥,满3个月即可达到商品标准,总体驯化成活率在90%以上。
3 结论与讨论
为探索外植体的选择,在叶片、基部分株叶片和花序中开展了外植体选择实验,结果表明,花序作为外植体进行组织培养,污染率最低,成活率最高。植物激素是植物细胞脱分化和再分化的关键因子,在愈伤诱导、不定芽分化、增殖和生根中,本实验设置了多种激素组合和不同浓度,探索出了一整套糯玉露的组培快繁体系。
综上所述,结合前人研究成果,研究利用组织培养方法成功获得了糯玉露的组培苗,建立了组培快繁生产程序,也为十二卷属多肉植物的组培苗规模化生产提供了参考,具有较好应用前景。
参考文献:
[1] 郭生虎,朱永兴,关雅静.百合科十二卷属玉露的组培快繁关键技术研究[J].中国农学通报,2016,32(34):85-89.
[2] 郜李彬,曹征宇,顾韵莉,等.玉露增殖培养基配方筛选及光照时间研究[J].上海农业科技,2017(6):109.
[3] 陈红刚,高素芳,杨韬.玉露的组织培养与快速扩繁[J].北方园艺,2011(12):101-102.
[4] 高越,王娅欣,孙涛,等.毛玉露的组织培养与快速繁殖[J].生物学通报,2010,45(6):54-55.
[5] 张景新,刘艳军,杨静慧,等.激素对冰灯玉露不定芽和不定根分化的影响[J].天津农林科技,2016(4):4-6.
(责任编辑:赵中正)
收稿日期:2021-08-13
基金项目:衡水市科技计划项目(2019014045Z)。
作者简介:李晓(1986—),男,河北桃城人,硕士,讲师,研究方向为生物多样性。E-mail:359617298@qq.com。
