携带NDV HN 基因的减毒鼠伤寒沙门菌Ⅲ型分泌系统构建及其生物学特性分析
2021-12-03宋敏杰周小双石胜丽朱文文田文静程相朝
宋敏杰,周小双,石胜丽,朱文文,田文静,程相朝,郁 川,
(1. 洛阳职业技术学院宠物与人类健康工程技术中心,河南洛阳 471900;2. 河南科技大学动物科技学院/洛阳市活载体生物材料与动物疫病防控重点实验室,河南洛阳 471023;3. 新乡市动物卫生监督所,河南新乡 453000)
鸡新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的一种对家禽业发展危害严重的传染病[1],其防治一直受到业界的广泛关注。近年来,被发现的NDV 基因型种类越来越多,ND 在我国的流行形势也越来越严重,给我国家禽业养殖造成了严重的经济损失[2]。NDV 为副黏病毒科禽腮腺炎病毒属成员,为有囊膜的单股负链RNA 病毒,其基因组编码6种病毒结构蛋白[3],分别为核衣壳蛋白(Nucleocapsid protein,NP)、磷酸化蛋白(Phsphorylated protein,P)、基质蛋白(Matrix protein,M)、融合蛋白(Fusion protein,F)、血凝素-神经氨酸酶蛋白(Hemagglutinin‑neuraminidase protein,HN)及依赖RNA 的RNA 聚合酶(L)。HN 蛋白是NDV 粒子重要的免疫原性蛋白和毒力因子,能够诱导机体产生抗体,使之具有宿主保护性[4‑5]。因此,NDV HN蛋白是目前研究新城疫DNA疫苗的首要选择,为ND的防控及新型疫苗的研制提供了新思路。
减毒活疫苗因其具有很好的安全性,是良好的载体和天然免疫佐剂,备受医学与兽医学的广泛关注[6‑8]。鼠伤寒沙门菌为胞内侵袭性菌,通过基因工程方法减毒后不影响其侵袭能力,携带质粒DNA 的细菌在抗原递呈细胞内发生溶解或以宿主吞噬小体进入胞质,并将DNA 释放到细胞核,从而使抗原基因在体内进行表达,并诱导相应的细胞免疫和体液免疫。减毒沙门菌作为活疫苗本身具有免疫佐剂的作用,通过口服可诱导黏膜免疫[9‑10]。沙门菌外膜蛋白E(Salmonellaouter protein E,SopE)是Ⅲ型分泌系统的功能蛋白,能高效运输外源蛋白,促使沙门菌内化到宿主细胞中[11]。以SopE 蛋白为基础构建的减毒沙门菌Ⅲ型分泌系统(Type Ⅲsecretion system,T3SS)能够有效递呈外源抗原,该重组菌株有潜力作为安全、稳定、高效表达外源基因的口服重组活疫苗载体[12]。基于Ⅲ型分泌蛋白SopE 的这一特点,河南科技大学动物科技学院/洛阳市活载体生物材料与动物疫病防控重点实验室构建了能稳定携带外源抗原的新型减毒鼠伤寒沙门菌Ⅲ型分泌表达系统ΔcrpΔasdSL1344(pYA-sopENt100),并将egfp标记基因克隆入SopE基因下游,结果显示,其能有效递呈增强绿色荧光蛋白(Enhanced green fluorescent protein,EGFP)[13]。
为了探索以减毒沙门菌为载体的新城疫口服疫苗,利用减毒鼠伤寒沙门菌Ⅲ型分泌系统ΔcrpΔasdSL1344(pYA3493-sopENt100),构建能稳定携带NDVHN基因的重组菌ΔcrpΔasdSL1344(pYA3493-sopENt100-HN),并研究其生物学特性,为进一步研究其免疫活性奠定基础。
1 材料和方法
1.1 菌株、质粒和细菌
质粒(pMD19-T)、大肠杆菌χ6097、减毒鼠伤寒沙门菌ΔcrpΔasdSL1344、减毒鼠伤寒沙门菌Ⅲ型分泌系统ΔcrpΔasdSL1344(pYA3493-sopENt100)均由河南科技大学动物科技学院/洛阳市活载体生物材料与动物疫病防控重点实验室保存。
1.2 培养基和试剂
胰蛋白胨、酵母浸出物、琼脂糖、琼脂粉、NaCl均购自生工生物(上海)股份有限公司;Taq聚合酶、Marker、dNTP、限制性内切酶BamH Ⅰ、Hind Ⅲ均购自Takara 公司;质粒提取试剂盒、胶回收试剂盒购自AxyPrep公司。
1.3 引物
根据GenBank 已经登录的NDV La Sota 株的HN基因序列(AO3663.1),利用Primer premier 5.0软件设计引物序列,并送至通用生物系统(安徽)有限公司合成。HN基因特异性引物序列:上游引物5′-CTGGATCCATGGACCGCGCCGTTAGC-3′,下划线碱基为BamH Ⅰ酶切位点;下游引物5′-CGAAGCTTCTAGCCAGACCTGGCTTC-3′,下划线碱基为Hind Ⅲ酶切位点。
1.4 重组质粒pMD19-T-HN的构建与鉴定
以pMD19-T 为载体,利用HN引物进行PCR 扩增,将反应完成的PCR反应液进行琼脂糖凝胶电泳,回收目的条带。将回收所得的目的片段与pMD19-T载体相连接并转化,最后挑取单菌落质粒进行Hind Ⅲ和BamH Ⅰ双酶切鉴定。
1.5 表达载体pYA3493-sopENt100-HN 的构建与鉴定
将鉴定正确的pMD19-T-HN和pYA3493-sopENt100分别用Hind Ⅲ和BamH Ⅰ双酶切,电泳回收目的片段并进行连接,然后将其转化至大肠杆菌χ6097,挑取单菌落进行PCR和酶切鉴定。
1.6 重组菌株Δ crp Δ asd SL1344(pYA3493-sopENt100-HN)的构建与鉴定
将鉴定正确的阳性重组质粒pYA3493-sopENt100-HN电转化至减毒鼠伤寒沙门菌ΔcrpΔasdSL1344,挑单菌落进行PCR和酶切鉴定。
1.7 重组菌株生物学特性研究
1.7.1 生长特性分析 挑菌株Δcrp ΔasdSL1344(pYA3493-sopENt100-HN)、ΔcrpΔasdSL1344、SL1344和ΔcrpΔasdSL1344(pYA3493-sopENt100)单菌落过夜培养,用PBS 稀释至合适稀释度,取100 μL 涂板计数,推算母液浓度。将4 种菌株母液均稀释至1×106cfu/mL 后进行转接,37 ℃培养,每隔1 h 取菌液测OD600,并绘制生长曲线。
1.7.2 遗传稳定性分析 将重组菌株Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)接种于LB 固体平板,连续传代50 代,挑第10、20、30、40、50 代单菌落进行HN基因PCR鉴定,分析其遗传稳定性。
1.7.3 表达特性分析 将重组菌株感染CEF 细胞[14],于感染后48 h 收集蛋白质,Western blot 分析HN蛋白在体外CEF细胞中的表达情况。
1.7.4 毒力特性分析 挑重组菌株Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)、ΔcrpΔasdSL1344、SL1344 和ΔcrpΔasdSL1344(pYA3493-sopENt100)单菌落过夜培养,PBS 稀释至合适稀释度后取100 μL 涂板计数,由此推算母液的浓度。将4 种菌株母液均稀释至合适浓度后,每只鸡口服200 μL进行免疫试验,每组10只,另设PBS 对照组,统计30 d内鸡只的存活数据,运用Bliss生物软件计算其LD50值。
2 结果与分析
2.1 重组质粒pMD19-T-HN的鉴定
挑取pMD19-T-HN质粒转化的菌株单菌落,提取质粒,进行PCR 和酶切鉴定。PCR 检测结果显示,重组质粒能成功扩增出1 700 bp 左右的目的片段(图1A);用限制性内切酶Hind Ⅲ和BamH Ⅰ双酶切后可见2 600 bp 左右的载体片段和1 700 bp 左右的目的片段(图1B)。均与预期片段大小一致,说明重组质粒pMD19-T-HN构建成功。
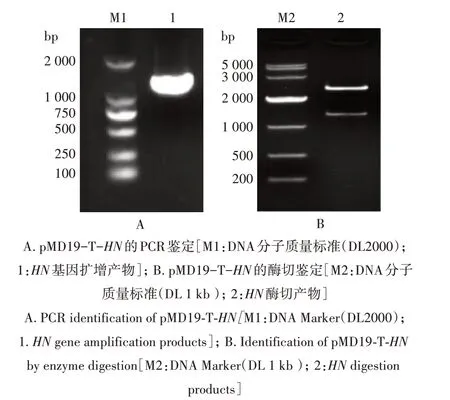
图1 重组质粒PMD19-T-HN的鉴定Fig.1 Identification of the recombinant plasmid pMD19-T-HN
2.2 重组质粒pYA3493-sopENt100-HN的鉴定
挑取转化菌株单菌落提质粒,进行PCR 和酶切鉴定。PCR 检测结果显示,重组质粒能成功扩增出1 700 bp 左右的目的片段(图2A),限制性内切酶Hind Ⅲ和BamH Ⅰ对重组载体pYA3493-sopENt100-HN进行双酶切后可见3 400 bp 左右的pYA3493-sopENt100载体条带和1 700 bp 左右的HN目的条带(图2B),与预期片段大小一致,说明重组质粒pYA3493-sopENt100-HN的构建成功。
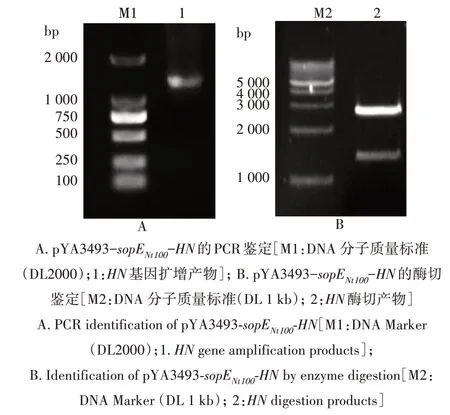
图2 重组质粒pYA3493-sopENt100-HN的鉴定Fig.2 Identification of the recombinant plasmid pYA3493-sopENt100-HN
2.3 重组菌株Δ crp Δ asd SL1344(pYA3493-sopENt100-HN)的鉴定
挑取重组菌株Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)单菌落提质粒,进行PCR 和酶切鉴定。PCR 扩增结果显示,重组质粒能成功扩增出1 700 bp 左右的目的片段(图3A),限制性内切酶Hind Ⅲ和BamH Ⅰ双酶切后可见3 400 bp 左右的pYA3493-sopENt100载体片段和1 700 bp 左右的目的片段(图3B)。说明重组质粒pYA3493-sopENt100-HN成功导入减毒鼠伤寒沙门菌ΔcrpΔasdSL1344。
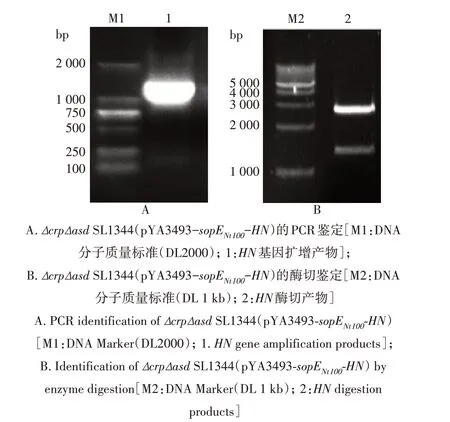
图3 重组菌株ΔcrpΔasd SL1344(pYA3493-sopENt100-HN)的鉴定Fig.3 Identification of the recombinant strain ΔcrpΔasd SL1344(pYA3493-sopENt100-HN)
2.4 重组菌株生物学特性分析
2.4.1 生长特性 将重组菌株Δ crp Δ asdSL1344(pYA3493-sopENt100-HN) 、Δ crp Δ asdSL1344(PYA3493)、SL1344 和ΔcrpΔasdSL1344(pYA3493-sopENt100)稀释至1×106cfu/mL后转接于培养基,37 ℃培养12 h,每隔1 h测菌液的OD600值,并绘制生长曲线(图4)。结果显示,重组菌Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)的生长趋势与Δ crp Δ asdSL1344(pYA3493-sopENt100)和Δ crp Δ asdSL1344 相似,与SL1344有明显差异。
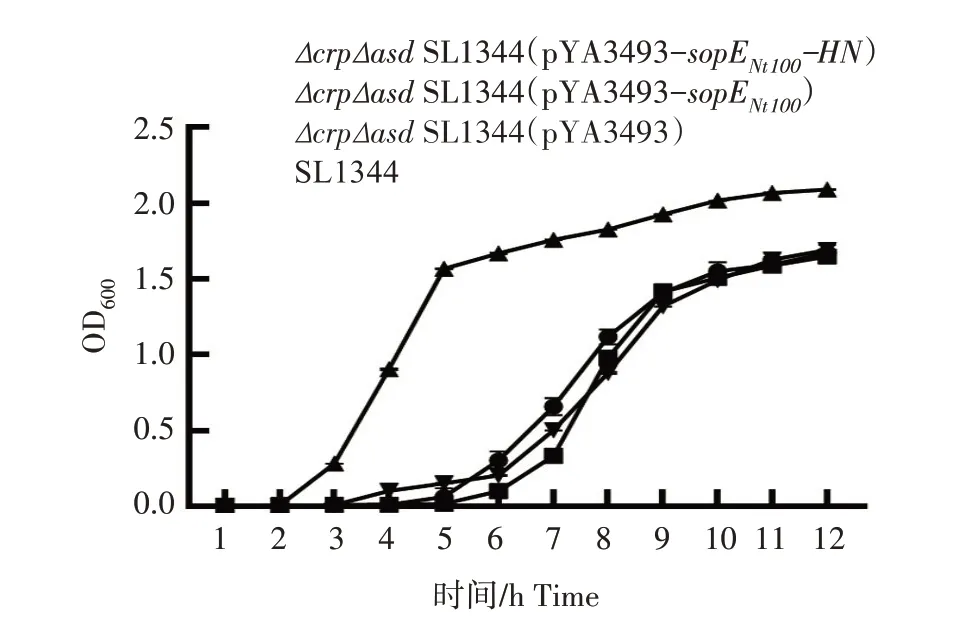
图4 重组菌株ΔcrpΔasd SL1344(pYA3493-sopENt100-HN)生长曲线(OD600)Fig.4 The growth curve of the recombinant strain ΔcrpΔasd SL1344(pYA3493-sopENt100-HN)based on OD600
2.4.2 稳定特性 重组菌株Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)连续传代50代后,挑第10、20、30、40、50 代进行PCR 鉴定,电泳可见其均能扩增出1 700 bp左右的HN基因片段,表明重组减毒鼠伤寒沙门菌Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)能够稳定遗传HN基因(图5)。
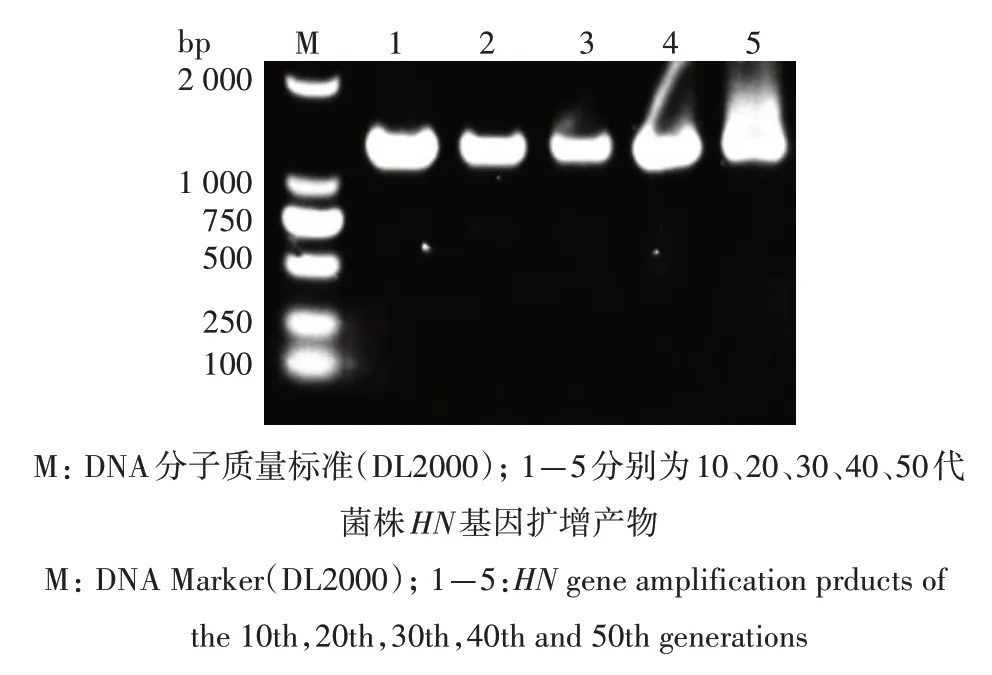
图5 重组菌株ΔcrpΔasd SL1344(pYA3493-sopENt100-HN)稳定性检测Fig.5 The stability test of the recombinant strain ΔcrpΔasd SL1344(pYA3493-sopENt100-HN)
2.4.3 表达特性 重组菌Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)感染CEF细胞48 h后,收集蛋白质做Western blot鉴定。结果显示,重组菌株ΔcrpΔasdSL1344(pYA3493-sopENt100-HN)感染CEF 细胞后,在细胞内成功表达了sopENt100-HN蛋白,大小约为73 ku(图6)。表明减毒鼠伤寒沙门菌Ⅲ型分泌系统能够有效递呈HN蛋白,并诱导其在细胞内表达。
2.4.4 毒力特性 将重组菌株Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)、ΔcrpΔasdSL1344、SL1344和ΔcrpΔasdSL1344(pYA3493-sopENt100)稀释至合适浓度后,每只鸡口服200 μL 进行免疫,每组10 只,统计存活数据,利用Bliss生物软件计算LD50(表1)。从表1 可以看出,口服感染重组菌ΔcrpΔasdSL1344(pYA3493-sopENt100-HN)的LD50是2.08×1010cfu,感染互补菌Δ crp Δ asdSL1344(pYA3493-sopENt100)的LD50是2.28×1010cfu,感染缺失菌ΔcrpΔasdSL1344 的LD50是2.53×1010cfu,感染亲本菌株SL1344 的LD50是2.87×105cfu。可见,重组菌Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)的LD50与ΔcrpΔasdSL1344(pYA3493-sopENt100)和ΔcrpΔasdSL1344 相差不大,与亲本菌株SL1344差异较大。
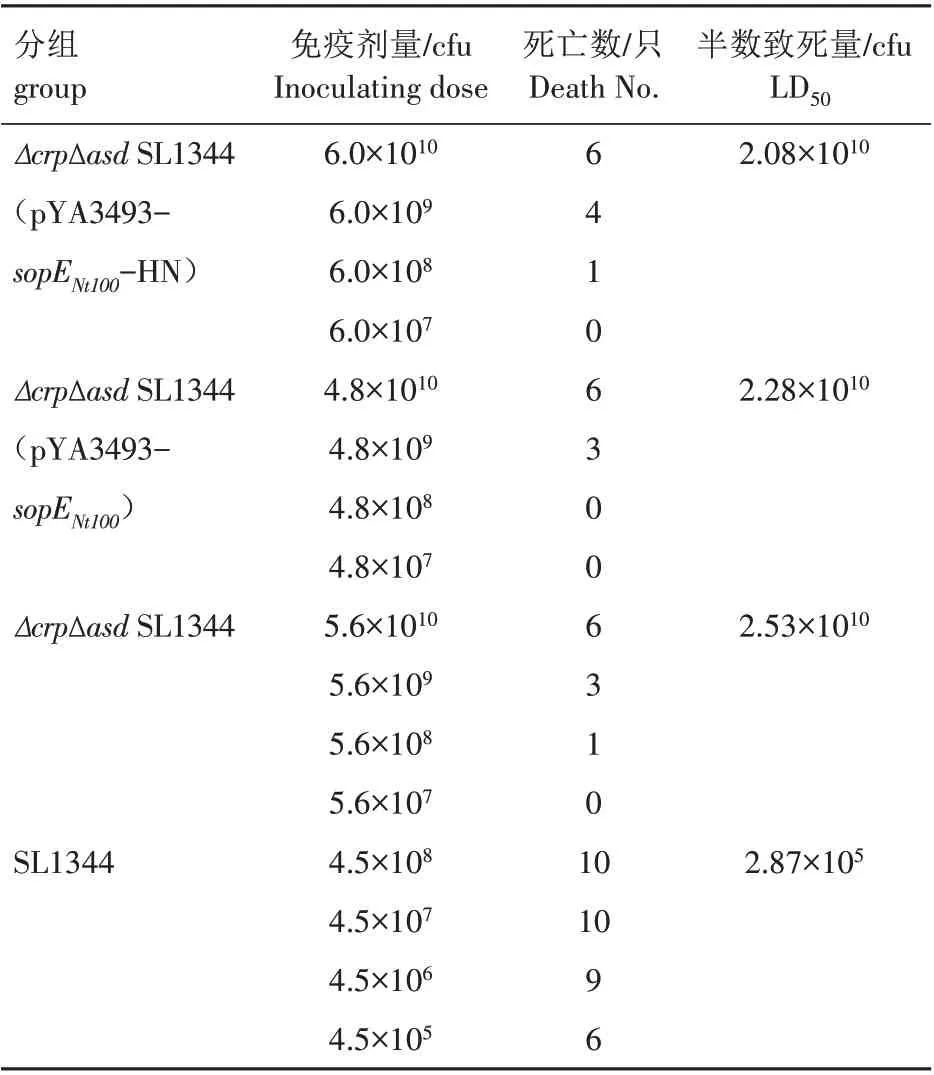
表1 毒力特性分析Tab.1 Analysis of virulence characteristics
3 结论与讨论
NDV 具有很强的传染性和致病性,严重阻碍我国家禽养殖业经济发展[15‑16]。随着基因工程技术和分子克隆技术的快速发展,研究者在NDV疫苗免疫方面的研究已取得了一定的进展。HN 蛋白是NDV传染性和致病性的重要蛋白,被认为是诱导宿主保护性免疫反应和刺激抗体产生的主要因子。研究发现,HN基因在真核表达载体中具有良好的稳定性[17]。李旭锋等[18]研究发现,HN 重组蛋白在毕赤酵母中能稳定表达,且纯化产物纯度较高、活性良好,具有糖基化修饰,NDV HN 蛋白具有很好的免疫原性。减毒沙门菌载体活疫苗相关研究显示,减毒沙门菌经口服免疫后可以定居在肠道相关淋巴组织,刺激抗原提呈细胞活化增殖,从而快速启动机体产生特异性黏膜免疫、体液及细胞免疫应答,在细菌[19]、病毒[20]和寄生虫病原体[21‑22]中抗原的传递和重组活载体疫苗的研究中,显示出潜在的应用价值。
本研究采用的减毒鼠伤寒沙门菌Δcrp ΔasdSL344,在crp基因缺失的情况下,失去了腺苷酸环化酶受体蛋白的编码能力,故而失去了碳水化合物等的代谢能力,该基因缺失使沙门菌毒力显著下降,在活疫苗的应用中既安全又具有免疫原性[23]。在asd基因缺失的情况下,失去了编码DAP 生物合成途径中的必需酶天冬氨酸β-半乳糖脱氢酶的能力,asd突变株若失去外源DAP,会由于不能形成完好的细胞壁而发生溶菌并引起死亡[24]。原核表达载体pYA3493 是一种含asd基因的互补质粒,含有asd+基因的互补型菌可以在DAP-宿主中生存,故可大幅度提高重组质粒的稳定性[25]。本研究发现,连续传50 代后,经PCR 鉴定,可扩增出1 700 bp 左右的HN基因片段,表明重组减毒鼠伤寒沙门菌ΔcrpΔasdSL1344(pYA3493-sopENt100-HN)能够稳定遗传HN基因,与贾艳艳等[26]报道的减毒鼠伤寒沙门菌ΔcrpΔcyaΔasdSL1344(pYA-HN-VP2)的结果一致。
以SopE 蛋白为基础的减毒鼠伤寒沙门菌Ⅲ型分泌系统逐渐引起研究者的关注,CHEN 等[12]利用减毒鼠伤寒沙门菌VNP20009 株表达日本血吸虫Sj23LHDGST 二价抗原,并检测其对血吸虫的保护作用,结果表明,其构建的减毒鼠伤寒沙门菌Ⅲ型分泌系统VNP20009[nirB-sopE(1-104)-Sj23LHDGST],能够分泌性表达Sj23LHDGST 并传递到巨噬细胞的胞浆中,显著增加机体IL-12 和IFN-γ 的产生量,对日本血吸虫的感染具有一定的免疫保护作用。本研究利用减毒鼠伤寒沙门菌Ⅲ型分泌系统以及asd平衡致死系统,成功构建了携带NDVHN基因的减毒鼠伤寒沙门菌Ⅲ型分泌系统ΔcrpΔasdSL1344(pYA3493-sopENt100-HN)。对重组菌株的生物学特性进行分析发现,重组菌的生长趋势与互补菌ΔcrpΔasdSL1344(pYA3493-sopENt100)和缺失菌Δ crpΔasdSL1344 相似,与亲本菌株SL1344 相比生长速度明显减慢。此外,重组菌的毒力与互补菌和缺失菌相差不大,与亲本菌株SL1344差异较大。其生长特性和毒力特性与石胜丽等[27]报道的鼠伤寒沙门菌Ⅲ型分泌系统Δ crp Δ asdSL1344(pYA3493-sopENt100)相一致,说明HN基因的表达并没有影响重组菌株的生物学特性。值得注意的是,重组菌株感染CEF 细胞后,可表达约73 ku 的sopENt100-HN 蛋白,证明减毒鼠伤寒沙门菌Ⅲ型分泌系统能有效向CEF 细胞递呈NDVHN基因,并在该细胞内有效表达。
本研究结果表明,重组菌Δ crp Δ asdSL1344(pYA3493-sopENt100-HN)生长稳定,能够有效递呈HN基因,有潜力作为NDV 口服重组活疫苗候选菌株,可进一步探究其免疫学特性,为开发安全、稳定、高效的NDV活载体疫苗奠定基础。
