基于生物膜干涉技术检测PDL1抗体与PDL1抗原的亲和力
2021-12-01胡妍陈玲
胡妍,陈玲
福建医科大学免疫治疗研究院,福州350122
目前免疫疗法广泛用于癌症治疗,免疫疗法能直接作用于肿瘤微环境,具有低毒、不良反应小、对人体伤害少等优势,且利于患者预后[1]。在肿瘤细胞表面,有大量程序性死亡配体1(programmed death ligand-1,PD-L1)蛋白表达,其能与T细胞表面的程序性死亡因子1(programmed death 1,PD-1)蛋白结合,使得肿瘤细胞逃避T细胞杀伤[2-3]。使用PD-L1抗体能阻断PD-1与PDL1结合,调节T细胞活性,治疗肿瘤效果明显[4],其完整的单克隆抗体是由2条重链和2条轻链组成,这种结构的抗体最先应于肿瘤的治疗。随着分子生物学技术的发展和临床应用的需求,研发出了各种结构的抗体,如单链抗体、双价抗体、串联抗体、双特异性抗体等[5]。单链抗体(single-chain variable fragment,scFv)是由抗体重链的可变区和轻链的可变区在一段肽段连接下构成的小分子,是具有抗体活性的最小功能结构。scFv由于分子质量小(约25 kDa)、穿透力强,在靶向治疗、影像诊断、细胞内免疫和生物检测等方面具有重要作用。在靶向治疗方面,可将药物和毒素与scFv链接,利用抗原抗体特异性结合特点,定位于靶细胞,对靶细胞进行特异性杀伤;在影像诊断方面,scFv由于分子质量小,具有体内清除率高、对身体伤害小等优势[6]。双价抗体(diabody)是scFv的二聚体,分子量小(50~60 kD),与scFv一样,具有体内半衰期短、组织渗透力强、体内清除率高等优点,diabody与抗原结合比单价scFv更敏感,且在结构和功能上更接近亲本抗体[7]。双特异性抗体(bispecific antibodies,BsAbs)结构包含2种抗体的可变区,具有2个抗原结合表位和双重功能[8-9],BsAbs可将效应细胞直接靶向肿瘤细胞,增强其细胞毒性,提高抗体选择性和功能性,共刺激或抑制受体,避免免疫逃逸机制进而改善治疗效果[10]。BsAbs抗体根据结构中是否带有Fc片段分为IgG-like BsAb和non-IgG-like BsAb两类。IgG-like BsAb具有Fc介导的效应功能,如诱导抗体依赖细胞介导的细胞毒作用(antibody-dependentcell-mediatedcytotoxicity,ADCC)或补体依赖的细胞毒作用(complement dependent cytotoxicity,CDC)。这类抗体相对分子量较大,Fc片段有助于抗体后期的纯化,并提高其溶解性、稳定性。此外,Fc部分可与受体FcRn结合,增加抗体血清半衰期。non-IgG-like BsAb因缺乏Fc片段,仅通过抗原结合力发挥治疗作用,具有免疫原性低、易于生产、分子量小、肿瘤组织渗透性高、治疗效果好等特点。目前,已存在几种相对成熟的双特异性抗体技术平台,可加快BsAbs的发展[11−12]。
KD测定是抗体研发过程中的一项重要质控指标。KD测定最经典的方法为酶联免疫法(enzyme-linked immunosorbent assay,ELISA),但ELISA方法操作费时费力,使用生物膜层干涉(biofilm layer interference,BLI)技术同样能提供较为可靠的KD[13],分别使用ELISA和BLI两种方法测定第1个研制出来的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)抗体与新型冠状病毒(severe acute respiratory syndrome corona virus 2,SARS-CoV-2)表面的S蛋白之间的亲和力,两种方法检测结果一致[14]。BLI技术是基于光干涉信号实现对生物分子快速检测的非标记分析检测技术[15],当生物分子结合到光纤材质的生物传感器末端会形成一层生物膜,当传感器末端的生物分子与待检测物结合时会引起传感器末端分子量的改变,从而导致生物膜厚度的改变。光通过传感器的生物膜层后发生透射和反射形成干涉光波,生物膜厚度的变化导致干涉光波发生相对位移。生物分子结合前后的干涉光波被光谱仪检测到,形成干涉光谱,通过结合前后光谱位移的变化对待检测分子进行分析[16]。BLI技术能对亲和力进行实时、无标记的分析,且这种检测技术结果准确、灵敏度高[17−18]。
通过选用SA生物传感器偶联biotin标记的PDL1抗原,再分别与4类PDL1抗体结合,并计算相应的KD。4类抗体在分子设计、细胞培养、缓冲液配比等实验条件不同时,可能会导致KD值不同,因此测量KD时,对SA传感器需求量较大,而SA传感器价格昂贵,本研究通过选用缓冲液再生传感器,并对再生后的传感器所测数据的稳定性、重复性进行考察,以确定传感器再生条件,并继续利用再生后的传感器测量抗原抗体之间的KD,旨在为SA传感器的重复利用提供再生方法和再生依据,以提高SA传感器的使用效率,节约检测成本。
1 材料与方法
1.1 材料
1.1.1 仪器Octet Red 96分子相互作用分析仪购自美国Pall公司;nanodrop 2000超微量分光光度计购自美国Thermo Scientific公司;SG 23手持式pH测量仪购自瑞士梅特勒−托利多公司;Practum 124-1CN电子分析天平购自德国赛多利斯公司;SA生物传感器购自Pall公司。
1.1.2 材料与试剂ScFv、diabody(一个PD-L1结合位点)、完整单抗、BsAb(PD-L1、TGFbeta 1两个抗原结合位点);PD-L1蛋白、5个批次的双价单链抗体DA200(2个PD-L1结合位点)均由本实验室提供,纯度经超高效液相色谱仪检测,纯度均大于98%;生物素(EZ-Link Sulfo-NHS-LC-LC-Biotin)、脱盐柱购于Thermo Scientific公司;96孔板购于Greiner Bio-One公司;磷酸盐缓冲溶液购于Corning公司。甘氨酸、吐温-20、蔗糖购于Sigma公司;盐酸为国产分析纯,实验用水为Milli-pore超纯水。
PBST:取100 μL吐温-20溶液加至500 mL PBS缓冲液中,混匀,用于预湿或中和传感器;再生液(10 mmol·L−1甘氨酸,pH 1.7):称取75 mg甘氨酸,加水溶解并定容至100 mL,滴加盐酸将溶液pH调至1.7,用于再生传感器。
1.2 方法
1.2.1 biotin-PD-L1的 制 备EZ-Link Sulfo-NHSLC-LC-Biotin通过其氨基基团,能有效与蛋白结合。将 现 配 的10 mmol·L−1的biotin溶 液 加 至PD-L1中,两者按照摩尔比3∶1的比例进行结合,冰上反应0.5 h,反应结束后使用脱盐柱去除游离的biotin,得到biotin化的PD-L1蛋白,使用nanodrop对biotin-PD-L1进行浓度测定,得到的biotin-PD-L1置于4℃冰箱保存。
1.2.2 PD-L1抗体与PD-L1抗原亲和力常数的测定选用SA生物传感器与biotin-PD-L1偶联,再利用Octet Red 96分子相互作用分析仪,依次检测抗原与4类PD-L1抗体的KD值。每次检测时,取8根SA生物传感器置于传感器盘上,于PBST缓冲液中预湿10 min,将biotin-PD-L1蛋白用PBST溶液稀释至20 μg·mL−1,将配制的50 nmol·L−1抗体溶液用PBST进行倍半稀释,形成7个浓度梯度的抗体溶液,最后将biotin-PD-L1蛋白、梯度稀释的抗体、缓冲液和中和液按照表1的设置加入样品板中,样品或溶液量为200 μL·孔−1,检测温度为30℃,样品盘转速400 r·min−1,固定好样品板和传感器盘后,按照表2设置的程序运行。抗体类别不同时选用新的传感器进行实验。
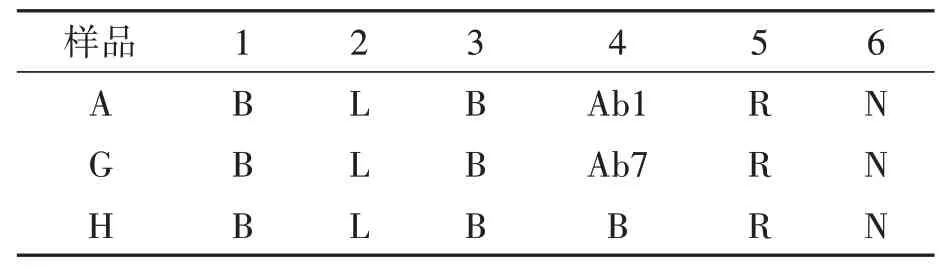
表1 样品盘加样设置Table 1 Setting of adding samples to sample tray

表2 仪器运行程序设置Table 2 Settting of instrument operation program
1.2.3 再生后的传感器测定KD值的实验步骤考察将使用后的传感器按照设定程序进行再生,即在再生液中浸泡5 s,转至中和液中浸泡5 s,再生、中和两个步骤循环重复3次。再生后的传感器按照1.2.2的方法对样品进行亲和力测定,测定结束后按照再生程序再生一次传感器,只进行平衡、结合、解离步骤,对样品进行亲和力测定,以考察再生后的传感器测定KD值是否需要重新上样。
1.2.4 再生后的传感器重复性考察将再生后的传感器按照考察确定后的实验方法对原样品进行亲和力测定,重复测3次,计算重复3次试验KD值的相对标准偏差(relative standard deviation,RSD),然后将再生传感器依次对4类抗体进行测定,比较同一传感器测不同抗体KD值的RSD。取1列传感器按照1.2.2的方法,对5个批次的DA200抗体上清液进行亲和力测试,计算5次结果 决 定 系 数(coefficient of determination,R2)的RSD值。
1.2.5 再生后的传感器稳定性考察将再生的传感器浸泡于20%蔗糖溶液中,5 min后将传感器37℃烘干过夜,再干燥密封保存。1个月后,按照考察后的实验方法,再生后传感器测定抗原抗体的KD值,并与1个月前重复3次所测KD值进行比较,计算RSD值,考察传感器稳定性。
2 结果与分析
2.1 PD-L1抗原与4类PD-L1抗体亲和力
Octet Red 96分子相互作用分析仪能实时检测PD-L1抗原与PD-L1抗体之间的相互作用。如图1所示,Octet Red 96检测PD-L1抗原与scFv抗体亲和力的各个步骤,图1中的上样、清洗步骤表明,biotin-PD-L1能与SA传感器快速结合,在清洗液中并未出现结合信号降低的现象,说明biotin-PD-L1能牢固地结合于SA传感器上。从结合、解离步骤可观察到抗原抗体结合、解离的动态全过程,当偶联了抗原的传感器与抗体结合时,抗体浓度越高,结合高度也越高,另外3列传感器检测其他三类抗体的全过程与图1类似。通过浓度梯度的抗体结合、解离曲线即可计算出KD值,由表3可知,完整单抗、BS4Ab与抗原的KD值在相同范围,KD值达到10−10mol·L−1,scFv、diabody这两种抗体的KD值接近,KD值为10−9mol·L−1,完整单抗和双特异性抗体与抗原结合能力大于其他两类。

图1 传感器检测PD-L1抗原与scFv抗体亲和力的各个步骤Fig.1 Each step of detecting the affinity of PD-L1 antigen and scFv antibody by sensor

表3 PD-L1抗原与4类PD-L1抗体亲和力Table 3 PD-L1 affinity and four classes of PD-L1 antibodies
2.2 再生后的传感器再次测KD值
SA传感器与biotin-PD-L1快速、稳定结合,本研究通过是否需要再次上样步骤,以考察再生液对SA-biotin之间非共价结合的影响(图2A)。初次结合scFv传感器再生后重新上样测分子间相互作用时的结合、解离过程。重新上样后,不同浓度的抗体均能与PD-L1抗原结合,根据结合、解离曲线能计算出KD值;初始结合scFv传感器再生后不经过上样步骤测分子间相互作用时的结合、解离过程,SA传感器上的结合高度为0~0.03 nm,说明不同浓度的抗体不能与PD-L1抗原结合,且曲线拟合的R2为0,其他3类抗体样品所测结果一致(图2B),说明再生液破坏了SA-biotin之间的非共价结合,再生后的传感器重新测KD需再次与biotin标记的蛋白结合。
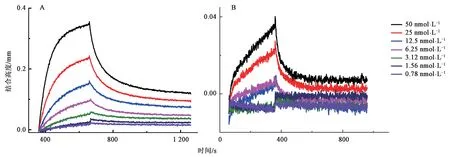
图2 再生后的传感器再次测KD值Fig.2 The regenerated sensor measured the KD value again
2.3 再生后的传感器测KD重复性试验
初次结合scFv抗体的传感器再生后重复测3次与scFv亲和力的RSD值为8.18%,其他3种传感器与3类抗体亲和力的RSD值分别为8.23%、2.64%、8.43%,RSD均值为6.87%,由表4可知,同一传感器再生后测其他种类抗体所测得KD的RSD值在7.28%~32.89%,偏差较大。由表5可知,同一传感器再生后测5个批次的DA200抗体上清液所测得KD的RSD为0.82%,偏差较小,重复性好。以上结果表明,再生后的传感器再次测自身样品KD值稳定,重现性高,但测其他样品亲和力时,所得结果的RSD值较大,重现性不高,因此,再生后的传感器只适用于对原类型的样品进行亲和力测定。

表4 初次使用的传感器再生后与4类抗体样品KD测定结果Table 4 KD determination results of the first used sensor and class 4 antibody samples after regeneration

表5 再生的传感器与5个批次的DA200样品测定结果Table 5 Determination results of regenerated sensor and 5 batches of DA200 samples
2.4 再生后的传感器测KD稳定性试验
通过传感器在保存1个月后所得KD值与之前进行比较,以考察再生后传感器的稳定性。再生后的4列SA传感器放置1个月后与scFv、diabody、完整单抗、BS4Ab的亲和力分别为5.10×10−9、5.56×10−9、2.79×10−10、4.17×10−10mol·L−1,与1个月前比较RSD分别为6.54%、8.34%、2.78%、6.88%,RSD均值为6.13%,说明再生后的传感器稳定性较好。
3 讨论
亲和力常数测定是抗体研发过程中的一项重要质控指标,基于BLI技术研发出的分子间相互作用平台自动化程度高、测定速度快、灵敏度高,能提供与ELISA一致的数据,检测过程无需标记,且能实时显示抗原抗体反应的动态过程,还可提供结合速率常数、解离速率常数和亲和力常数,通过曲线拟合即可计算出抗体的亲和力。本研究利用BLI技术检测PD-L1抗原与4类抗体之间的亲和力,结果表明,scFv和diabody这两类抗体因只有1个PD-L1抗原结合位点、分子量相差较小,因此,2类抗体与抗原的KD值接近,均为10−9mol·L−1,完整单抗因分子量大,解离速度慢,所以亲和力大于scFv和diabody这2类抗体,BS4Ab因含有2个PD-L1抗原结合位点、分子量大等原因,亲和力与完整单抗的结果相似,PD-L1抗原与4类PD-L1抗体的KD值与其他文献[19−23]报道的结果一致。说明PD-L1抗原与PD-L1抗体的亲和力主要与抗体的结合位点数、分子量有关,结合位点数越多,结合速率常数越大,亲和力也越大;分子量越小,解离速率常数越大,亲和力值则越小。SA传感器用甘氨酸再生后,需再次结合biotin-PD-L1,才能检测与抗体的亲和力,不结合biotin-PD-L1的传感器则检测不出KD值;进行亲和力测定时,再生后的传感器只能用于原样品的亲和力检测,检测其他样品准确度降低;再生后的传感器重复测3次原样品,4类抗体KD值的RSD均值为6.87%,重复性较好;再生传感器测5个批次的抗体,所得拟合曲线R2的RSD均值为0.82%,批间结果准确可靠;再生后的传感器干燥密闭保存后再次进行亲和力检测,与之前数据比较,4类抗体KD的RSD均值为6.13%,数据仍较稳定、重现性高。
综上所述,当抗原抗体亲和力≤10−10mol·L−1数量级时,可以使用甘氨酸再生SA传感器,再生后的传感器能继续用于原样品的KD测定,数据重现可靠,且能明显节约检测成本,本研究结果可为今后SA传感器或其他传感器的重复使用提供试验思路和参考依据。
