菝葜皂苷元对结直肠癌细胞HT-29凋亡和自噬的影响
2021-11-29吴源陶,邹译娴,张春虎,王理槐
吴源陶,邹译娴,张春虎,王理槐
〔摘要〕 目的 探讨菝葜皂苷元(sarsasapogenin, SAR)对人结直肠癌细胞HT-29增殖、凋亡和自噬的影响。方法 将HT-29细胞分为对照组(DMEM培养液)和SAR组(DMEM培养液+DMSO+10、20、30、40、50、60 mg/L SAR溶液);分别采用MTT法、流式细胞术、TUNEL染色及MDC染色检测细胞的增殖、凋亡及自噬的变化情况;用Western blot法检测细胞中Caspase-3、Caspase-9、Beclin-1及LC3B蛋白表达水平。结果 经SAR处理后,HT-29细胞的增殖能力明显降低(P<0.05),凋亡和自噬水平明显增加(P<0.05);与对照组相比,SAR组细胞Caspase-3、Caspase-9、Beclin-1及LC3B蛋白表达水平显著上调(P<0.05)。结论 SAR能够抑制结直肠癌细胞增殖,诱导细胞凋亡和细胞自噬的发生,其机制可能与上调Caspase-3、Caspase-9、Beclin-1及LC3B蛋白表达水平有关。
〔关键词〕 菝葜皂苷元;结肠癌;大肠癌;细胞增殖;细胞凋亡;细胞自噬
〔中图分类号〕R273 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.11.001
Effect of Sarsasapogenin on Apoptosis and Autophagy of Colorectal Cancer Lines HT-29
WU Yuantao1, ZOU Yixian1, ZHANG Chunhu2, WANG Lihuai1*
(1. The First Affiliated Hospital of Hunan University of Chines Medicine, Changsha, Hunan 410007, China;
2. Xiangya Hospital, Central South University, Changsha, Hunan 410008, China)
〔Abstract〕 Objective To investigate the effect of sarsasapogenin (SAR) on the proliferation, apoptosis, and autophagy of human colorectal cancer cell HT-29. Methods HT-29 cells were divided into control group (DMEM medium) and SAR group (DMEM medium + DMSO + 10, 20, 30, 40, 50, 60 mg/L SAR solution). MTT, flow cytometry, TUNEL staining, and MDC staining were used to detect the changes of cell proliferation, apoptosis and autophagy; Western blot method was used to detect the expression levels of Caspase-3, Caspase-9, Beclin-1 and LC3B protein. Results After treatment with SAR, the proliferation ability of HT-29 cells was significantly reduced (P<0.05), and the level of apoptosis and autophagy increased significantly (P<0.05). Compared with the control group, the expression levels of Caspase-3, Caspase-9, Beclin-1 and LC3B protein in SAR group were significantly increased (P<0.05). Conclusion SAR can inhibit the proliferation of colorectal cancer cells, induce apoptosis and autophagy. The mechanism may be related to the up-regulation of Caspase-3, Caspase-9, Beclin-1 and LC3B protein expression levels.
〔Keywords〕 sarsasapogenin; colon cancer; colorectal cancer; cell proliferation; apoptosis; autophagy
結直肠癌(colorectal cancer, CRC)是常见的消化道恶性肿瘤之一,居全球恶性肿瘤发病率的第三位[1]。我国CRC的发病率和死亡率呈逐年升高趋势[2]。最新的调查数据显示,CRC在我国恶性肿瘤发病率中位列第三[3]。菝葜,又名金刚藤,为百合科植物菝葜Smilax china L.的干燥根茎,其主要成分是皂苷,且是以菝葜皂苷元(sarsasapogenin, SAR)为主要苷元所衍生的皂苷。研究[4]表明,SAR具有抗衰老、抗炎、降血糖等作用。近年来研究[5]报道,SAR还可用于抗肿瘤,如肝癌、胃癌等。但是,关于SAR对CRC的作用及其机制的研究报道甚少。因此,本研究拟以CRC细胞株HT-29为研究对象,通过观察菝葜提取物对CRC细胞株HT-29凋亡和自噬的影响,探讨菝葜提取物对CRC的作用及其机制。
1 材料与方法
1.1 细胞株
人CRC细胞HT-29(批号:SCSP-5032)购于上海生物科学研究所,在含10%的胎牛血清的RPMI 1640培养液中培养,其内加入双抗,置于培养箱内常规培养。
1.2 试剂与仪器
SAR(海亿欣生物科技公司,批号:B20025);DMEM培养基(批号:12491015)、胎牛血清(批号:10099-141-FBS)均购自美国GIBCO公司;二甲基亚砜(dimethyl sulfoxide, DMSO)(美国Sigma公司,批号:67-68-5);Caspase-3抗体(批号:9669)、Caspase-9抗体(批号:9504)、Beclin-1抗体(批号:3738)、LC3B抗体(批号:2775)均购自美国CST公司。
超净工作台(苏州净化公司,型号:SW-CJ-IFD);二氧化碳培养箱(美国Thermo公司,型号:Shellab 2306);流式细胞仪(美国Beckman-Coulter Inc公司,型号:Cytomics FC500);全自动酶标仪(深圳迈瑞公司,型号:MR-96A);实时定量 PCR 仪(美国 BioRad公司,型号:S1000);离心机(美国Thermo公司,型号:Medifuge);荧光显微镜(日本Olympus公司,型号:BX-51)。
1.3 细胞分组
将HT-29细胞以1×104个细胞/孔接种在96孔板培养24 h。分为对照组(DEME培养液)和SAR组(DMEM培养液+DMSO+10、20、30、40、50、60 mg/L SAR溶液),各组培养24 h后进行后续实验。
1.4 MTT法检测细胞增殖能力
取状态良好、生长旺盛的HT-29细胞,用胰酶消化细胞;以1×105/孔细胞密度接种至96孔板,常规培养4 h后分别加入10、20、30、40、50、60 mg/L的SAR,对照组不加药;药物处理24、48、72 h后,开始MTT反应,酶标仪490 nm检测OD值。根据OD值绘制细胞生长曲线。
1.5 流式细胞术测定细胞凋亡
将50 mg/L SAR加入细胞培养瓶中,培养48 h后,胰酶消化细胞,当细胞间隙变大、细胞变圆时,终止消化,依次以预冷的D-Hanks液及1×binding buffer洗涤细胞。离心重悬成细胞悬液。添加10 μL
Annexin V-APC染色液,应用流式细胞仪检测不同组别细胞的凋亡率。
1.6 MDC染色检测细胞自噬
取对数生长期的HT-29细胞,胰酶消化细胞,重悬成细胞悬液。加入50 mg/L SAR培养,2 h后加入6-OHDA,共培养48 h,对照组不加药,常规培养。后按照MDC染色试剂盒操作说明进行染色,荧光显微镜下观察,计数并拍照。检测到的高亮点状荧光代表自噬泡。
1.7 Western blot檢测蛋白表达量
用胰酶消化并收集处于对数生长期的HT-29细胞,加入SDS裂解液提取细胞总蛋白,后采用考马斯亮蓝法进行蛋白定量。取30 μg蛋白经十二烷基硫酸钠-聚丙烯酰氨凝胶电泳分离蛋白,转膜至PVDF膜,封闭液室温封1 h;用TBST洗膜3次后,加入用TBST稀释的一抗(Caspase-3为1∶500;Caspase-9为1∶1 000;Beclin-1为1﹕1 000;LC3B为1∶1 000),4 ℃过夜;用TBST洗膜3次,每次5 min;经TBST漂洗后加入相应的二抗(1∶1 000),室温孵育2 h,TBST洗膜3次;加ECL显影剂,用自动凝胶成像分析仪检测,采用凝胶成像分析系统扫描分析。以β-actin为内参计算目的蛋白的表达水平。
1.8 统计学分析
采用SPSS 22.0统计软件对数据进行分析,所有数据用“x±s”表示。当数据符合正态分布时,组间比较采用one-way ANOVA分析。若方差齐,组间差异比较采用LSD法;若方差不齐,组间差异比较采用Tamhane法。以P<0.05表示差异有统计学意义。
2 结果
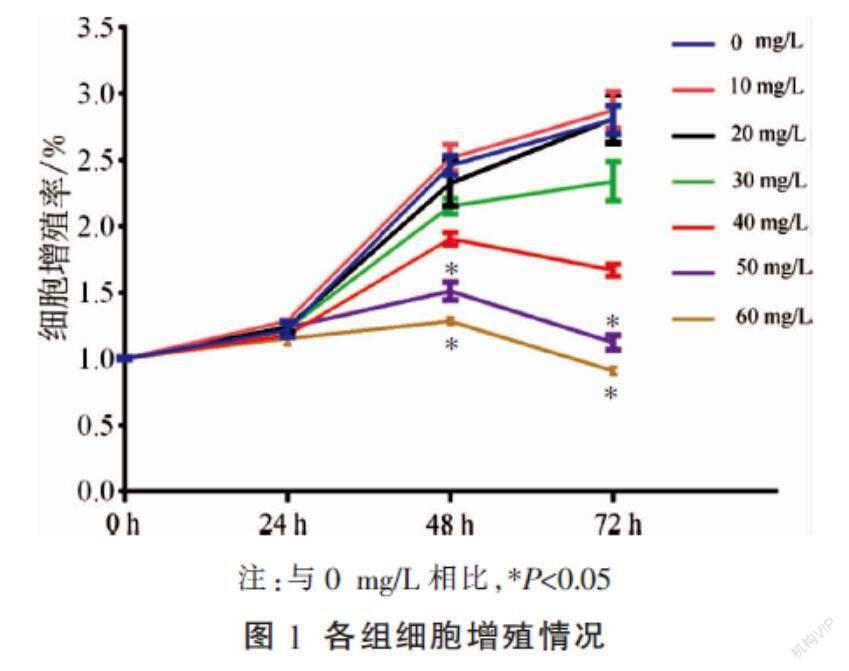
2.1 SAR对HT-29细胞生长抑制的影响
SAR能够抑制HT-29细胞的增殖,且对细胞增殖的抑制作用呈时间和浓度依赖性。与0 mg/L相比,用50 mg/L SAR干预48 h后,细胞增殖明显受到抑制(P<0.05)。因此选取50 mg/L SAR进行后续实验。见图1。
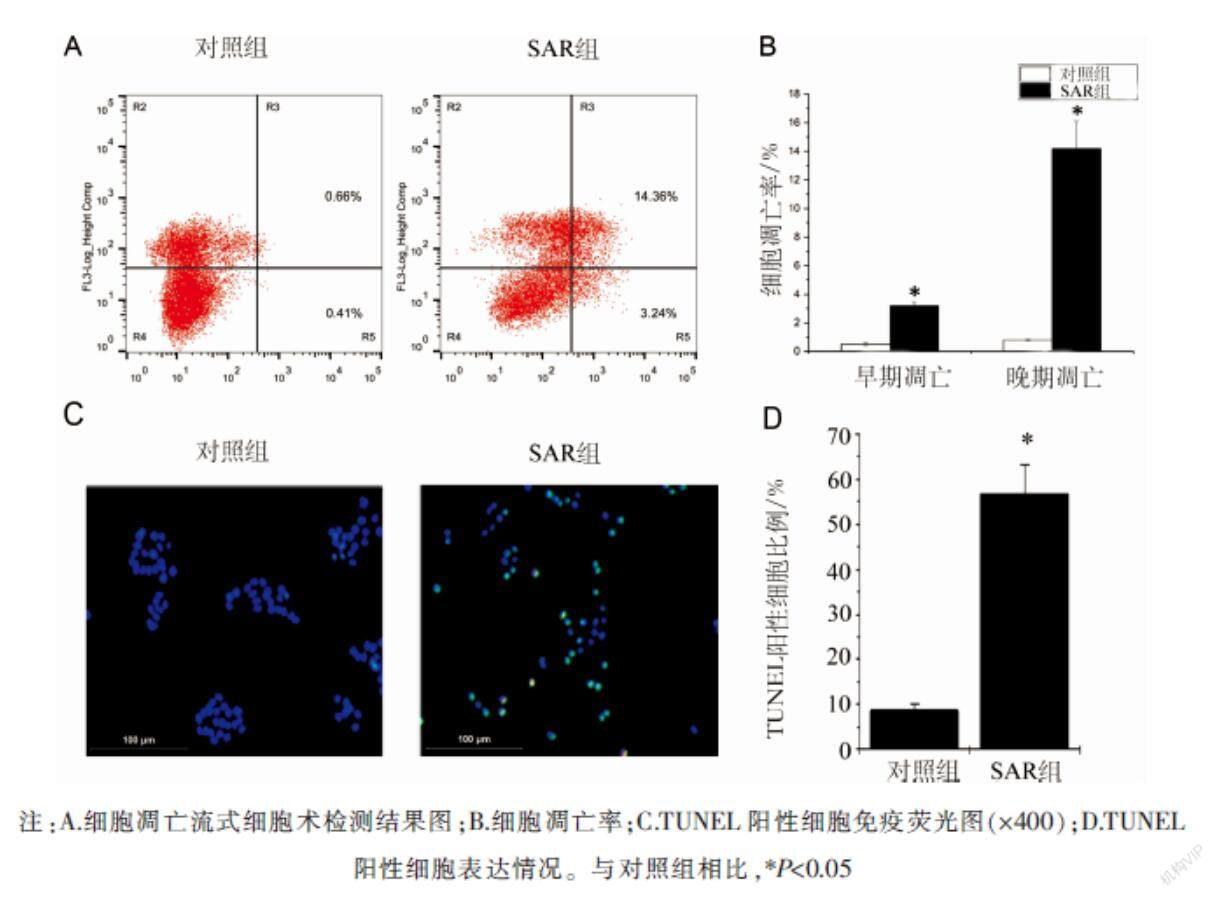
2.2 SAR对HT-29细胞凋亡的影响
流式细胞术检测结果显示,SAR组细胞早期凋亡率为3.24%,高于对照组细胞早期凋亡率的0.41%(P<0.05);SAR组细胞晚期凋亡率为14.36%,高于对照组细胞晚期凋亡率的0.66%(P<0.05)。TUNEL染色结果显示,与对照组相比,SAR组TUNEL阳性细胞数明显增多(P<0.05)。见图2。
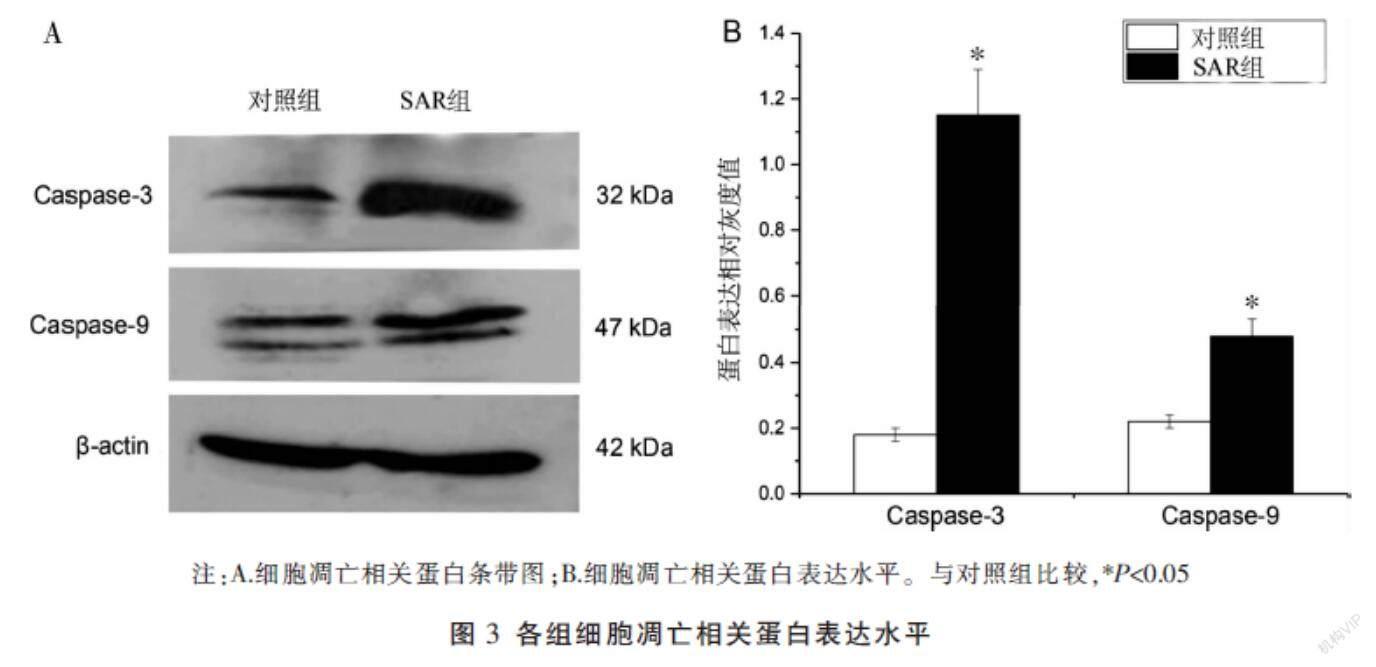
2.3 SAR对HT-29细胞凋亡相关蛋白的影响
与对照组相比,SAR组Caspase-3和Caspase-9蛋白表达上调(P<0.05)。见图3。
2.4 SAR对HT-29细胞自噬的影响
与对照组相比,SAR组可见到明显的自噬囊泡形成。见图4。
2.5 SAR对HT-29细胞自噬相关蛋白的影响
与对照组相比,SAR组细胞Beclin-1和LC3B蛋白表达增多(P<0.05)。见图5。
3 讨论
據世界卫生组织统计,CRC已成为全球第四大致命癌症[6]。根据中国国家癌症中心发布的《2018年国家癌症报告》显示,CRC在中国癌症发病率中排名第三[3]。因此,迫切需要寻找一种有效治疗CRC的临床药物[7]。SAR可通过多种途径发挥抗肿瘤作用,且由于其较高的安全性,使SAR的抗CRC癌活性已成为国内外研究的热点之一[5]。
凋亡是细胞为清除体内异常或受损细胞自发启动的程序性保护机制,在细胞发育和代谢中起着至关重要的作用[8-9]。临床上通过外部干预诱导肿瘤细胞凋亡成为治疗肿瘤的重要途径。有学者探讨了SAR对肝癌细胞HepG2凋亡的影响,发现SAR能够诱导HepG2凋亡[9-10]。廖子君等[10-12]研究发现,SAR能够诱导胃癌细胞BGC-823凋亡,而不会影响健康细胞的生长,同时能够上调Bax蛋白、下调Bcl-2蛋白的表达水平。在本研究中,流式细胞术结果发现,与对照组相比,SAR组HT-29细胞凋亡率显著增加(P<0.05)。TUNEL染色结果同样提示SAR可以诱导人CRC HT-29细胞凋亡(P<0.05)。进一步对细胞凋亡相关蛋白进行测定发现,SAR干预可上调HT-29细胞中凋亡相关蛋白Caspase-3和Caspase-9的表达(P<0.05)。凌博凡等[13]研究发现,SAR干预人结肠癌LoVo细胞48 h后能够诱导该细胞凋亡,该效应发生的同时线粒体膜电位会出现下调改变,提示诱导凋亡的机制可能与线粒体通路的调控有关。
自噬是真核生物体细胞内重要的自我降解和再循环机制。生理状态下,自噬通过清除自身有害物质(老化及死亡的蛋白质和细胞器)而维持细胞内稳态,对机体细胞发挥着保护作用[14-15]。当自噬发生异常时,细胞内原有的稳态会被打破,而促进肿瘤发生与发展[16-17]。Beclin-1基因是自噬的特异性相关基因,由其编码的Beclin-1蛋白被认为是肿瘤抑制蛋白,能够调节自噬过程,其机制可能是与ClassⅢPI3K相结合参与自噬泡的形成[18]。LC3B作为细胞自噬的特异性蛋白,其含量与自噬小体数量呈正相关,因而被广泛运用于自噬研究[19-20]。本研究运用MDC染色法研究SAR对细胞自噬的影响,结果显示,与对照组相比,SAR组可见到明显的自噬囊泡,且经SAR处理的HT-29细胞中,自噬相关蛋白Beclin-1和LC3B显著增多(P<0.05),提示SAR可激活HT-29细胞的自噬。
综上所述,SAR可能通过调控Caspase-3、Caspase-9、Beclin-1及LC3B蛋白的表达水平发挥抑制HT-29细胞增殖,诱导细胞凋亡和自噬的作用。但是其具体深层机制需后续实验进一步进行研究。本研究为菝葜皂苷的进一步开发和为CRC的临床治疗提供了有力的实验证据。
参考文献
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA: A Cancer Journal for Clinicians, 2020, 70(1): 7-30.
[2] 曹 文,周小青.湿热-痰结-瘀毒型小鼠肠癌模型的建立[J].湖南中医药大学学报,2020,40(1):38-41.
[3] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mort?鄄
ality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424.
[4] 王江威,苏晓琳,郑秀茜,等.中药菝葜的化学成分及药理作用研究进展[J].化学工程师,2020,34(2):50-53.
[5] 宋 宇,梁长青,何忠梅,等.薯蓣皂苷元体外抗肿瘤作用的研究[J]. 中国肿瘤,2004,13(10):41-43.
[6] CHENG L, ENG C, NIEMAN L Z, et al. Trends in colorectal cancer incidence by anatomic site and disease stage in the United States from 1976 to 2005[J]. American Journal of Clinical Oncology, 2011, 34(6): 573-580.
[7] DEKKER E, TANIS P J, VLEUGELS J L A, et al. Colorectal cancer[J]. The Lancet, 2019, 394(10207): 1467-1480.
[8] FERNALD K, KUROKAWA M. Evading apoptosis in cancer[J]. Trends in Cell Biology, 2013, 23(12): 620-633.
[9] XU X B, LAI Y Y, HUA Z C. Apoptosis and apoptotic body: Disease message and therapeutic target potentials[J]. Bioscience Reports, 2019, 39(1): BSR20180992.
[10] BAO W N, PAN H F, LU M, et al. The apoptotic effect of sarsasapogenin from Anemarrhena asphodeloides on HepG2 human
hepatoma cells[J]. Cell Biology International, 2007, 31(9): 887-892.
[11] 倪 源.菝葜皂苷元致肝癌HepG2细胞凋亡作用机理的研究[D]. 杭州:浙江大学,2008.
[12] 廖子君,郑 琪,赵 征,等.菝葜皂苷对胃癌BGC-823细胞Bcl-2、Bax凋亡蛋白表达影响的实验研究[J].中国医药指南,2018,16(18):1-2.
[13] 凌博凡,邹 玺,吴 坚,等.菝葜皂苷元对人结肠癌细胞LoVo凋亡的影响[J].南京中医药大学学报,2012,28(3):256-258.
[14] NODA N N, INAGAKI F. Mechanisms of autophagy[J]. Annual Review of Biophysics, 2015, 44: 101-122.
[15] RAVANAN P, SRIKUMAR I F, TALWAR P. Autophagy: The spotlight for cellular stress responses[J]. Life Sciences, 2017, 188: 53-67.
[16] ONORATI A V, DYCZYNSKI M, OJHA R, et al. Targeting autophagy in cancer[J]. Cancer, 2018, 124(16): 3307-3318.
[17] MARINKOVI M, PRUNG M, BULJUBA I M, et al. Autophagy
modulation in cancer: Current knowledge on action and therapy[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 8023821.
[18] DU H L, CHE J M, SHI M M, et al. Beclin 1 expression is associated with the occurrence and development of esophageal squamous cell carcinoma[J]. Oncology Letters, 2017, 14(6): 6823-6828.
[19] GIATROMANOLAKI A, KOUKOURAKIS M I, GEORGIOU I, et al. LC3A, LC3B and beclin-1 expression in gastric cancer[J]. Anticancer Research, 2018, 38(12): 6827-6833.
[20] CERULLI R A, SHEHAJ L, BROWN H, et al. Stapled peptide inhibitors of autophagy adapter LC3B[J]. ChemBioChem, 2020, 21(19): 2777-2785.
(本文編辑 匡静之 周 旦)
