基于网络药理学及分子对接研究参芪扶正注射液抗非小细胞性肺癌的作用机制
2021-11-29杨罡赵峻邓峥袁兵张云辉
杨罡 赵峻 邓峥 袁兵 张云辉

摘要 目的:运用网络药理学结合分子对接技术研究参芪扶正注射液抗非小细胞肺癌(NSCLC)的活性成分及作用机制,为临床应用提供理论依据。方法:应用中药系统药理学数据库与分析平台( TCMSP)获取参芪扶正注射液的活性成分及靶点,通过美国国立生物技术信息中心(NCBI)数据库获取NSCLC与正常肺组织的差异基因,并采用STRING数据库及Cytoscape构建共同靶点可视化网络图。借助DAVID数据库实现基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG) 富集分析,利用AutoDock Vina和PyMoL进行分子对接以验证。结果:获取参芪扶正注射液活性成分41个,NSCLC差异基因2 861个,共同靶点58个。GO分析显示生物学过程主要涉及对类固醇激素、氧化应激、多种化学物理因素刺激等反应的调节;KEGG富集显示主要通过TNF、Relaxin、IL-17、P13K/AKT、Estrogen等通路发挥抗癌作用。分子对接表明药物主要活性成分与关键靶点结合性较好,从分子层面对参芪扶正注射液的有效性进行了验证。结论:运用网络药理学及分子对接的方法证明参芪扶正注射液通过多成分、多靶点、多通路发挥对NSCLC的治疗作用,并为临床应用提供了理论支持。
关键词 参芪扶正注射液;非小细胞肺癌;网络药理学;分子对接
Abstract Objective:To explore the active components and mechanism of Shenqi Fuzheng Injection for the treatment of non-small cell lung cancer(NSCLC) by network pharmacology and molecular docking technology,and to provide theoretical basis for clinical application.Methods:TCMSP database was used to obtain the active components and targets of Shenqi Fuzheng Injection.The differential genes between NSCLC and normal lung tissue were obtained by NCBI database.And the visual network of common targets was drawed by STRING database and Cytoscape.The DAVID database was used to perform GO analysis and KEGG pathway analysis.The molecular docking technology was carried out by using AutoDock Vina and PyMOL for further verification.Results:A total of 41 active components of Shenqi Fuzheng Injection,2 861 differential genes of NSCLC and 58 common targets were obtained.GO enrichment analysis showed that the biological process mainly involved in the regulation of steroid hormone,oxidative stress response,and multiple chemical and physical responses; KEGG enrichment showed that anti-cancer effect was mainly through TNF pathway,Relaxin pathway,IL-17 pathway,P13K/AKT pathway and Estrogen pathway.The results of molecular docking showed that the main active components had good binding with key targets,and the effectiveness of Shenqi Fuzheng Injection was verified from the molecular level.Conclusion:The therapeutic effect of Shenqi Fuzheng Injection on NSCLC through multi-components,multi-targets and multi-pathways can be proved by network pharmacology and molecular docking,which provides theoretical support for clinical application.
Keywords Shenqi Fuzheng Injection; Non-small cell lung cancer; Network pharmacology; Molecular docking
中圖分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.20.001
原发性支气管肺癌简称肺癌,是我国及全球范围内最常见的严重威胁人群生命和健康的恶性肿瘤。2018年全球癌症数据统计显示,肺癌以11.6%的发病率及18.4%的病死率高居所有类型癌症榜首[1]。同时,根据癌症中心提供的数据,我国肺癌患者人数约为78.1万且以2%~3%的增长率逐年增多[2]。其中,非小细胞肺癌(Non-small Cell Lung Cancer,NSCLC)占肺癌患者总数的绝大部分,且由于其癌细胞生长分裂速度慢,扩散转移相对较晚,2/3的患者确诊时已为晚期或发生远处转移从而丧失手术机会[3]。化疗是这部分患者的标准治疗措施,但由于不良反应大,且严重影响患者生命质量。故寻求不良反应小且有疗效的NSCLC替代或辅助支持疗法具有重大的临床意义。
参芪扶正注射液(Shenqi Fuzheng Injection,SFI)是以党参和黄芪为主要成分的中药制剂。中医认为党参益气养精、健脾益肺;而黄芪具有补气固表的功效[4]。现代药理研究证实参芪扶正注射液能够抑制炎症介质产生抗炎作用,通过调控细胞周期促进癌细胞凋亡从而产生抗肿瘤、增强机体免疫力等多种药理作用[5-6]。该中药制剂临床应用多年,常用于肺癌、胃癌等多种癌症的辅助治疗。同时临床研究表明,参芪扶正注射液在改善中晚期肺癌患者生命质量,减轻放化疗不良反应并提高其疗效等方面具有良好的临床疗效[7-8]。但其具体的作用机制和有效活性成分有待进一步研究,以便更好地指导临床用药。
由于中医药治疗疾病具有多种成分、多个靶点、多条通路共同发挥作用的特点,对复方中药治疗疾病的生物学机制研究需兼顾整体性和系统性。网络药理学是一种研究中药活性化合物、作用靶标和疾病之间相互作用的新方法,本质上是基于大数据信息挖掘的系统生物学。该方法对于药物功效的评价、作用机制的研究具有科学性和可视化的特点[9]。分子对接技术将药物小分子作为配体与受体蛋白进行3D结构间的对接,来预测蛋白和药物分子的亲和力及结合模式从而达到药物设计及验证的目的。基于此,本研究运用网络药理学探索参芪扶正注射液核心活性成分和靶点,并结合生物学、通路分析和分子对接技术,预测其干预NSCLC的作用机制,从而为参芪扶正注射液临床运用提供理论依据。
1 资料与方法
1.1 参芪扶正注射液中化合物收集
将参芪扶正注射液主要成分“党参”“黄芪”作为关键词,输入至中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php),检索出成分对应的化合物。
1.2 药物的活性成分和靶蛋白筛选
药物口服生物利用度(OB)是药动学ADME参数中的重要指标之一,指药物中有效活性成分经吸收进入人体血液循环的速度与程度。OB值越低提示药物的治疗效果可能越差。类药性(DL)是指某化合物与已知药物的相似程度,通常DL值越低,该化合物作为药物活性成分的可能性越低[10]。因此,以OB≥30%和DL≥0.18为标准,进一步筛选出具有较高生物学活性的成分。将成分在TCMSP中进行药物靶标的匹配,并将获取的靶标经Uniprot数据库(https://www.uniprot.org/)校正为标准基因名。
1.3 NSCLC差异基因获取
通过NCBI平台(National Center for Biotechnology Information,https://www.ncbi.nlm.nih.gov/)中的GEO数据库,将物种选择为智人且样本量以>20为选择标准,下载非小细胞肺癌及癌旁正常肺组织DNA测序数据。利用R语言edgR软件包对肺癌差异表达基因做进一步分析,设置logFCfilter≥1,显著性P-value>0.05,并使用R语言gplots软件包绘制差异基因火山图及热图。
1.4 药物和疾病共同靶点获取
利用VENNY 2.1(https://bioinfogp.cnb.csic.es/tools/venny),对非小细胞肺癌差异基因和参芪扶正注射液主要化合物的靶点进行比较,筛选出共同作用靶点,并绘制Venny图。
1.5 构建“药物-成分-靶点-疾病”网络
利用复杂网络可视化分析和编辑软件Cytoscape(Version3.7.2)构建“药物-成分-靶点-疾病”网络图。在网络中,节点(Node)代表党参和黄芪、药物活性成分、关键靶基因以及非小细胞肺癌。边(Edge)代表党参、黄芪与对应活性成分、活性成分与靶基因、疾病与靶基因相互作用关系。
1.6 构建蛋白质-蛋白质相互作用( PPI)网络
利用STRING平台(https://string-db.org/)构建交集靶点蛋白质-蛋白质相互作用(PPI)网络,并利用R语言绘制相互作用关系最高的前20个靶点蛋白柱状图。以明确参芪扶正注射液中的主要有效成分“党参”“黄芪”对非小细胞肺癌的作用关键靶点。
1.7 通路富集分析
将获取到的交集基因导入至DAVID数据库(https://david.ncifcrf.gov)进行基因本体(GO)生物学功能富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路富集分析。并借助Omicshare平台(https://www.omicshare.com/tools/)及R语言中ggplot2包将富集得到的结果绘制成气泡图和柱状图。最后应用Cytoscape软件构建参芪扶正注射液主要药物成分-靶点-信号通路网络结构图。
1.8 分子对接
从PDB数据库(http://www.rcsb.org/)下载PPI网络中相互作用Degree值前4位核心蛋白的3D结构,并从PubChem数据库(http://pubchem.ncbi.nlm.nih.gov/)及ZINC数据库(http://zinc.docking.org)下载网络图中Degree值最高的前4位活性小分子的3D结构。应用AutoDock Tools 1.5.6对获取的小分子及蛋白3D结构进行去水、加氢、计算电荷等处理后,导入到AutoDock Vina进行对接,计算出药物活性成分与靶蛋白相结合所需的最低结合效能。再利用Pymol2.1.1将对接所获得的相互作用结构进行可视化处理。
2 结果
2.1 药物活性成分获取
在TCMSP数据库中以黨参、黄芪进行检索,共计获得221个化合物(党参134个、黄芪87个),并根据OB≥30%和DL≥0.18筛选后共获得活性成分41个,其中党参21个、黄芪20个,二者无重叠成分。见表1。
2.2 药物靶点的获取
借助TCMSP对41个活性化合物进行靶点筛选,共获得210个靶点,其中黄芪101个,党参189个,80个为共有的重叠靶点。
2.3 非小细胞肺癌的差异基因获取
通过NCBI平台以“NSCLC Normal”为关键词在GEO数据库中进行检索,以样本量>20、人类非小细胞肺癌组织与正常肺组织为标本进行筛选,下载目标表达谱(GSE21933)的平台文件及样本文件。获取非小细胞肺癌差异基因2 861个,并借助R语言绘制出差异基因的热图。见图1。火山图见图2。
2.4 共同靶点的获取
为了进一步明确参芪扶正注射液和NSCLC的共同靶点,经过对获得的非小细胞肺癌相关差异基因2 861个及药物的预测靶点210个进行比较筛选后,筛选出二者共同作用靶点58个。见图3。具体基因名及entrez ID见表2。
2.5 构建PPI网络
将获取到的58个交集靶点蛋白输入String平台,设置置信度为Highest≥0.9,并剔除独立于网络以外的靶点,构建PPI网络。见图4。根据相互作用关系性高低,利用R语言绘制最高的前20项基因的柱状图,获取核心蛋白。见图5。
2.6 药物-成分-靶点-疾病共表达网络构建
制作党参、黄芪与对应药物活性成分、活性成分与关键靶基因、关键靶基因与非小细胞肺癌相互作用关系以及节点属性文件,并导入到Cytoscape构建“药物-成分-靶点-疾病”网络。见图6。使用CentiScape计算药物活性成分Degree值,该值越大说明对应的节点在网络中越重要。其中,根据与非小细胞肺癌的关系度值由高至低排名前5的药物成分:槲皮素(Quercetin)为44、木犀草素(Luteolin)为20、刺芒柄花素(Formononetin)为12、山柰酚(Kaempferol)为12、7-O-甲基-异微凸剑叶莎醇(7-O-methylisomucronulatol)为10。见表3。
2.7 GO富集分析
利用DAVID数据库对相关靶点蛋白进行分子功能、细胞组分和生物过程3个方面的GO分析,综合校正后的P值及富集在该功能区基因数目。见图7。分别选择排名靠前的条目借助Omicshare平台作条形图呈现。见图8。分析结果显示,上述蛋白在生物过程方面主要涉及对类固醇激素、氧化应激反应、多种化学物理因素对细胞的刺激反应等过程的调节;细胞组分方面主要是影响细胞膜的小凹、微区、膜筏以及细胞核染色质体等;在分子功能方面主要是调控类固醇激素及结合、DNA转录激活、多种肽酶活性功能。推测参芪扶正注射液可能通过以上功能过程在NSCLC的治疗中发挥其扶正益气、养精补血的功效。
2.8 KEGG通路富集分析
对58个抗癌关键基因进行KEGG分析。见图9。共富集64条通路,根据校正后P值进行排序,选择前20项通路绘制气泡图展示,主要涉及肿瘤转录失控(Transcriptional Misregulation in Cancer)、癌症中的MicroRNAs(MicroRNAs in Cancer)、多种病毒感染、细胞衰老和细胞周期(Cellular Senescence,Cell cycle)、前列腺癌(Prostate Cancer)、非小细胞肺癌(Non-small Cell Lung Cancer)等信号通路。排除广泛通路后,前15条信号通路见表4,其中肿瘤坏死因子(TNF)通路涉及PTGS2、MMP9、JUN、IL6、ICAM1、SELE等基因;松弛素(Relaxin)信号通路涉及EGFR、VEGFA、MMP9、JUN、MMP1、MMP13等基因;白细胞介素-17(IL-17)通路涉及PTGS2、MMP9、JUN、IL6、MMP1、MMP13等基因;磷脂酰肌醇3-羟激酶-苏氨酸激酶(PI3K-AKT)信号通路涉及EGFR、VEGFA、CDKN1A、IL6、IL2、NOS3等基因;雌激素(Estrogen)信号通路涉及ESR1、EGFR、MMP9、JUN、FOS、NOS3、CTSD基因。
2.9 药物成分-靶基因-信号通路共表达网络构建
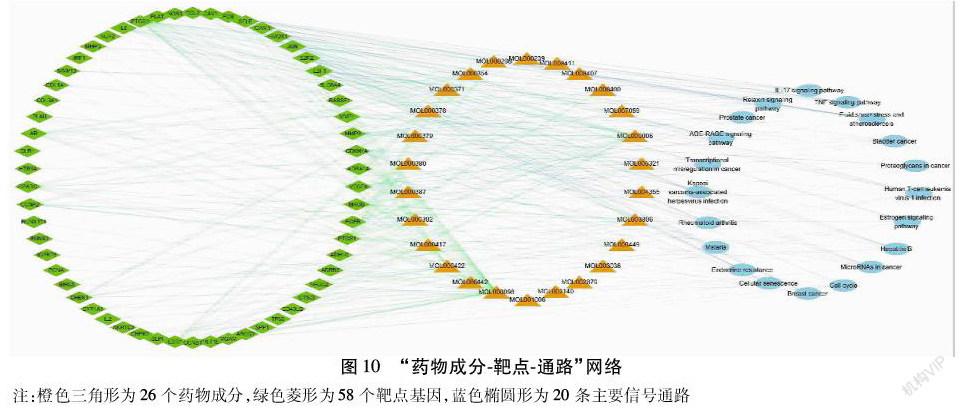
应用Cytoscape绘制参芪扶正注射液核心成分-关键靶点-主要信号通路网络结构图。见图10。可见药物活性成分分别作用于单个或多个靶点基因,并通过对应的信号通路发挥调控作用,证明了参芪扶正注射液治疗NSCLC具有多成分、多靶点、多通路的机制。
2.10 分子對接
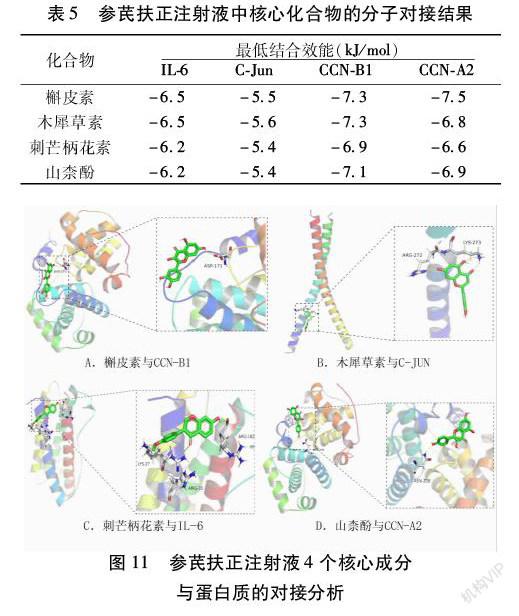
对网络图中Degree值前4的药物有效成分与PPI网络中相互作用度值最高的前4位核心蛋白进行分子对接,Autodock软件对接结果见表5。配体与蛋白相结合时所需结合效能<0则说明二者可以自发结合,且二者亲和力越强,所需的结合效能越低。对接结果显示,前4位药物有效成分与所选取的核心蛋白之间的结合能均低于-5 kJ/mol,表明具有较好的结合活性,证明参芪扶正注射液主要通过上述活性成分作用于对应的关键蛋白发挥抗NSCLC的治疗作用。最后利用Pymol软件对其进行可视化分析处理,从而进一步研究这些小分子成分与蛋白质的相互作用关系。见图11。
3 讨论
非小细胞肺癌是肺癌分型中占比最大、预后最差的一种类型。中医学将其归于“肺积”“息贲”等范畴,并认为它的发生是由于内因(正气虚损)、外因(癌毒侵袭)等多种因素共同作用的结果[11]。因此,扶正固本,活血化瘀祛痰为NSCLC的重要治疗原则。参芪扶正注射液是以党参、黄芪为组成成分的中药制剂,其中黄芪为君药补中益气、健脾益肺;党参为臣药补气固表、活血化瘀。二者合用使扶正固本、益气健脾肺的功效得到增强,从而与非小细胞肺癌的病机相契合[8]。但为了更全面地研究参芪扶正注射液对NSCLC的治疗作用,本研究采用网络药理学联合分子对接技术对其有效成分、潜在靶点和具体作用机制进行研究。
3.1 药物核心有效成分
通过获取参芪扶正注射液活性成分并根据“药物-成分-靶点-疾病”网络图所显示:黄芪、党参主要活性成分中槲皮素(Quercetin)、木犀草素(Luteolin)、刺芒柄花素(Formononetin)、山柰酚(Kaempferol)为拓扑网络中与抗NSCLC靶点度值最高的化合物,即最核心的节点,提示这几种活性成分在治疗NSCLC中发挥着关键作用。1)槲皮素是一种生物类黄酮,对NSCLC具有抗增殖和抗侵袭活性。研究证明槲皮素通过抑制热休克蛋白70的表达,从而抑制A549肺癌细胞生长。并且槲皮素及其代谢产物能通过抑制Src/Fn14/NF-kB信号通路,上调过氧化物酶体增殖物激活受体(PPAR-γ)的表达,抑制基质金属蛋白酶-2(MMP-2)的活性和表达,从而显著抑制非小细胞肺癌的侵袭和迁移[12-13]。另有研究表明槲皮素能提高肺癌细胞对化疗药物吉西他滨的敏感性。因此,槲皮素在NSCLC治疗中可能作为一种抗增殖和化疗药物增敏剂[14]。2)木犀草素是一种天然类黄酮,其抗肿瘤作用与多条信号通路及下游因子密切相关。研究表明,木犀草素可通过激活JNK信号通路、增强肿瘤坏死因子相关凋亡诱导配体(TRAIL)从而诱导NSCLC细胞周期G2期停滞及细胞凋亡[15-16]。另有研究证明,木犀草素能抑制TGF-β1诱导的E-钙黏蛋白(Cadherin)下降,从而抑制肺癌细胞的侵袭、转移和上皮间充质转化(EMT)[17]。3)刺芒柄花素是一种具有抗肿瘤作用的植物异黄酮,可降低多种细胞周期相关蛋白表达水平,同时上调抑癌基因P53及凋亡蛋白bax的表达,诱导NSCLC细胞周期G1期停滞,促进癌细胞凋亡[18]。此外,刺芒柄花素被证明为一种EGFR抑制剂,在非小细胞肺癌中通过抑制EGFR-AKT-Mcl-1信号通路,抑制肿瘤生长[19]。4)山柰酚是一种天然的膳食类黄酮,能提高放疗对NSCLC癌细胞的杀伤作用,并通过上调MMP-2及E-cadherin从而发挥抑制肺癌细胞转移的重要作用[20-21]。
3.2 关键靶点基因
对PPI网络进行分析发现IL-6、JUN、CCNA2、CCNB1、EGFR基因相互作用关系最紧密,处于网络的核心地位,可视为治疗的关键靶点。1)IL-6是一种多效性细胞因子,在调节机体炎症反应和肿瘤免疫方面发挥重要作用。JAK和STAT3是其调控的重要下游基因,研究表明IL-6通过激活JAK2/STAT3信号途径促进肺癌细胞的增殖和肺癌干细胞样特性的形成[22]。此外,IL-6受体拮抗蛋白或司妥昔单抗都能阻断IL-6/JAK/STAT3信号通路有效抑制肺癌细胞的生长[23-24]。血清高水平的IL-6与NSCLC患者较差的生存率明显相关[25]。故抗IL-6治疗在NSCLC综合治疗中意义重大。2)c-Jun是一种重要的致癌基因,常与c-Fos组成二聚体复合物活化蛋白-1(AP-1),是促进多种肿瘤发生的关键转录因子。研究发现,c-Jun基因(-1 318T>G和2 673T>C)多态性,通过与环境因素(吸烟或饮酒)的相互影响,增加了中国地区该基因型携带者对肺癌的易感性[26]。3)CCNB1及CCNA2属于细胞周期蛋白家族,是参与肺癌细胞周期调控、影响癌细胞增殖的重要因子。研究发现,CCNB1可以预测NSCLC患者的预后,CCNB1水平越高,生存期越短且预后越差[27]。并且抑制CCNB1表达后,癌细胞的细胞周期阻滞在G2/M期,克隆性增殖减少,肿瘤体积缩小[28]。另外,CCNA2的过表达与早期NSCLC患者较差的无复发生存率明显相关[29]。4)EGFR通过多条下游信号途径影响肺癌细胞周期诱导细胞增殖,并促进癌细胞转移,在NSCLC的发生、发展过程中发挥着至关重要的作用。同时,EGFR作为肺癌治疗的重要靶点,针对其研发的EGFR-酪氨酸激酶抑制剂作为EGFR突变型非小细胞肺癌患者的治疗具有高度的敏感性和显著的疗效[30]。
3.3 GO及KEGG富集分析
GO富集分析表明参芪扶正注射液主要是通过对类固醇激素及与受体结合、DNA转录的激活、多种肽酶活性、氧化应激反应等功能过程的调节来发挥抗NSCLC作用。
KEGG通路结果显示参芪扶正注射液的治疗过程涉及多条与肿瘤炎症反应、血管生成、增殖、侵袭转移相关的信号通路。1)TNF信号通路:肿瘤坏死因子α(TNF-α)是迄今为止发现的抗肿瘤作用最强大的细胞因子。TNF-α通过激活SAKP/JNK信号通路增强肺癌细胞对放疗的敏感性并抑制了肺癌转移[31]。研究发现,TNF作为抗血管生成药物,其减毒增效突变体联合化疗药物在晚期NSCLC患者的治疗中具有显著疗效[32]。2)Relaxin信号通路:松弛素(Relaxin,RLN)是一种结构类似于胰岛素的多肽类激素,近年来研究发现松弛素对多种癌症的增殖和侵袭具有促进作用。研究发现通过RLN2/RXFP1(松弛素受体1)信号通路诱导钙黏蛋白表达降低和β-連环蛋白(β-catenin)磷酸化增加,从而导致子宫内膜癌细胞侵袭性增加[33]。此外,对于前列腺癌,RLN能促血管生成,并产生NO扩张血管从而增加肿瘤血流量,促进肿瘤发展[34]。目前关于松弛素与NSCLC的研究较少,可能有望成为治疗的新方向。3)IL-17信号通路:该通路的激活导致外周血IL-17水平升高并与NSCLC分期相关。NSCLC组织中IL-17及IL-17R表达升高能增强癌细胞侵袭潜能,IL-17基因敲除小鼠的癌细胞转移性明显下降[35]。4)P13K/AKT信号通路:P13K/AKT信号通路是非小细胞肺癌发生发展过程中最重要的途径之一,其通过参与或激活多条相关信号通路如PI3K/AKT/mTOR,IGF-1/PI3K/AKT及PI3K/AKT/NF-κB等,促进NSCLC的增殖、侵袭和转移。因此,抑制P13K/AKT通路在NSCLC的综合治疗中有着至关重要的意义。5)Estrogen信号通路:雌激素主要通过雌激素受体α和β的表达在NSCLC的增殖和转移中起着重要作用,但通过不同受体发挥作用的机制和通路不同,ERα可以激活CCL2/CCR2/MMP9信号通路,促进癌组织中巨噬细胞浸润,从而增强NSCLC细胞的侵袭性,并与较差的生存率相关[36]。ERβ介导肺癌组织中IGF-1R表达上调并与之协同作用促进NSCLC细胞增殖[37]。因此,抗雌激素及其受体治疗可能为NSCLC综合治疗的重要组成部分。
4 结语
本研究采用网络药理学联合分子对接的方法,对参芪扶正注射液治疗NSCLC的核心有效成分、关键作用靶点蛋白进行获取,并对交集靶标进行GO和KEGG富集分析,阐明了参芪扶正注射液通过多化合物、多靶点、多通路作用于NSCLC,为临床应用提供了科學理论。但由于本研究基于大数据挖掘,具有一定的局限性,故仍需要临床研究及体内外研究以验证我们的发现。
参考文献
[1]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[2]中华医学会,中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肺癌临床诊疗指南(2019版)[J].中华肿瘤杂志,2020,42(4):257-287.
[3]Gridelli C,Rossi A,Carbone DP,et al.Non-small-cell lung cancer[J].Nat Rev Dis Primers,2015,1:15009.
[4]鲍卓,何映月.参芪扶正注射液联合化疗对老年晚期非小细胞肺癌患者外周血T淋巴细胞亚群和肿瘤标志物的影响[J].中国老年学杂志,2019,39(10):2359-2361.
[5]廖巧,邢蓉.参芪扶正注射液的药理作用和临床应用研究进展[J].中国药房,2016,27(24):3455-3456.
[6]Xiong Y,Zhao Q,Gu L,et al.Shenqi Fuzheng Injection reverses cisplatin resistance through Mitofusin-2-Mediated cell cycle arrest and apoptosis in A549/DDP cells[J].Evid Based Complement Alternat Med,2018,2018:8258246.
[7]Dedong C,Huilin X,Anbing H,et al.The Effect of ShenQi FuZheng Injection in combination with chemotherapy versus chemotherapy alone on the improvement of efficacy and immune function in patients with advanced non-small cell lung cancer:A Meta-Analysis[J].PLoS One.2016,11(3):e0152270.
[8]任军生.参芪扶正注射液辅助治疗晚期非小细胞肺癌化疗患者对不良反应的预防效果观察[J].现代中西医结合杂志,2015,24(12):1286-1289.
[9]Kibble M,Saarinen N,Tang J,et al.Network pharmacology applications to map the unexplored target space and therapeutic potential of natural products[J].Nat Prod Rep,2015,32(8):1249-1266.
[10]Wu J,Hong S,Xie X,et al.A Network pharmacology-based study on the anti-Lung cancer effect of dipsaci radix[J].Evid Based Complement Alternat Med,2020,2020:7424061.
[11]张星星,李泽庚.肺癌中医病因病机探讨[J].中华中医药杂志,2015,30(10):3447-3449.
[12]Dong Y,Yang J,Yang L,et al.Quercetin inhibits the proliferation and metastasis of human non-small cell lung cancer cell line:the key role of src-mediated fibroblast growth factor-inducible 14(Fn14)/nuclear factor kappa B(NF-κB) pathway[J].Med Sci Monit,2020,26:e920537.
[13]Chuang CH,Yeh CL,Yeh SL,et al.Quercetin metabolites inhibit MMP-2 expression in A549 lung cancer cells by PPAR-γ associated mechanisms[J].J Nutr Biochem,2016,33:45-53.
[14]Lee SH,Lee EJ,Min KH,et al.Quercetin enhances chemosensitivity to gemcitabine in lung cancer cells by inhibiting heat shock protein 70 expression[J].Clin Lung Cancer,2015,16(6):e235-e243.
[15]Cai X,Ye T,Liu C,et al.Luteolin induced G2 phase cell cycle arrest and apoptosis on non-small cell lung cancer cells[J].Toxicol In Vitro,2011,25(7):1385-1391.
[16]Yan J,Wang Q,Zheng X,et al.Luteolin enhances TNF-related apoptosis-inducing ligand′s anticancer activity in a lung cancer xenograft mouse model[J].Biochem Biophys Res Commun,2012,417(2):842-846.
[17]Chen KC,Chen CY,Lin CR,et al.Luteolin attenuates TGF-β1-induced epithelial-mesenchymal transition of lung cancer cells by interfering in the PI3K/Akt-NF-κB-Snail pathway[J].Life Sci,2013,93(24):924-933.
[18]Yang Y,Zhao Y,Ai X,et al.Formononetin suppresses the proliferation of human non-small cell lung cancer through induction of cell cycle arrest and apoptosis[J].Int J Clin Exp Pathol,2014,7(12):8453-8461.
[19]Yu X,Gao F,Li W,et al.Formononetin inhibits tumor growth by suppression of EGFR-Akt-Mcl-1 axis in non-small cell lung cancer[J].J Exp Clin Cancer Res,2020,39(1):62.
[20]Kuo WT,Tsai YC,Wu HC,et al.Radiosensitization of non-small cell lung cancer by kaempferol[J].Oncol Rep,2015,34(5):2351-2356.
[21]Jo E,Park SJ,Choi YS,et al.Kaempferol suppresses transforming growth factor-β1-induced epithelial-to-mesenchymal transition and migration of A549 lung cancer cells by inhibiting akt1-mediated phosphorylation of smad3 at threonine-179[J].Neoplasia,2015,17(7):525-537.
[22]Liu CC,Lin JH,Hsu TW,et al.IL-6 enriched lung cancer stem-like cell population by inhibition of cell cycle regulators via DNMT1 upregulation[J].Int J Cancer,2015,136(3):547-559.
[23]Lee JJ,Kim HJ,Yang CS,et al.A high-affinity protein binder that blocks the IL-6/STAT3 signaling pathway effectively suppresses non-small cell lung cancer[J].Mol Ther,2014,22(7):1254-1265.
[24]胡彥辉,崔庆丽,马东阳,等.片仔癀对肺癌细胞增殖、迁移、侵袭的抑制作用及其机制研究[J].中草药,2019,50(22):5527-5531.
[25]Silva EM,Mariano VS,Pastrez PRA,et al.High systemic IL-6 is associated with worse prognosis in patients with non-small cell lung cancer[J].PLoS One,2017,12(7):e0181125.
[26]Tichelaar JW,Yan Y,Tan Q,et al.A dominant-negative c-jun mutant inhibits lung carcinogenesis in mice[J].Cancer Prev Res(Phila),2010,3(9):1148-1156.
[27]Cooper WA,Kohonen-Corish MR,McCaughan B,et al.Expression and prognostic significance of cyclin B1 and cyclin A in non-small cell lung cancer[J].Histopathology,2009,55(1):28-36.
[28]Wang F,Chen X,Yu X,et al.Degradation of CCNB1 mediated by APC11 through UBA52 ubiquitination promotes cell cycle progression and proliferation of non-small cell lung cancer cells[J].Am J Transl Res,2019,11(11):7166-7185.
[29]Ko E,Kim Y,Cho EY,et al.Synergistic effect of Bcl-2 and cyclin A2 on adverse recurrence-free survival in stage I non-small cell lung cancer[J].Ann Surg Oncol,2013,20(3):1005-1012.
[30]Liu TC,Jin X,Wang Y,et al.Role of epidermal growth factor receptor in lung cancer and targeted therapies[J].Am J Cancer Res,2017,7(2):187-202.
[31]Pal S,Yadav P,Sainis KB,et al.TNF-α and IGF-1 differentially modulate ionizing radiation responses of lung cancer cell lines[J].Cytokine,2018,101:89-98.
[32]Ma X,Song Y,Zhang K,et al.Erratum:Recombinant mutated human TNF in combination with chemotherapy for stage ⅢB/Ⅳ non-small cell lung cancer:a randomized,phase Ⅲ study[J].Sci Rep,2018,8:46953.
[33]Fue M,Miki Y,Takagi K,et al.Relaxin 2/RXFP1 signaling induces cell invasion via the β-catenin pathway in endometrial cancer[J].Int J Mol Sci,2018,19(8):2438.
[34]Neschadim A,Summerlee AJ,Silvertown JD.Targeting the relaxin hormonal pathway in prostate cancer[J].Int J Cancer,2015,137(10):2287-2295.
[35]Li Q,Han Y,Fei G,et al.IL-17 promoted metastasis of non-small-cell lung cancer cells[J].Immunol Lett,2012,148(2):144-150.
[36]He M,Yu W,Chang C,et al.Estrogen receptor α promotes lung cancer cell invasion via increase of and cross-talk with infiltrated macrophages through the CCL2/CCR2/MMP9 and CXCL12/CXCR4 signaling pathways[J].Mol Oncol,2020,14(8):1779.
[37]Tang H,Liao Y,Chen G,et al.Estrogen upregulates the IGF-1 signaling pathway in lung cancer through estrogen receptor-β[J].Med Oncol,2012,29(4):2640-2648.
(2020-12-03收稿 責任编辑:马雪玲,徐颖)
