老化处理对红砂种子生理特性的影响
2021-11-25王鑫鑫苏世平李毅马彦军扁红英
王鑫鑫,苏世平,李毅,马彦军,扁红英
(甘肃农业大学林学院,甘肃 兰州 730070)
一般情况下,在自然条件下种子老化需要花费大量的时间,但是人工老化技术则能够很好地模拟种子在自然状况下的老化和劣变过程,所以很多研究者采用人工老化的处理方法对种子的生理生化和遗传物质结构进行研究[1].
人工老化种子的方法最早由 Roderts E H 等[2]提出,称人工加速种子老化法,即种子在高温高湿的环境下,活力不断降低乃至最后丧失寿命.国内外许多学者对老化条件下种子活力及生理特性的变化做了诸多研究,以期在生理层面揭示种子活力下降的原因,进而探讨延缓种子老化的技术措施[3].Kim等[4]在对红松种子长期贮藏过程中发现,老化处理后种子的丙二醛含量比对照种子高出21倍.Bhanuprakash等[5]在对洋葱的老化种子生理生化研究中发现,老化处理后的种子丙二醛含量比对照组增加26.2%.王鹤冰等[6]、高华伟等[7]通过对芥菜、大豆种子进行老化处理发现,老化处理均不同程度地降低了种子发芽率、种子活力、平均发芽时间,在萌发过程中对逆境条件的适应性减弱,对不良环境的耐受力降低.韩熠等[8]以高粱吉杂127和吉杂355为试材,人工老化处理下对高粱种子生理特性研究表明,老化处理能显著降低氧化还原酶活性和蛋白质代谢能力、同时脂质过氧化作用加剧等.姚侠妹等[9]在高温(40 ℃)、相对湿度95%的条件下,通过对桔梗种子在不同时间的研究中发现,桔梗种子细胞膜受损,抗逆性物质脯氨酸含量增加,造成渗透调节物质积累和保护酶系统受到破坏,致使种子活力丧失.雷雄等[10]在对西伯利亚龙须草(SiberianWildrye)的研究中同样也发现,衰老处理严重破坏了包括碳水化合物代谢、脂肪代谢和抗氧化活性在内的一系列关键途径.因此,人工控制植物种子老化可以为模拟自然老化过程中种子活力的变化提供可靠的理论依据.
红砂(Reaumuriasoongorica)隶属于柽柳科(Tamaricaceae)红砂属(ReaumuriaLinn.),以红砂为建群种或优势种的植被群落是我国温带荒漠的主要植被类型之一[11].红砂具有很强的抗旱、耐盐和集沙能力[12-13],对维护荒漠区生态安全具有重要作用[14].近年来很多学者对红砂进行了大量研究,大多数研究针对干旱或盐胁迫等逆境环境下红砂植株的生理生化特征为主[15-19],刘娟丽[20]通过对红砂种子活力的研究发现,随着老化温度的升高,红砂种子发芽率逐渐下降,其中45 ℃老化处理时种子发芽率显著降低.而有关红砂种子在老化条件下的生理生化特性的研究却未见报道.因此,本研究采用人工老化处理方法,对红砂种子进行不同温度及时间的处理,以期总结出红砂种子在老化处理中的生理响应机制,从而为延长红砂种子贮藏寿命以及种质资源的保存提供可靠依据.
1 材料与方法
1.1 试验材料
供试红砂种子于2019年11月采自甘肃省武威市林业技术服务中心实验基地(N 38°24′、E 103°9′,海拔1 378 m).种子采回后置于室内阴干后搓除果壳,用1 mm孔径的筛子除去杂物及小种子,选取饱满、无机械损伤和无虫害的种子备用.
1.2 人工老化处理
利用人工老化方法对红砂种子进行处理,模拟荒漠区种子的老化劣变过程,为了缩短试验时间,称取挑选好千粒质量为0.97 g的红砂种子,每6 g为一份,每份约为6 185粒种子,共称取3份,设置6个温度处理(25(CK)、30、35、40、45、50 ℃);3个时间处理(24、48、72 h ),置于老化箱内进行处理,各处理完成后,浸种24 h后进行发芽试验及各项生理指标测定.
1.3 指标的测定
发芽率测定:处理后挑选大小、饱满度基本一致的种子装于纸袋中封口备用.在选取好的直径为90 mm且铺有两层滤纸的培养皿底部做好标记,每个处理设置3个重复.对老化处理的种子用10%的84液消毒处理0.5 h,然后用蒸馏水洗净,分别均匀摆放在其中,并且加入蒸馏水,每个培养皿中摆放100粒种子.将装有种子的培养皿放置在实验室中的实验台上,在室温25 ℃下观察发芽情况(种子萌发以胚根突破种皮为标准).每天按时观察并用滴管补充足量水分(蒸馏水),以浸润滤纸为标准,每隔48 h更换一次滤纸,保持苗床干净,防止种子发霉.观察种子发芽间隔时间为24 h,安置发芽当天为第1天,每天按时观察并统计记录种子发芽数量,连续3 d没有种子发芽时结束发芽试验.
发芽率(%)=发芽总数/试验种子数×100%[21]
电导率测定:分别取不同老化处理的种子50 粒,并分别称质量、记录,重复3次.分别用两层纱布包住,做好标记;然后用去离子水对种子进行清洗并用吸水纸吸干种子表面残留水分,分别装入25 mL具塞试管中,同时设置空白对照,分别加入20 mL的去离子水,在室温条件下浸泡24 h摇晃5 min,再用电导率仪测定浸泡液的电导率,最后参照国际种子检验协会《种子活力测定方法手册》[22]计算种子相对电导率.
丙二醛(MDA) 含量采用硫代巴比妥酸比色法,过氧化氢酶(CAT) 活性采用H2O2标准溶液法,过氧化物酶(POD) 活性采用愈创木酚法,超氧化物歧化酶(SOD) 活性采用氮蓝四唑(NBT)光还原法,可溶性蛋白质含量采用考马斯亮蓝(G-250) 染色法、可溶性糖含量采用蒽酮比色法测定[23].
1.4 数据处理
采用Origin 2019b软件作图;采用SPSS 19.0软件进行方差分析及多重比较.
2 结果与分析
2.1 老化对红砂种子发芽率的影响
经老化处理后,发芽率随着老化程度的加深总体呈下降趋势(表1).在同一时间处理下,随着温度的升高呈先上升后下降的趋势,且随着老化温度的升高差异均显著(P<0.05);在24 h发芽率出现峰值,为96%,且比对照高出21.88%.在同一温度处理下,随老化时间的延长,发芽率变化规律比较一致,均表现出下降的变化趋势.在30 ℃和35 ℃处理下均高于对照,分别高出对照20.21%(24 h)、18.18%和16.97%(24 h)、12.79%(48 h)、8.17%(72 h);40、45、50 ℃下随着温度与时间的增加均低于对照,并且在50 ℃时发芽率为零.同时在35 ℃与45 ℃时随着处理时间的延长发芽率差异显著(P<0.05),其余温度处理中发芽率差异不显著(P>0.05).

表1 老化处理对红砂种子发芽率的影响
2.2 老化处理对红砂种子相对电导率的影响
经老化处理后,电导率随老化程度的加深总体呈现上升趋势,老化处理后的电导率均大于CK(图1).在30、35 ℃老化处理时随处理时间的延长,电导率呈上升趋势,且随着老化处理时间的延长差异不显著(P>0.05);40、 45、50 ℃时随老化时间延长,电导率呈先升后降的趋势,随着老化处理时间的延长差异显著(P<0.05).其中老化温度达到50 ℃时电导率出现峰值,为70.23%,与对照相比高出38.3%;在相同老化时间,随着老化处理的温度升高电导率呈现出升—降—升的趋势,且与CK相比均差异显著(P<0.05).老化处理时间在24 h时红砂种子的电导率出现最低值,为56.34%,且略高于对照19.2%.

不同小写字母表示相同老化温度下不同处理时间差异显著(P<0.05),不同大写字母表示同一处理时间不同老化温度间差异显著(P<0.05).
2.3 老化处理对红砂种子过氧化氢酶(CAT)活性的影响
经老化处理后,在同一温度处理下,随老化时间的延长,红砂种子CAT活性变化规律比较一致,表现出下降的变化趋势,且随着处理时间的延长差异显著(P<0.05)(图2).其中50 ℃处理下CAT活性最低,为104.69 U/g,与对照相比减少了72.8%.30 ℃时CAT活性最高,为855.81 U/g,与对照相比增加了55%.相同老化时间,不同老化温度之间,随着老化温度的增加表现出降—升—降的变化趋势,在30~35 ℃处理时呈现下降趋势,且下降幅度最大,为72.0%,35~45 ℃呈现上升趋势,在50 ℃时再次出现下降,且随着老化温度的升高差异显著(P<0.05).与对照相比除30 ℃ 24 h高于对照外,其他处理均低于对照.

不同小写字母表示相同老化温度下不同处理时间差异显著(P<0.05),不同大写字母表示同一处理时间不同老化温度间差异显著(P<0.05).
2.4 老化处理对红砂种子过氧化物酶(POD)活性的影响
经老化处理后,相同老化时间,不同老化温度之间,随着老化温度的升高呈先上升后下降的变化趋势,与对照相比差异显著(P<0.05)(图3).并且在老化温度30 ℃时, POD 的活性出现了峰值,为420 U/g,与对照相比,高出94.1%.老化温度达到50 ℃时POD 的活性最低,为11.56 U/g,比对照减少了53.6%.相同老化温度,随着老化时间的延长POD活性均呈下降的变化规律,且在30~45 ℃差异显著(P<0.05),在50 ℃差异不显著(P>0.05),在老化处理时间到24 h时降幅最高,为95.6%,老化处理时间到72 h时降幅最低,为92.3%.

不同小写字母表示相同老化温度下不同处理时间差异显著(P<0.05),不同大写字母表示同一处理时间不同老化温度间差异显著(P<0.05).
2.5 老化处理对红砂种子超氧化物歧化酶(SOD)的影响
老化处理过后的红砂种子,在相同老化温度,红砂种子的 SOD 活性随老化时间的延长整体上表现出下降的趋势,且变化差异显著(P<0.05,图4).

不同小写字母表示相同老化温度下不同处理时间差异显著(P<0.05),不同大写字母表示同一处理时间不同老化温度间差异显著(P<0.05).
其中在40 ℃时活性出现峰值,为416.20 U/g,高于对照30.54%;同时SOD 活性除40 ℃高于对照外,其余均低于对照.老化处理时间一样时,随着温度的升高SOD活性呈先上升后下降的趋势.老化时间为24 h时,老化温度在30~35 ℃差异不显著(P>0.05),处理时间72 h时出现最低值,与对照相比下降了60.95%.
2.6 老化处理对红砂种子丙二醛(MDA)含量的影响
红砂种子经老化处理后,在温度相同的情况下,随着老化时间的延长,种子中MDA含量的变化除了35 ℃老化处理下逐渐下降外,其余处理下均呈现先下降后升高的趋势,50 ℃老化处理下,各处理时间间差异不显著(P>0.05)(图5).30 ℃老化处理时MDA含量最高,并且高出对照19.5%.老化温度在35 ℃老化时间72 h以及老化温度在45℃老化时间在48、72 h条件下,MDA 含量低于对照,分别比对照降低5.6%、2.7%、1.9%.而其余的不同老化处理条件下与对照相比,分别都高出对照,最大比对照高出19.5%.在老化处理时间相同情况下随着温度的提升,MDA 含量呈升-降-升的趋势,且随着老化温度的变化差异显著(P<0.05).
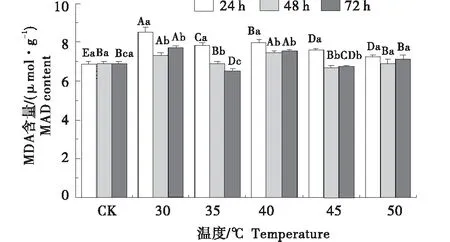
不同小写字母表示相同老化温度下不同处理时间差异显著(P<0.05),不同大写字母表示同一处理时间不同老化温度间差异显著(P<0.05).
2.7 老化处理对红砂种子可溶性蛋白(SP)含量的影响
经老化处理后,老化温度一样时,随着老化时间的延长,红砂种子可溶性蛋白含量呈上升的变化趋势,总体变化较平稳,且差异显著(P<0.05)(图6).其中老化处理在30、35 ℃时与对照相比种子可溶性蛋白增加,在老化温度达到45 ℃时,种子可溶性蛋白含量最低,与对照相比分别下降了91.8%、82.9%、73.0%.在老化时间相同的情况下,随着老化温度的升高,老化的红砂种子可溶性蛋白呈升—降—升的变化趋势,且差异显著(P<0.05).在40 ℃处理72 h时与对照相比增加了11.3%,在 72 h时可溶性蛋白含量出现一个高峰,为31.02 mg/g,与对照相比增加了3.2%,在老化24 h时出现一个低峰,且随着温度升高,24 h下降幅度最大,为92.03%.

不同小写字母表示相同老化温度下不同处理时间差异显著(P<0.05),不同大写字母表示同一处理时间不同老化温度间差异显著(P<0.05).
2.8 老化处理对红砂种子可溶性糖(SS)含量的影响
在老化处理后,SS含量随老化程度的加深总体呈现上升趋势,老化处理后的SS含量均大于CK(图7).在老化处理温度相同时,不同老化时间处理下,除了老化温度在40 ℃处理下,呈现先下降后上升的趋势之外,其余温度均呈先上升后下降的变化趋势,且各老化温度的处理下差异显著(P<0.05).其中老化温度在40 ℃处理下可溶性糖含量出现高峰,为4.59 mg/g,比对照升高了 44.52%.在处理时间不变的情况下,随着老化温度的升高,红砂种子SS含量的变化整体上呈先上升后下降的趋势,并且老化处理后红砂种子SS含量与对照相比均呈现上升趋势,且差异显著(P<0.05).

不同小写字母表示相同老化温度下不同处理时间差异显著(P<0.05),不同大写字母表示同一处理时间不同老化温度间差异显著(P<0.05).
2.9 老化处理对红砂种子脯氨酸(Pro)含量的影响
经老化处理,在老化处理温度相同时,随着处理时间的延长,30、40、50 ℃时红砂种子中Pro含量的变化呈下降趋势,而在35、45 ℃时随着处理时间的延长,红砂种子中Pro含量呈先上升后下降的变化趋势,且各老化温度的处理下差异显著(P<0.05)(图8).在老化处理达到40 ℃时出现峰值,为984.59 μg/g,与对照相比分别提升了40.3%.而在老化处理时间一样时,随着处理温度的上升Pro含量整体呈先下降后上升再下降的趋势,且差异显著(P<0.05),其中老化时间在72 h处理下,种子Pro含量出现最小值,与对照相比减小了32.7%.
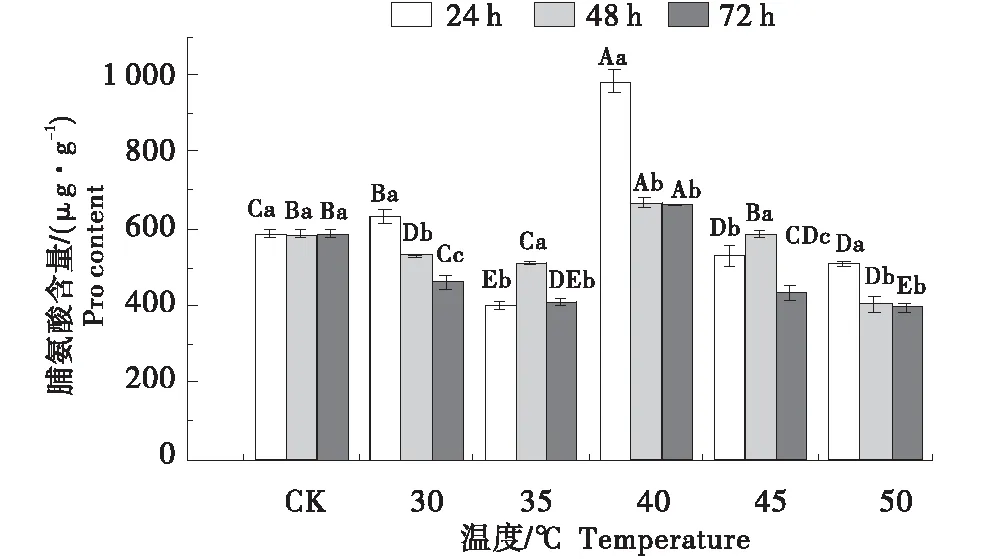
不同小写字母表示相同老化温度下不同处理时间差异显著(P<0.05),不同大写字母表示同一处理时间不同老化温度间差异显著(P<0.05).
3 讨论
人工加速老化法是研究自然老化过程中物质代谢和遗传物质变化的重要方式[24].本研究发现,随着处理温度升高和处理时间延长,红砂种子的发芽率均表现出先上升后降低的趋势,表明老化导致种子活力降低.其中在温度30 ℃时间24 h时最佳,在温度达到50 ℃时发芽率为零.这与周晶等[24]对垂穗披碱草种子活力的研究和张诗慧等[25]对白刺花种子活力的研究结果一致.吴滨等[21]对红砂种子在不同高温下处理研究中也指出,随着温度的增加活力会降低.并且Sananda等[26]通过对两个小麦品种(Hur-468和Huw-234) 的萌发研究发现,两个品种的种子均以24 h老化种子、对照种子和42 h老化种子为最大值.
老化处理可导致植物器官在生理生化方面发生一定的变化[27],随着老化时间的延长和温度的升高,种子的活力不断下降,使膜系统受损[28].因此,膜透性的变化反映了各种逆境下对植物细胞的伤害程度,同时也反映了植物抗逆性的高低[23].本研究表明,红砂种子电导率随老化程度的加深而升高.主要因为老化处理是在高温高湿的条件下进行,破坏膜的结构、损坏膜的功能,并使其透性增大.王春莲等[29]研究玉米杂交老化过程中发现,浸出液电导率随老化程度的加深而升高.这与本试验结果一致,进一步证明了老化对种子抗逆性的影响.植物在逆境下遭受衰老与活性氧积累诱发的膜脂过氧化作用密切相关,其中丙二醛(MDA)是膜质过氧化的中间产物,MDA的增加会损伤生物膜[23].还可以加剧过氧化作用,而且能与蛋白质结合使蛋白质的结构发生变化,导致其催化功能丧失[30-31].本研究中随着老化强度加深红砂种子MDA含量总体较高且呈先上升后下降的趋势,这说明种子抗氧化物的清除能力减弱.高茜[32]通过对红砂种子在贮藏温度条件下生理特性的研究中发现,温度越低,种子贮藏期间有毒物质积累越少,对种子膜系统破坏越小.这与本研究中的结果基本一致,由此可知是由于种子中膜脂不饱和脂肪酸的过氧化作用使膜损伤以及种子活力下降.
在清除自由基的系统中,保护酶处于一个十分重要的地位,他们之间的协同作用可消除自由基,保证种子不受伤害[33-37].本研究发现,随着老化时间的延长,红砂种子CAT、POD和SOD活性均呈先上升后下降的趋势,但CAT活性、POD活性在种子老化达到30 ℃出现拐点而SOD活性是在40 ℃时出现拐点,表明种子活性好,具有更强的萌发能力和一定的滞后性.桓国江等[38]在对红砂种子萌发指标的研究中发现,红砂种子在20~30 ℃下萌发效果最好,这也从生理角度揭示了30~40 ℃是其最佳萌发温度的机理.本研究中对照的POD活性则低于处理后种子的POD活性.这可能是红砂种子在老化过程中,为了适应抗逆环境而使超氧化物阴离子自由基的含量增加,加剧了对种子的毒害作用,提高了酶的活性.由试验结果可以看出,30 ℃条件老化后,红砂种子内抗氧化酶活性较高.
可溶性蛋白质与可溶性糖是种子内不可或缺的营养,对种子发芽与胚的发育起着重要的作用,因此与种子的活力有着密切的关系.本研究中,随着老化强度的加深,种子贮藏营养物质可溶性糖、可溶性蛋白先升高后基本稳定,然后再下降.马向丽等[39]通过对纳罗克非洲狗尾草种子的测定表明,贮藏营养物质可溶性糖、可溶性蛋白基本稳定上升,与本研究结果相似.说明高温高湿能够使红砂种子在老化过程中对蛋白质与糖类消耗大,使得种子新陈代谢保持在最高水平,种子寿命缩短.在正常环境条件下种子体内脯氨酸的含量一般较低,但在逆境条件下,脯氨酸是植物在不良环境下产生的主要渗透调节物质之一[23].在本研究中,随着老化强度的增加,脯氨酸含量总体呈先下降后上升再下降的趋势,可见抗老化性能在逐渐减弱.这与姚侠妹等[9]对桔梗种子的研究结果相符合.由于脯氨酸亲水性极强,能稳定原生质胶体及组织内的代谢过程.因此,脯氨酸的积累,对于保持种子内的水分,保护膜结构避免伤害具有重要意义.
4 结论
本研究以红砂种子为材料,采用高温(30~50 ℃)高湿(相对湿度95%)的方法对种子进行人工老化处理24~72 h,研究红砂种子发芽指标和生理特性指标的变化规律.结果表明,随着老化强度的加深,红砂种子活力变化明显,发芽率降低,内溶外渗严重,质膜受伤害程度高,保护酶活性降低,丙二醛、可溶性糖和可溶性蛋白增加,脯氨酸总体也呈先上升后下降的趋势.通过发芽率和生理层面对老化的红砂种子进行研究得知在逆境环境下,加速了红砂种子老化.因此,老化时间24 h、温度30~40 ℃时红砂种子活力最佳.
