禾花鲤摄食选择与仔稚鱼消化器官发育的研究
2021-11-23罗雨萧蒋士宋梁艺馨庞琳星莫翠琴
刘 婷,黄 凯,林 勇,罗雨萧,蒋士宋,梁艺馨,庞琳星,莫翠琴
( 1.广西大学 动物科学技术学院,广西 南宁 530004; 2.广西水产科学研究院,广西 南宁 530021; 3.全州县科学技术情报研究所,广西 桂林 541500 )
禾花鲤(Cyprinuscarpio),属鲤科温水性鱼类,原产于桂林市全州县龙水乡和融水县苗山等地,是具有地方特色的土著养殖鱼类,因主食稻田禾花并带有特色风味而得名。禾花鲤食性广,生长速度快,繁殖能力强,肉质鲜美,鱼骨柔软无泥腥味。有研究表明,禾花鲤具有4种呈味氨基酸,营养价值较高且矿物质含量丰富,证实其是适宜推广养殖和加工利用的鱼类品种[1-2]。随着稻田种养模式产业化和规模化发展,禾花鲤已成为华南地区稻田养殖对象研究的热点[3-4]。与普通鲤鱼相比,禾花鲤上市规格较小,通常规格为30~50 g/尾,稻田中养殖的禾花鲤旺季价格可达30元/kg。然而,市场面临着需求量大的问题,且在禾花鲤仔稚鱼阶段尚无较为理想的人工开口饵料。
消化器官的发育影响鱼类对摄取食物的消化和吸收程度,且与鱼类的生长发育有关。国内外关于鱼类消化器官发育的组织学研究已有诸多报道,包括鱼(Lizahaematocheila)[5]、泥鳅(Misgurnusanguillicaudatus)[6]、日本白姑鱼(Argyrosomusjaponicus)[7]等,但对禾花鲤仔鱼到稚鱼消化器官发育的组织学变化研究尚未见报道。在早期生长发育过程中,随着消化器官的逐步完善,消化酶活性也随之改变。幼鱼早期不同发育阶段消化酶活性变化已经作为幼鱼发育程度、成活率和人工饲料投喂初始时间的参考依据[8]。因此,笔者测定禾花鲤早期生长、摄食选择与消化酶活性变化,并采用组织切片技术对消化器官组织结构进行观察,了解饲养阶段禾花鲤的食性和消化生理特性,为开发出适宜的禾花鲤仔稚鱼开口饲料提供理论基础和参考。
1 材料与方法
1.1 试验材料
试验鱼为2018年5月2日于广西农业良种海南南繁育种基地进行人工催产孵化获得,亲鱼产卵池规格4.5 m×1.8 m×0.8 m,于200 m2的水池中孵化,孵化水温为29 ℃,经36~48 h后鱼苗孵出,自孵化后第2~10天向池内泼洒熟豆浆,豆浆投喂量为4 kg/666.7 m2,日投喂2次(9:00、16:00),自第11天起每隔2 d使用水蛛乐和益菌宝(广东佛山市顺德区活宝源生物科技有限公司)追肥1次,养殖周期为30 d。
1.2 试验方法
1.2.1 口径与生长测量
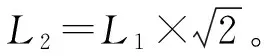
1.2.2 育苗池浮游生物采集定量
在育苗池的不同采样点采集浮游植物:使用采水器采水1 L,倒入水样瓶用15 mL鲁哥氏液固定,沉淀后去掉上清液,浓缩至20~40 mL沉淀物保存于棕色广口瓶内。浮游动物的采集:用采水器采水20 L,经浮游生物网过滤浓缩于100 mL广口瓶中,加入5 mL福尔马林固定。将沉淀物滴满计数框置于显微镜下进行计数,方法参考《水生生物学》[10]。
1.2.3 消化道内含物采集与测定
由于仔鱼较小,无法分离出肠道内含物,因此分别在孵化后第14、18、22、26、30天取20尾鱼肠道,将肠道置于10%福尔马林中固定,在体视解剖镜(XTL-165-VT/MT,凤凰)下解剖取出鱼肠内含物,吸去水分后,分离食物团,置于显微镜(MODEL E100,尼康)下观察。通过计算每份食物体积占肠内含物总体积的百分比,或每类食物出现的频率来评估鱼对食物的选择[11]。计算仔稚鱼对养殖环境中饵料生物的选择性(E):
E=(r-p)/(r+p)
式中,r为某种饵料在肠道食物中所占的比例,p为某种饵料在育苗池中所占的比例。E值为-1.0 (完全不选食)~1.0(总是选食)[12]。
1.2.4 消化器官的组织切片观察
组织切片的制作参考文献[13]的方法,对出膜1~30 d的鱼消化器官(包括口咽腔、食道、肠道、肝胰脏)进行组织结构观察。隔日每次取样20尾。采用10%福尔马林固定,石蜡包埋,使用德国徕卡切片机(RM 2126)进行纵、横方向连续切片,厚度5 μm,苏木精—伊红染色,中性树胶封片,在尼康显微镜下观察拍照。
1.2.5 消化酶活性测定
取样前将鱼置于清水中空腹过夜,前10 d隔天取样1次,后10 d每隔4 d取样1次,1~15 d的仔鱼取全鱼,16~20 d的仔稚鱼剪取腹部进行消化酶活性测定。每次取样2.5 g,每组3个平行样。其中的2.0 g样品在10倍体积冰冻双蒸水里进行组织匀浆,于-80 ℃冰箱冷冻保存,使用南京建成生物工程研究所的酶试剂盒测定酸性蛋白酶、碱性蛋白酶、淀粉酶和碱性磷酸酶的活性。使用生工生物工程(上海)股份有限公司的改良型BCA蛋白浓度试剂盒测定酶蛋白浓度。0.5 g样品保存于-80 ℃冰箱,使用索莱宝的酶试剂盒测定脂肪酶活性。
1.3 数据处理
数据使用Excel软件进行统计,采用软件SPSS 21.0进行单因素方差分析,所得数据用平均值±标准差表示。
2 结 果
2.1 禾花鲤仔稚鱼口径的变化与仔鱼生长形态
2.1.1 禾花鲤仔稚鱼生长与口径变化
鱼孵出后第3天测量到口径大小,3 d后口径随着日龄的增加而变化,口径长(y,mm)与日龄(x,d)的关系式为:y=0.0033x2+0.0421x+0.3774,r2=0.9754(图1a)。在前10 d生长速度较为缓慢,从12 d开始生长速度明显加快,体长和全长均随着日龄的增加而增长(图1b)。体长(y,mm)与日龄(x,d)的关系式为:y=0.1076x2-0.75x+6.6221,r2=0.9874;全长(y,mm)与日龄(x,d)的关系式为:y=0.1399x2-0.904x+7.3907,r2=0.9884。
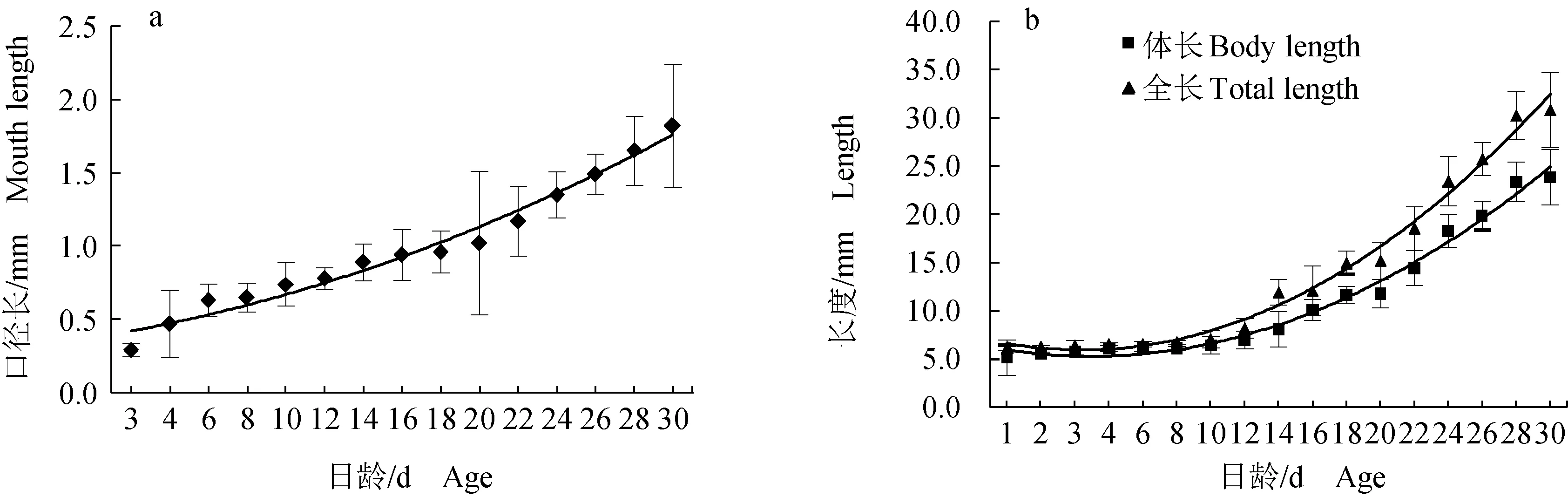
图1 禾花鲤仔稚鱼口径长(a)与体长、全长(b)变化Fig.1 Changes in mouth length (a), body length, and total length (b) of rice flower carp P. merus larvae and juveniles
2.1.2 禾花鲤仔鱼的形态变化
1 d仔鱼在孵化初期尚未开口,营养主要来源于卵黄囊(图2a);2 d仔鱼卵黄囊尚未完全消失,但已出现口裂、鳃弓(图2b);发育至第3 d,仔鱼开口摄食(图2c)。10 d首次观察到鳞片,鳞片的出现标志着仔鱼期向稚鱼期的转变;生长至17 d,所有鳞片基本长齐,为稚鱼过渡到幼鱼的阶段。
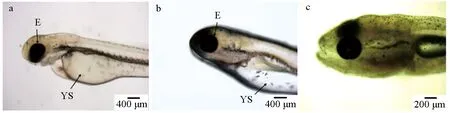
图2 禾花鲤仔鱼的形态特征Fig.2 Morphological characteristics of rice flower carp P. merus larvaea.1 d仔鱼; b.2 d仔鱼; c.3 d仔鱼; YS.卵黄; E.眼.a.1 day old larva; b.2 day old larva; c.3 day old larva; YS.yolk sac; E.eye.
2.2 禾花鲤育苗池的浮游生物组成
14~30 d育苗池中浮游动物的组成以轮虫数量最多,随着养殖天数的增加,轮虫数量逐渐上升,但在26 d明显减少,30 d又增加(图3a)。枝角类和桡足类的数量呈现规律性上下浮动。浮游植物组成以蓝藻门和硅藻门为主,在22 d后蓝藻门数量逐渐降低(图3b)。硅藻门数量呈现先降低22 d后逐渐增加的趋势。绿藻门自18 d开始出现,26 d开始可观察到甲藻门和黄藻门的少量个体。
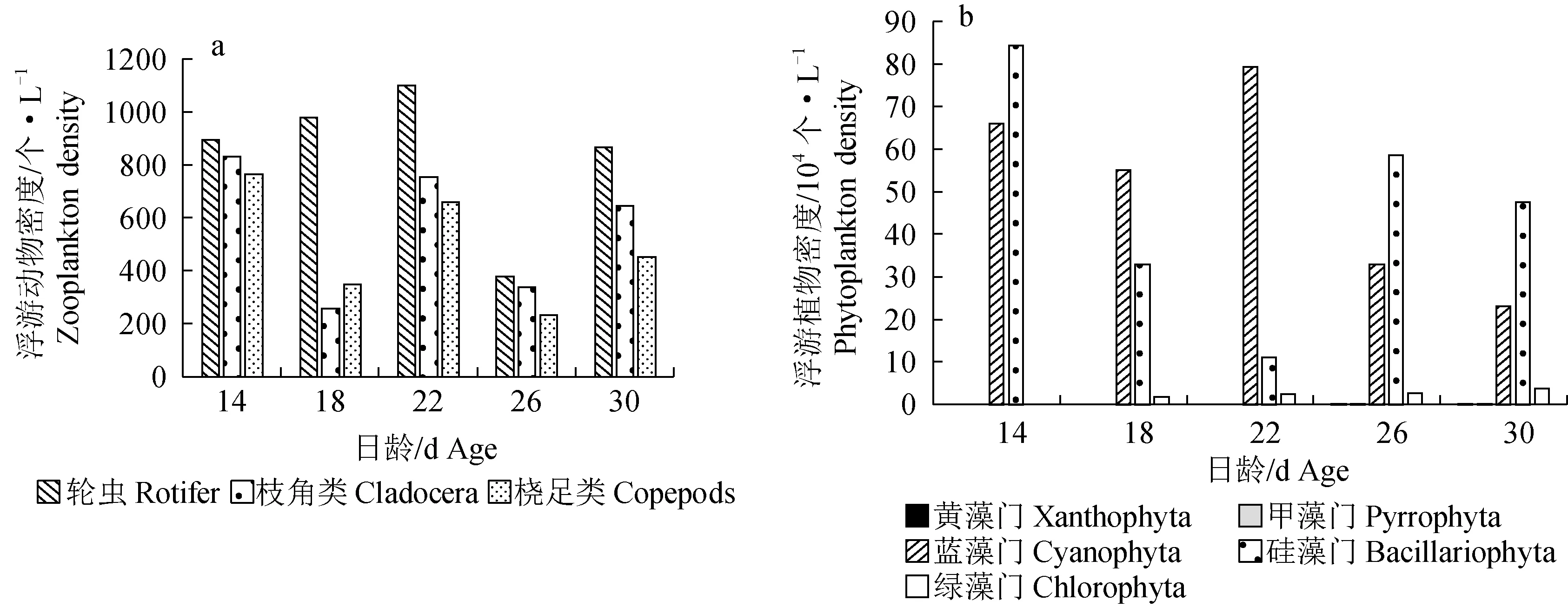
图3 禾花鲤育苗池浮游生物饵料组成Fig.3 Composition of plankton food in the seedling pond of rice flower carp P. merus
2.3 禾花鲤稚鱼肠道内含物的饵料组成
14~30 d稚鱼肠道内含物的浮游植物组成主要以蓝藻门和硅藻门为主,绿藻门、甲藻门和黄藻门较少或几乎观察不到;22 d前,蓝藻门和硅藻门共约占当天总体组成比例的40%~60%,22 d后蓝藻门和硅藻门的比例有所下降(图4)。枝角类和桡足类组成比例随着日龄增加逐渐提高,22 d后,肠道内含物中生物总体组成转变为以枝角类和桡足类为主,共约占当天总体组成的40%~50%;轮虫数量逐渐减少,26 d未观察到轮虫,30 d又观察到少量轮虫,约占1%。在22 d首次观察到摇蚊幼虫,且比例随日龄逐渐增大。肠道中部分已消化成糊状的食物占比相对较大,归类为其他。
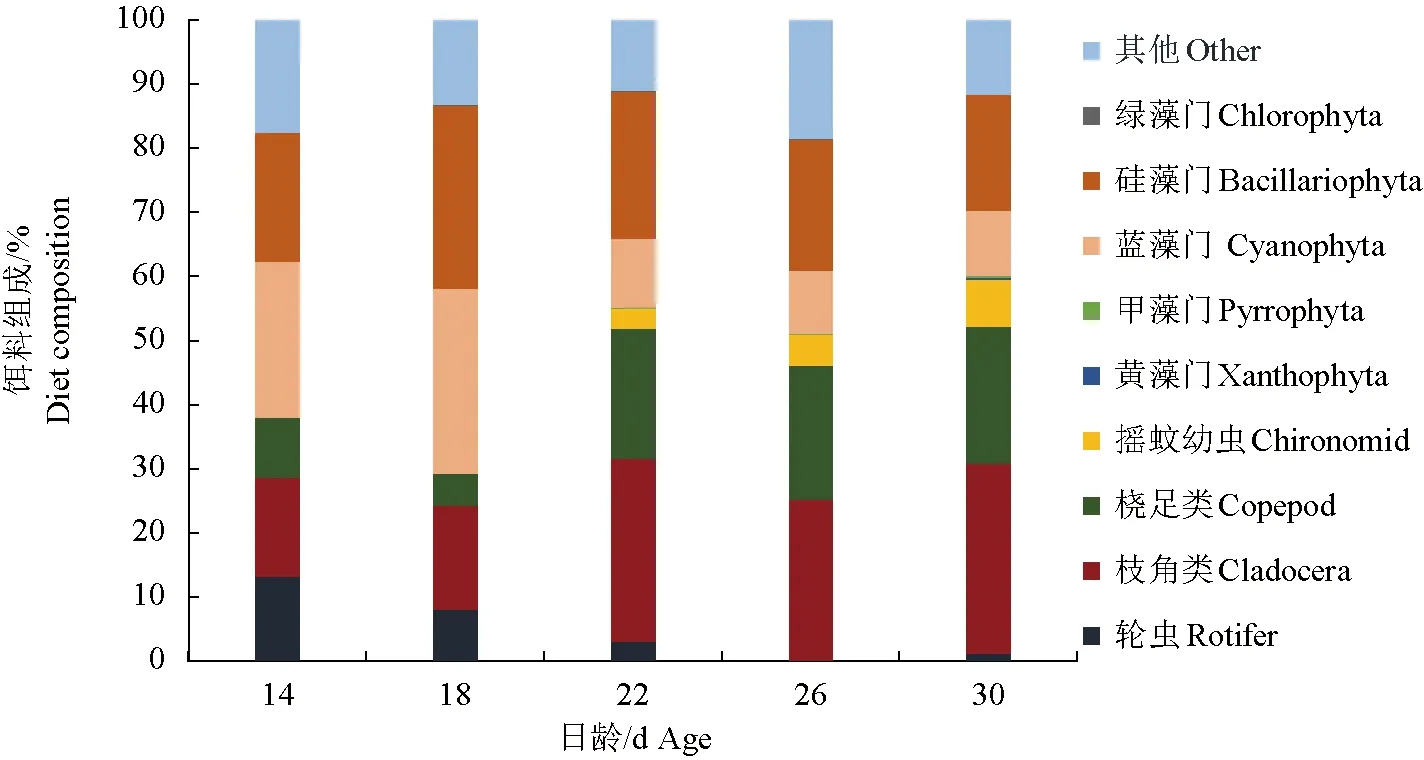
图4 不同日龄的禾花鲤肠道内含物组成Fig.4 Food item composition of intestinal contents of rice flower carp P. merus with different daily age
2.4 禾花鲤稚鱼的摄食选择性指数
14~30 d稚鱼对枝角类和桡足类的偏好性强,摄食选择性指数值均接近1,成为其重要的食物来源(图5)。对于蓝藻门、绿藻门的偏好性极差,摄食选择性指数为0或负数,不会对其主动选食,为被动摄食。甲藻门摄食选择性指数时正时负,摄食选择不稳定。在22 d,禾花鲤对黄藻门、甲藻门和硅藻门有明显的选择性,摄食选择性指数为正。在26 d前,对轮虫的偏好性强,摄食选择性指数在0.9以上;在26 d,对轮虫的摄食选择性指数为-1,完全回避摄食,26 d后逐渐恢复摄食。
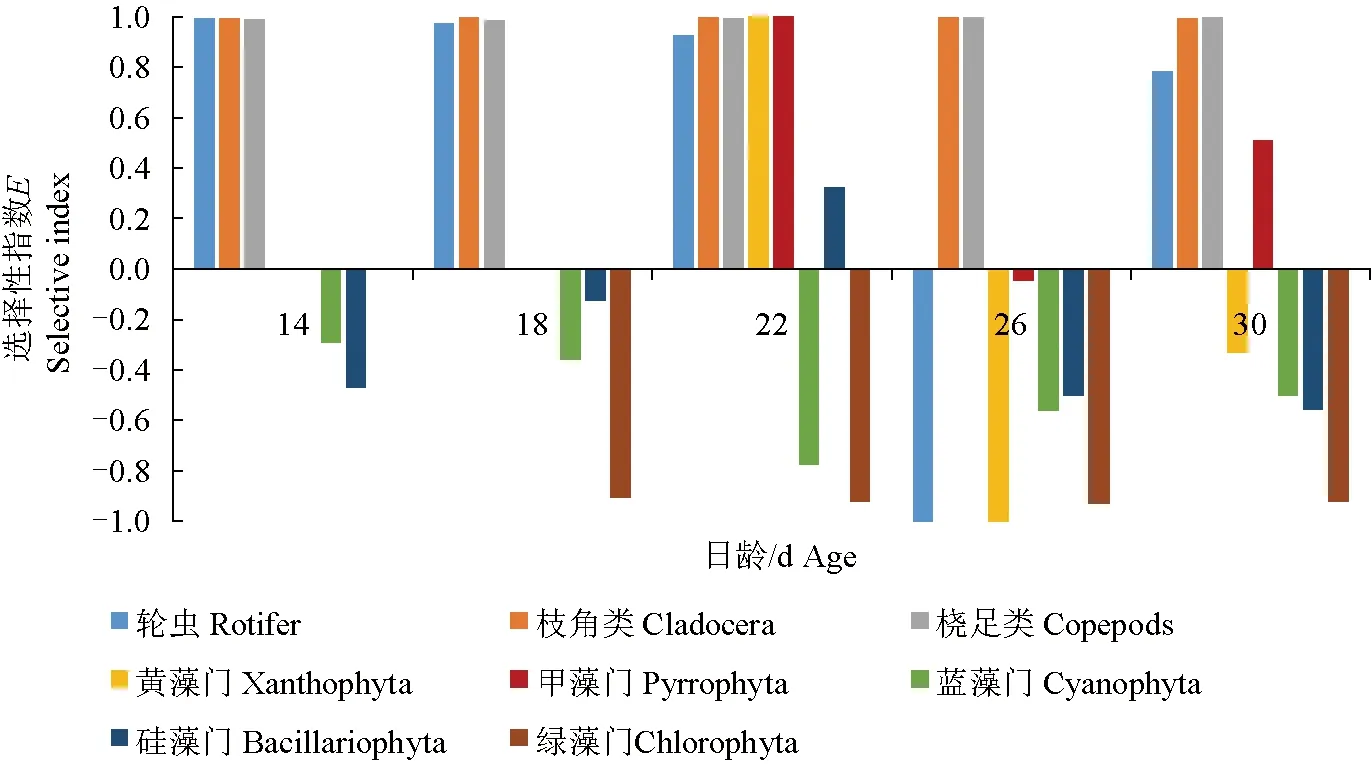
图5 禾花鲤对不同饵料的选择性指数Fig.5 The selectivity index E of food items in rice flower carp P. merus
2.5 禾花鲤仔稚鱼消化器官的组织结构观察
2.5.1 口咽腔
第3天仔鱼开口,口腔表面的黏膜层发育出复层扁平上皮及少量杯状细胞,但未发现味蕾,黏膜层较薄,咽部出现角质垫(图6a)。发育至第5天,黏膜层加厚,可见黏膜下层、肌肉层、浆膜层,杯状细胞逐渐增多,味蕾开始出现,黏膜上皮由直线型变为“凹”型,随后逐渐发育出齿囊(图6b、c)。随着日龄增加,黏膜层逐渐加厚,黏液细胞增多(图6d);第21天,口咽腔已基本发育完全(图6e)。
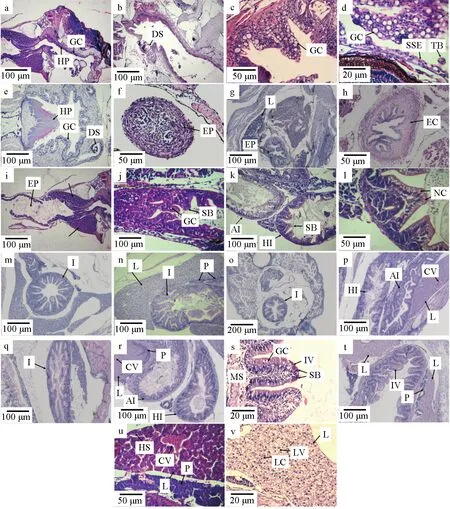
图6 禾花鲤仔稚鱼消化器官的组织学变化Fig.6 Histologic changes in digestive organs of rice flower carp P. merus larvae and juvenilea.3 d口咽腔纵切; b.6 d口咽腔纵切; c.13 d口咽腔横切; d.13 d口咽腔纵切; e.21 d口咽腔横切; f.8 d食道横切; g.19 d食道横切; h.30 d食道横切; i.3 d肠道纵切; j.6 d肠道纵切; k.12 d肠道纵切; l.12 d肠道纵切; m.15 d 肠道横切; n.15 d肠道及肝胰脏纵切; o.17 d肠道及肝胰脏横切; p.17 d肠道纵切; q.19 d 肠道纵切; r.23 d肠道及肝胰脏纵切; s.29 d肠道横切; t.30 d肠道及肝胰脏横切; u.8 d肝胰脏纵切; v.29 d肝胰脏横切. HP.角质垫; GC.杯状细胞; DS.齿囊; SSE.复层扁平上皮; TB.味蕾; EP.食道; EC.食物团; L.肝脏; SB.纹状缘; I.肠; AI.前肠; HI.后肠; NC.核上内容物; MS.肌肉层; CV.中央静脉; P.胰脏; IV.肠绒毛; HS.肝血窦; LC.肝脏细胞; LV.肝脏空泡.a.longitudinal section of oropharyngeal cavity in 3 d; b.longitudinal section of oropharyngeal cavity in 6 d; c.cross section of oropharyngeal cavity in 13 d; d.longitudinal section of oropharyngeal cavity in 13 d; e.cross section of oropharyngeal cavity in 21 d; f.cross section of esophagus in 8 d; g.cross section of esophagus in 19 d; h.cross section of esophagus in 30 d; i.longitudinal section of intestine in 3 d; j.longitudinal section of intestine in 6 d; k.longitudinal section of intestine in 12 d; l.longitudinal section of intestine in 12 d; m.cross section of intestine in 15 d; n.longitudinal section of intestine and hepatopancreas in 15 d; o.cross section of intestine and liver in 17 d; p.longitudinal section of intestine in 17 d; q.longitudinal section of intestine in 19 d; r.longitudinal section of intestine and hepatopancreas in 23 d; s.cross section of hepatopancreas in 29 d; t.cross section of intestine and hepatopancreas in 30 d; u.longitudinal section of hepatopancreas in 8 d; v.cross section of liver in 29 d. HP.horny pad; GC.goblet cell; DS.dental sac; SSE.stratified squamous epithelium; TB.taste buds; EP.esophagus; EC.esophageal contents; L.liver; SB.striated border; I.intestine; AI.forgut; HI.hindgut; NC.supran uclear content; MS.muscle layer; CV.central vein; P.pancreas; IV.intestinal villus; HS.hepatic sinusoid; LC.liver cell; LV.liver vacuole.
2.5.2 食道
食管初始为半封闭状态,食道短且狭窄,由复层鳞状上皮构成黏膜层,发育至第8天,食道仍未完全贯通(图6f),后期逐渐出现褶皱及杯状细胞,黏膜层出现横纹肌纤维。发育至第19天食道可见大量杯状细胞,横纹肌纤维逐渐增厚,但未见黏膜下层及肌层(图6g),至第30天肌层相继出现(图6h)。
2.5.3 肠道
仔鱼在刚孵出时消化管位于卵黄囊与脊索之间,呈直管状,出膜后第2天卵黄囊变小(图2)。第3天逐渐消失,仔鱼开口后进入混合营养期,肠腔内可见食物团,出现褶皱及单层柱状细胞,但褶皱不明显(图6i)。第6天出现较薄的环肌,首次观察到杯状细胞和纹状缘(图6j)。随着日龄增加,肠腔褶皱越来越明显,高度不断增加,杯状细胞逐渐增多,发育至第12天,出现前肠和后肠,最先出现核上内容物的是前肠(图6k、l)。后期肠道不断增加,形成复杂的弯曲形状(图6p、r),发育至第30天,纹状缘已经非常明显,杯状细胞丰富,肠道的形态发育和细胞分化基本完善(图6s)。
2.5.4 肝胰脏
在仔鱼生长至第3天时,可见肠道两侧出现疑似肝脏细胞团,肝细胞形态不明显,细胞核颜色较深(图6i)。随后体积不断增大,发育至第8天可观察到明显的中央静脉及肝细胞索,随着营养积累,肝脏开始出现空泡(图6u),第29天肝脏空泡增多(图6v)。胰脏在第8天观察到,且分布较复杂散乱,呈弥散型(图6n,r,t,u)。
2.6 禾花鲤仔稚鱼消化酶活性变化
仔鱼开口前就具有消化酶活性(图7)。8~10 d脂肪酶活性升至最大值,接着出现下降,14~26 d基本稳定,26 d后急剧增加(图7a)。淀粉酶活性从开口后第4 d逐渐下降,最低值出现在第8天,随后逐渐上升再下降,直到第30天达到最大值(图7b)。碱性蛋白酶活性在开口后有明显上升;酸性蛋白酶在第14天和第26天出现峰值;且酸性蛋白酶和碱性蛋白酶的活性变化呈互补关系,当酸性蛋白酶活性升高时,碱性蛋白酶活性降低,反之亦然(图7c)。第4天碱性磷酸酶活性出现峰值;第8天出现最高值,活性为0.21(图7d)。
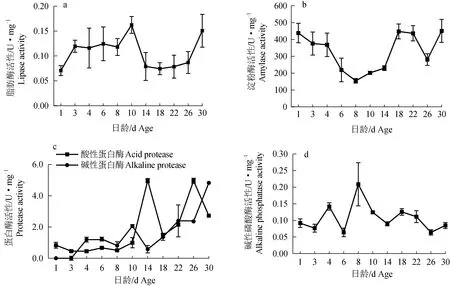
图7 禾花鲤仔稚鱼消化酶活性变化Fig.7 Changes in digestive enzyme activities of rice flower carp P. merus larvae and juvenile
3 讨 论
3.1 禾花鲤的生长与稚鱼后期摄食选择
第3天仔鱼即开口摄食,混合营养期持续不到1 d。混合营养阶段是仔鱼培育过程的关键时期,其组织形态和生理机能都将发生改变[14],此时需要给予仔鱼营养丰富的适口饵料以提高其成活率。第10天部分禾花鲤已经长出鳞片,且10 d前出现生长缓慢的情况。有研究表明,在鳞片出现前后鱼全长的日增长会下降,是因为用于生长的部分能量被用于了鳞片形成[15]。
仔鱼口径长短与摄食的饵料规格密切相关。有研究报道,鲤鱼开口摄食的体长为6.6 mm,口径为0.57 mm,能摄食285~425 μm的饵料,不能摄食水蚤和裸腹溞(Moina)成体,但可将其幼体作为摄食对象[9]。禾花鲤开口摄食的体长和口径长相对较小,分别为5.74、0.29 mm,仔鱼从开口第3天至第30天,口径增大逾6倍,为1.82 mm。参考李云兰等[16]的方法(饲料粒径=口径长×75%×25%),计算得到禾花鲤的适宜饲料粒径,孵化后3~14 d为50~170 μm,14~30 d为170~350 μm。推测14 d前可能主要以小型轮虫幼体(40~150 μm)和小型藻类(<100 μm)为食,随着口径长增大而主动选择摄食体型更大的枝角类和桡足类,14 d后对浮游动物的摄食量也逐渐加大。至第22天时,首次从禾花鲤稚鱼体内观察到摇蚊幼虫,摇蚊幼虫属于底栖生物,体现禾花鲤杂食的特性。
禾花鲤摄食选择与育苗池中浮游生物组成有一定关联。在14~30 d,育苗池中浮游植物主要以蓝藻门和硅藻门为主,优势种分别为微囊藻和直链藻,但摄食选择性结果显示,禾花鲤对其无明显的主动选择性,这可能与养殖环境中它们占主要比例有关,导致禾花鲤被动选择食物。蓝藻门中藻类大多含有微囊藻毒素,鱼类摄食大量蓝藻会对其组织发育造成损伤。但有研究表明,鳙鱼(Aristichthysnobilis)可长期耐受高含量的微囊藻毒素[17]。而禾花鲤属于被动摄食蓝藻,是否对蓝藻有很强的消化能力和耐受力,还需深入研究。育苗池中蓝藻数量较多,表明应及时调整水质环境,以达到提高苗种成活率的目的。
26 d前育苗池中浮游动物以轮虫数量最多,稚鱼开始主动选择摄食轮虫。26~30 d禾花鲤对轮虫摄食出现从无到恢复摄食的情况。推测一方面与育苗池中轮虫数量出现先减后增有关,另一方面与消化器官发育完善而需摄食高营养的动物饵料有关。因此,在14~30 d,禾花鲤对浮游动物的摄食量逐渐升高,且主要以大型蛋白动物性饵料为食,说明此时需要摄入大量营养(蛋白质和脂肪)才能满足稚鱼的生长发育,应给予营养均衡的配合饲料并混合浮游动物投喂。其他藻类数量较少,摄食量也少。
3.2 禾花鲤消化器官发育与消化酶变化
仔鱼开口后消化酶活性会受到消化器官生长发育的影响。3 d后仔鱼各部分消化器官已开始分化,第6天首次从肠道内观察到杯状细胞,肠道中的杯状细胞可分泌黏液和消化酶,促进食物的消化吸收。此时也出现纹状缘,可增大肠道吸收表面积,它是鱼类幼体发育过程中获得成体消化模式的重要标志和关键步骤[18]。第8天碱性磷酸酶出现最大值,说明肠道功能发育完善[19]。第4天碱性磷酸酶活性出现峰值,可能受仔鱼开口摄食的影响和与肠道功能开始发育有关。8 d后淀粉酶生产的中心器官肝胰脏逐渐发育完善,酶活性随之增强。脂肪酶活性在8~10 d突然增加达到最大值,可能与第8天肝脏逐渐发育出中央静脉和肝细胞索,并开始贮存糖原进行营养积累有关;后期脂肪酶活性下降可能与仔鱼组织蛋白的增加有关[20]。本试验结果显示,禾花鲤仔鱼在开口前已具有消化酶活性,与刘亚秋等[21-22]研究结果一致,其认为仔鱼开口前消化酶活性受基因决定。
3.3 禾花鲤消化器官发育与摄食消化
3 d仔鱼开口摄食,口腔内出现少量杯状细胞,对坚硬食物起到润滑作用。5 d观察到咽齿齿囊,6~10 d长出咽齿,禾花鲤的咀嚼能力得到加强。10 d前,仔鱼食道未完全打开,无法完全适应外源性营养摄入,生长较缓慢。根据讨论3.1节可知,前期主要以微小的藻类和轮虫幼体为食。因此,在育苗池培育小型浮游动物的同时也要培育一定量的浮游植物,为仔鱼提供丰富的食物来源。10 d后肠道功能逐渐加强,发育至第12天出现了核上内容物和空泡结构,说明肠道细胞已可进行胞饮作用和细胞内消化吸收蛋白质大分子[18]。第14天和第26天酸性蛋白酶出现峰值,预示着肠道消化蛋白机能的逐渐完善,14 d后食性转变为动物性,生长速度明显加快。因此,稚鱼期的禾花鲤更倾向于摄食体格较大的浮游动物(枝角类和桡足类) 来为机体提供能量,进而导致第26天时对轮虫偏好性降低,摄食由主动变为被动。30 d消化器官基本发育完全,更需摄食营养丰富饵料进行能量补充。
3.4 禾花鲤消化酶活性变化与饵料消化利用
由本试验结果看,2~4 d是仔鱼内源性营养转换为外源性营养的转换期;10~17 d是仔鱼转变为稚鱼的转变期。仔鱼在转变期间摄食不足时,机体会通过水解体内贮存的脂肪来补充能量,此时可适量增加饵料脂肪的占比。转换期前仔鱼具有较高的淀粉酶活性,这可能与本身卵黄囊中含有较丰富的糖原有关[19]。转换期后淀粉酶活性逐渐降低,可能是卵黄囊消失使糖原下降所致。这反映了8 d前仔鱼发育阶段的碳水化合物被用作能量消耗,不是作为营养被吸收[21]。8 d后淀粉酶活性随之增强,说明此时仔鱼可能开始适应对碳水化合物的利用[23];22 d后淀粉酶活性先降后升,可能是消化器官发育与糖代谢调节不同步所致。高活性淀粉酶可促进藻类的消化,第22天禾花鲤对黄藻、甲藻和硅藻有明显的摄食,刺激淀粉酶的合成和分泌。有研究表示,鲤鱼可有效地利用碳水化合物作为能量来源[24]。因此,仔鱼后期时可在饵料中添加糖的占比为机体提供能量。
禾花鲤仔鱼开口前碱性蛋白酶活性较低,开口摄食后活性增加,可能在一定程度上受到外源食物刺激酶分泌增加的影响。禾花鲤仔稚鱼前期(4~10 d)时碱性蛋白酶活性较酸性蛋白酶高,14 d后稚鱼主要以动物蛋白饵料为食,且转变为以酸性蛋白酶消化蛋白为主。吉红等[8]认为,由于消化器官和组织发育的完善,对蛋白消化起主导作用的酶种类会发生转变;常青等[25]表示,在仔稚鱼后期酸性蛋白酶在蛋白消化过程中更为重要,且在仔鱼发育早期较高活性的碱性蛋白酶可以补偿酸性蛋白酶的缺乏。说明两者在早期发育阶段可以起到互补作用。
4 结 论
综上,禾花鲤属杂食性鱼类,仔稚鱼的摄食与消化器官发育、消化酶活性、养殖环境中饵料组成有关;仔鱼开口后消化酶活性会受消化器官生长发育的影响;随着消化器官发育的完善,禾花鲤需要摄食营养丰富饵料进行能量补充。因此,为促进禾花鲤仔稚鱼的生长和提高育苗成活率,在苗种培育过程可根据不同发育时期消化系统发育、摄食选择以及消化酶变化的综合体现来相应调整饲料配方。本试验结果表明,3~14 d禾花鲤饲料适宜粒径为50~170 μm,此时可在饵料中增加糖的占比,或在育苗池中同时培养浮游动物和植物;在转变期10~14 d可适量增加饵料中脂肪的占比;14~30 d禾花鲤食性为杂食偏动物型,此时需营养均衡的配合饲料(蛋白和脂肪)并混合浮游动物投喂,饲料适宜粒径为170~350 μm。
