藏红花素对氯化锂-匹罗卡品致痫大鼠的脑保护作用及机制研究*
2021-11-22江冉冉王莉平李晓东
江冉冉,王莉平,李晓东,闫 桦
(1.冀中能源峰峰集团有限公司总医院,河北 邯郸 056200;2.邯郸市中心医院,河北 邯郸 056001)
癫痫(epilepsy,EP)是一种因大脑神经元同步异常放电而引发的脑功能障碍综合征,我国EP发病率均7‰,是仅次于脑卒中的第二大神经系统疾病,严重危害着人类的生命健康。EP发作是神经元过度兴奋和自由基堆积的过程,发作时间超过30 min即可造成大脑神经元损伤或丧失,其中海马神经元最为敏感。有研究发现,氧化应激和炎症反应在EP所致脑损伤过程中发挥着重要作用[1-2],而内质网应激是机体调控氧化应激和炎症反应的关键通路[3-4]。藏红花素(又名西红花苷)为中药藏红花的主要活性成分,具有良好的抗氧化、抗炎活性[5-6]。有研究发现藏红花素能够通过抑制氧化应激和炎症反应对缺血性脑损伤起到保护作用[7],但藏红花素对EP所致脑组织损伤及内质网应激通路的影响尚未见文献报道。本实验通过制备EP大鼠模型,研究藏红花素对氯化锂-匹罗卡品(Li-Pc)所致EP大鼠脑组织的保护作用及其机制,现将研究结果报告如下。
1 材料与方法
1.1 实验动物8周龄SPF级健康雄性SD大鼠120只,体质量230~250 g,购自河北省实验动物中心,生产许可证号:SCXK(冀)2018-004。饲养于邯郸康业制药有限公司,使用许可证号:SCXK(冀)2019-003。适应性饲养7 d后开展实验,饲养条件:光照黑暗各12 h交替,室温23~25℃,相对湿度55%~65%。本实验方案经冀中能源峰峰集团有限公司总医院伦理委员会批准,伦理批件号:FFZY[K]字2019-028。
1.2 药物与试剂 藏红花素(美国Sigma公司,纯度≥98%,批号:17304-1G);注射用丙戊酸钠(VPA,四川科瑞德制药股份有限公司,批号:20190826);MDA检测试剂盒(批号:191107)、SOD检测试剂盒(批号:190830)、CAT检测试剂盒(批号:191214)(南京建成生物工程研究所);TNF-α试剂盒(货号:SEKR-0009)、IL-1β试剂盒(货号:SEKR-0002)、IL-6试剂盒(货号:SEKR-0005)(北京索莱宝生物技术有限公司);调节蛋白78(GRP78,货号:bs-1219R)、增强子结合蛋白同源蛋白(CHOP,货号:bs-1630R)、激活型半胱氨酸蛋白酶-12(Cleved Caspase-12,货号:bs-1105R)、B细胞淋巴瘤基因-2(bcl-2,货号:bs-20352R)、bcl-2相关X蛋白(Bax,货号:bsm-52316R)、核因子-κB(NF-κB,货号:bs-0465R)、β-actin(货号:bs-0061R)(北京博奥森生物技术有限公司)。
1.3 主要仪器RM2125型石蜡切片机(德国Leica公司);CKX31型倒置光学显微镜(日本Olympus公司);UV762型紫外-可见分光光度计(上海楚定分析仪器有限公司);Synergy-HT型多功能酶标仪(美国BioTck公司);SE300型电泳仪、TE22型转膜仪(美国Hoefer公司);EC3 410型化学发光成像系统(美国UVPN公司)。
1.4 分组与造模 将120只大鼠按照随机数字表法分为正常对照组,模型组,丙戊酸钠组和藏红花素低、中、高剂量组,每组20只。除正常对照组外,其余各组均采用氯化锂-匹罗卡品(Li-Pc)化学点燃法制备EP大鼠模型[8]:以127 mg/kg剂量腹腔注射Li溶液,20 h后以15 mg/kg剂量背部皮下注射Pc溶液;空白对照组各步骤均同步给予0.9%氯化钠溶液。造模成功判断标准[9]:按照Racine分级标准对EP发作进行分级(见“1.6.1”),连续出现5次4~5级EP发作即认定为造模成功。
1.5 实验给药 各组大鼠均于注射Pc前30 min腹腔注射给药1次,丙戊酸钠组腹腔注射给予浓度60 mg/mL的丙戊酸钠溶液(注射剂量5 mL/kg)[10],藏红花素低、中、高剂量组分别腹腔注射浓度1、2、4 mg/mL的藏红花素(注射剂量5 mL/kg)[11],模型组和正常对照组同步腹腔注射给予0.9%氯化钠溶液(注射剂量5 mL/kg)。
1.6 观察指标
1.6.1 EP发作程度分级Pc注射后2 h,对照Racine分级标准对EP发作进行分级[9]:无发作为0级;口周及面部肌肉抽搐为1级;点头或频繁抖动为2级;前肢局限性阵挛为3级;前肢局限性阵挛伴后肢站立的全身强直性发作为4级;前肢局限性阵挛伴有站立并摔倒、翻滚的全身强直阵挛发作为5级。
1.6.2 HE染色法行大脑海马组织病理学检查Pc注射24 h后,分别随机取各组大鼠10只,腹腔注射10%水合氯醛溶液(3 mL/kg)实施麻醉,脊椎脱臼处死,断头取脑,去除小脑、脑干后置于4%多聚甲醛溶液固定72 h,石蜡包埋、5μm厚度切片、梯度乙醇脱蜡和二甲苯透明,然后行HE染色,通过光学显微镜观察各组大鼠海马组织病理学改变。
1.6.3 TUNEL法观察海马神经元凋亡水平 取脑组织石蜡切片,经梯度乙醇脱蜡和二甲苯透明后,按照TUNEL试剂盒操作说明进行染色处理,封片后通过光学显微镜观察各组大鼠海马神经元凋亡状态;凋亡指数(Apoptosis Index,AI)计算:每只大鼠选取同部位5张染色切片,每张切片选取5个不重叠视野计数凋亡细胞数和细胞总数,取平均值,AI(%)=(凋亡细胞数/细胞总数)×100%。
1.6.4 海马组织生化制备检测Pc注射24 h后,分别取各组剩余的10只大鼠,麻醉后脊椎脱臼处死,在冰上断头取脑并剥取海马组织,加入适量4℃裂解液后研磨匀浆,4℃、3 000 r/min离心(离心半径10 cm)10 min取上清液,然后遵照试剂盒操作方法进行处理后,通过紫外-可见分光光度计检测各组大鼠海马组织MDA含量和SOD、CAT活力,通过酶标仪检测TNF-α、IL-1β、IL-6含量。
1.6.5 Western blotting法检测海马组织蛋白表达 取海马组织匀浆液,4℃、12 000 r/min离心(离心半径10 cm)25 min取沉淀,通过BCA法检测蛋白总浓度后95℃水浴使蛋白变性,30μg蛋白量上样、SDS-PAGE胶电泳、湿法转PVDF膜、5%脱脂奶粉37℃封闭1 h后,滴加目标蛋白和β-actin一抗后4℃孵育过夜,洗膜后滴加IgG二抗室温孵育1 h,洗膜后滴加DAB显色,以β-actin为内参半定量目标蛋白表达,检测海马组织糖调节蛋白78(GRP78)、增强子结合蛋白同源蛋白(CHOP)、激活型半胱氨酸蛋白酶-12(Cleved Caspase-12)、B细胞淋巴瘤基因-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、核因子-κB(NF-κB)蛋白表达情况。
1.7 统计学方法 采用SPSS 25.0进行统计分析,计量资料以(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;EP发作等级比较采用Kruskal-Wallis H检验,两两比较采用Nemenyi法检验;P〈0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠EP发作等级比较 正常对照组大鼠未见EP发作;模型组大鼠EP发作等级明显高于正常对照组(P〈0.01);丙戊酸钠组和藏红花素中、高剂量组大鼠EP发作等级明显低于模型组(P〈0.01);藏红花素低剂量组大鼠EP发作等级与模型组比较,差异无统计学意义(P〉0.05);藏红花素高剂量组EP发作等级明显低于丙戊酸钠组(P〈0.01)。(见表1)

表1 各组大鼠EP发作等级比较
2.2 各组大鼠大脑海马组织病理学改变情况 正常对照组大鼠大脑海马神经元呈圆形或椭圆形,排列整齐,核膜、核仁边界清晰;模型组大鼠海马神经元可见形态不规则、排列紊乱、层次不清,核膜不清,核仁固缩、偏移、深染等病理学形态结构改变;与模型组比较,丙戊酸钠组和藏红花素低、中、高剂量组大鼠海马神经元病变呈不同程度减轻;藏红花素高剂量组大鼠大脑海马神经元形态较规则、排列较整齐、核膜核仁边界清晰,效果优于藏红花素低、中剂量组。(见图1)
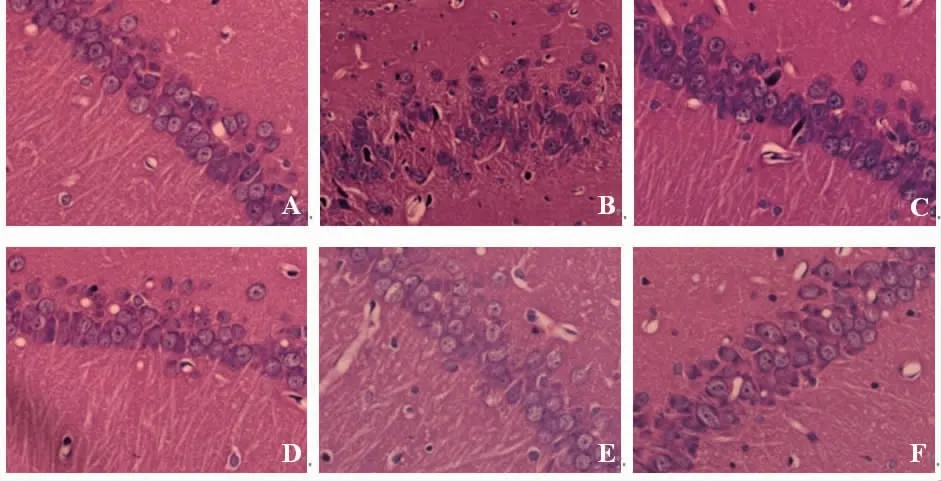
图1 各组大鼠大脑海马组织病理学改变比较(HE,×400)
2.3 各组大鼠海马神经元凋亡情况比较 与正常对照组比较,模型组大鼠海马神经元凋亡数量明显增多;与模型组比较,丙戊酸钠组和藏红花素中、高剂量组大鼠海马神经元凋亡数量明显减少;藏红花素低剂量组大鼠海马神经元凋亡数量与模型组比较,未见明显变化;与丙戊酸钠组比较,藏红花素高剂量组大鼠海马神经元凋亡数量明显减少。(见图2)
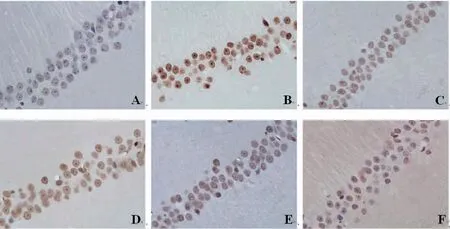
图2 各组大鼠海马神经元凋亡情况(TUNEL,×400)
与正常对照组比较,模型组大鼠海马神经元AI明显升高(P〈0.01);与模型组比较,丙戊酸钠组和藏红花素中、高剂量组大鼠海马神经元AI明显降低(P〈0.01);藏红花素低剂量组大鼠海马神经元AI与模型组比较,差异无统计学意义(P〉0.05);与丙戊酸钠组比较,藏红花素高剂量组AI明显降低(P〈0.01)。(见表2)
表2 各组大鼠海马神经元AI比较(±s)
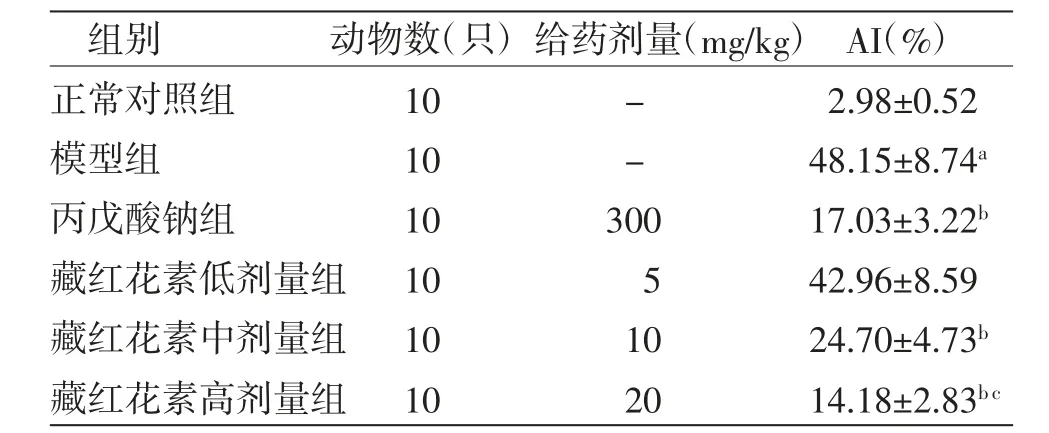
表2 各组大鼠海马神经元AI比较(±s)
注:与正常对照组比较,aP〈0.01;与模型组比较,bP〈0.01;与丙戊酸钠组比较,cP〈0.01
组别 动物数(只)给药剂量(mg/kg)AI(%)正常对照组 10 - 2.98±0.52模型组 10 - 48.15±8.74a丙戊酸钠组 10 300 17.03±3.22b藏红花素低剂量组 10 5 42.96±8.59藏红花素中剂量组 10 10 24.70±4.73b藏红花素高剂量组 10 20 14.18±2.83b c
2.4 各组大鼠海马组织SOD、CAT活力和MDA含量比较 与正常对照组比较,模型组大鼠海马组织SOD、CAT活力降低,MDA含量升高(P〈0.01);与模型组比较,丙戊酸钠组和藏红花素中、高剂量组大鼠海马组织SOD、CAT活力升高,MDA含量降低(P〈0.05或P〈0.01);藏红花素低剂量组大鼠海马组织SOD、CAT活力和MDA含量与模型组比较,差异均无统计学意义(P〉0.05);与丙戊酸钠组比较,藏红花素高剂量组大鼠海马组织SOD活力升高,MDA含量降低(P〈0.05或P〈0.01)。(见表3)
表3 各组大鼠海马组织SOD、CAT活力和MDA含量比较(±s)

表3 各组大鼠海马组织SOD、CAT活力和MDA含量比较(±s)
注:与正常对照组比较,aP〈0.01;与模型组比较,bP〈0.05,cP〈0.01;与丙戊酸钠组比较,dP〈0.05,eP〈0.01
组别 动物数(只)给药剂量(mg/kg)SOD(U/mg)CAT(U/mg)MDA(nmol/mg)正常对照组 10 - 2.73±0.35 55.31±6.59 7.24±1.46模型组 10 - 1.38±0.16a 44.87±4.62a 28.05±3.92a丙戊酸钠组 10 300 1.80±0.22c 50.15±5.40b 16.39±3.07c藏红花素低剂量组10 5 1.46±0.18 46.79±5.03 24.87±3.83藏红花素中剂量组10 10 1.91±0.24c 49.86±5.24b 20.16±3.17c藏红花素高剂量组10 20 2.36±0.30c e 52.37±5.86c 13.45±2.44c d
2.5 各组大鼠海马组织TNF-α、IL-1β、IL-6含量比较 模型组大鼠海马组织TNF-α、IL-1β、IL-6含量明显高于正常对照组(P〈0.01);丙戊酸钠组和藏红花素中、高剂量组大鼠海马组织TNF-α、IL-1β、IL-6含量明显低于模型组(P〈0.01);藏红花素低剂量组大鼠海马组织TNF-α、IL-1β、IL-6含量与模型组比较,差异均无统计学意义(P〉0.05);藏红花素高剂量组大鼠海马组织TNF-α、IL-6含量明显低于丙戊酸钠组(P〈0.01)。(见表4)
表4 各组大鼠海马组织TNF-α、IL-1β、IL-6含量比较(±s,pg/mL)

表4 各组大鼠海马组织TNF-α、IL-1β、IL-6含量比较(±s,pg/mL)
注:与正常对照组比较,aP〈0.01;与模型组比较,bP〈0.01;与丙戊酸钠组比较,cP〈0.01
组别 动物数(只)给药剂量(mg/kg)TNF-α IL-1β IL-6空白对照组 10 - 502.73±54.16 28.13±3.77 42.96±5.31模型组 10 - 1 142.35±128.40a 50.26±5.94a 99.05±10.72a丙戊酸钠组 10 300 680.17±83.26b 37.02±4.03b 59.17±5.73b藏红花素低剂量组10 5 1 039.52±131.08 46.14±5.52 91.42±9.86藏红花素中剂量组10 10 804.15±98.42b 40.32±4.79b 68.04±7.53b藏红花素高剂量组10 20 495.22±57.49b c 34.27±4.11b 51.16±4.60b c
2.6 各组大鼠海马组织GRP78、CHOP蛋白表达比较 与正常对照组比较,模型组大鼠海马组织GRP78、CHOP蛋白表达明显上调(P〈0.01);与模型组比较,丙戊酸钠组和藏红花素中、高剂量组大鼠海马组织GRP78、CHOP蛋白表达明显下调(P〈0.01);藏红花素低剂量组大鼠海马组织GRP78、CHOP蛋白表达与模型组比较,差异无统计学意义(P〉0.05);与丙戊酸钠组比较,藏红花素高剂量组大鼠海马组织GRP78、CHOP表达明显下调(P〈0.01)。(见图3、表5)
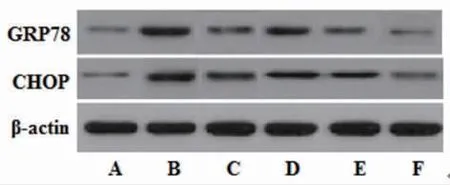
图3 各组大鼠海马组织GRP78、CHOP蛋白表达电泳图
表5 各组大鼠海马组织GRP78、CHOP蛋白表达比较(±s)
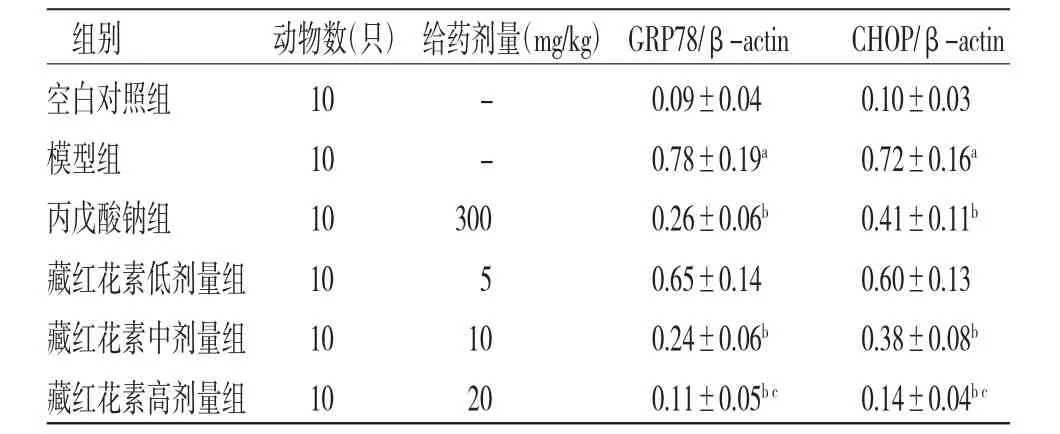
表5 各组大鼠海马组织GRP78、CHOP蛋白表达比较(±s)
注:与正常对照组比较,aP〈0.01;与模型组比较,bP〈0.01;与丙戊酸钠组比较,cP〈0.01
组别 动物数(只)给药剂量(mg/kg)GRP78/β-actin CHOP/β-actin白对照组 10 - 0.09±0.04 0.10±0.03型组 10 - 0.78±0.19a 0.72±0.16a戊酸钠组 10 300 0.26±0.06b 0.41±0.11b红花素低剂量组 10 5 0.65±0.14 0.60±0.13红花素中剂量组 10 10 0.24±0.06b 0.38±0.08b空模丙藏藏藏红花素高剂量组 10 20 0.11±0.05b c 0.14±0.04b c
2.7 各组大鼠海马组织Cleved Caspase-12、Bcl-2、Bax、NF-κB蛋白表达比较 与正常对照组比较,模型组大鼠海马组织Cleved Caspase-12、Bax、NF-κB蛋白表达明显上调,Bcl-2表达明显下调(P〈0.01),Bcl-2/Bax比值明显降低(P〈0.01);与模型组比较,丙戊酸钠组和藏红花素中、高剂量组大鼠海马组织Cleved Caspase-12、Bax、NF-κB蛋白表达明显下调,Bcl-2表达明显上调(P〈0.01),Bcl-2/Bax比值明显升高(P〈0.01);藏红花素低剂量组大鼠海马组织Cleved Caspase-12、Bcl-2、Bax、NF-κB蛋白表达与模型组比较,差异均无统计学意义(P〉0.05),藏红花素低剂量组大鼠海马组织Bcl-2/Bax比值明显高于模型组(P〈0.01);与丙戊酸钠组比较,藏红花素高剂量组大鼠海马组织Cleved Caspase-12、NF-κB表达明显下调而Bcl-2表达明显上调(P〈0.05或P〈0.01),Bcl-2/Bax比值明显升高(P〈0.01)。(见表6、图4)

图4 各组大鼠海马组织Cleved Caspase-12、Bcl-2、Bax、NF-κB蛋白表达电泳图
表6 各组大鼠海马组织Cleved Caspase-12、bcl-2、Bax、NF-κB蛋白表达及Bcl-2/Bax比值比较(±s)
注:与正常对照组比较,aP〈0.01;与模型组比较,bP〈0.01;与丙戊酸钠组比较,cP〈0.05,dP〈0.01
组别 动物数(只)给药剂量(mg/kg)Cleved Caspase-12/β-actin Bcl-2/β-actin Bax/β-actin NF-κB/β-actin Bcl-2/Bax空白对照组 10 - 0.13±0.03 0.95±0.16 0.04±0.02 0.03±0.02 23.75±4.86模型组 10 - 1.08±0.19a 0.07±0.04a 0.45±0.09a 0.98±0.20a 0.15±0.05a丙戊酸钠组 10 300 0.19±0.05b 0.73±0.14b 0.14±0.04b 0.35±0.08b 5.21±1.17b藏红花素低剂量组10 5 0.96±0.17 0.11±0.05 0.39±0.08 0.82±0.18 0.28±0.08b藏红花素中剂量组10 10 0.52±0.11b 0.32±0.07b 0.16±0.04b 0.50±0.12b 2.06±0.43b藏红花素高剂量组10 20 0.12±0.04b d 0.88±0.15b c 0.06±0.03b d 0.08±0.03b d 14.67±2.37b d
3 讨 论
EP是一种常见的慢性神经系统疾病,以感觉、意识、精神、行为等功能性障碍为主要临床表现,具有反复、急性自发的特点。EP发作是大脑神经元过度兴奋和同步异常放电所致,该过程导致神经元损伤或丢失使EP病情进行性加重,而海马体是最敏感的脑区。EP发病机制十分复杂,其中氧化应激和炎症反应是EP发作和神经退行性变的重要机制。
藏红花(又名番红花)是一种鸢尾科番红花属多年生植物,为我国传统中药品种,味甘、性平,具有活血化瘀、散郁开结之功效。藏红花素是藏红花的主要活性成分,具有良好的抗氧化、抗凋亡活性,较易通过血脑屏障,温彬等[7]研究发现藏红花素能够通过抑制氧化应激反应和神经元凋亡减轻大鼠缺血性脑损伤。丙戊酸钠是一种广泛应用于临床的广谱抗EP药,也是EP相关动物实验研究的常用阳性对照药物。EP动物模型的制备方法主要有电点燃和化学点燃两大类,其中Li-Pc化学点燃法制备的EP大鼠模型病理特征与人类高度相似,并且操作简便、重复性高,是目前公认的EP大鼠模型制作方法。本实验采用Li-Pc法制备EP大鼠模型,并以丙戊酸钠作为阳性对照药物,研究发现经藏红花素干预能够有效降低EP发作等级,抑制大脑海马组织病变和海马神经元凋亡,并且藏红花素高剂量组效果优于丙戊酸钠组,提示藏红花素对Li-Pc所致EP大鼠脑组织具有保护作用。
活性氧簇(reactive oxygen species,ROS)过剩是发生氧化应激反应的物质基础,EP发作时大脑神经元过度兴奋和异常放电导致ROS大量生成,抗氧化酶(SOD、CAT)被过度消耗,导致ROS代谢失衡而蓄积;过剩的ROS破坏核酸、蛋白质及生物膜脂质等分子结构,生成具有生物毒性的MDA,因此MDA含量和SOD、CAT活性能够反映机体氧化应激反应程度[12]。EP发病过程中大脑神经元过度兴奋将刺激炎症细胞因子(TNF-α、IL-1β、IL-6)大量释放,引发系列炎症反应进而导致海马神经元损伤;并且TNF-α、IL-1β作为炎性趋化因子能够刺激粒细胞而进一步释放炎症因子,形成炎症级联反应而加重炎症损伤[13];IL-6则能够刺激细胞大量产生活性氧(ROS)而加重氧化应激损伤[14]。本研究发现,藏红花素干预能够明显提高EP大鼠大脑海马组织SOD、CAT活力并降低MDA、TNF-α、IL-1β、IL-6含量,并且藏红花素高剂量组对CAT活力和MDA、TNF-α、IL-6含量的调控作用优于丙戊酸钠组,提示藏红花素对Li-Pc所致EP大鼠海马组织氧化应激损伤和炎症反应具有抑制作用。
内质网是一种膜性亚细胞器,GRP78是一种钙离子伴侣蛋白,对维持内质网稳态至关重要,既往研究发现病理性刺激细胞导致内质网过度应激时,导致大量错误折叠和未折叠的蛋白蓄积,进而诱导GRP78大量合成[15]。因此,GRP78升高可作为内质网应激标志检测物质。CHOP是重要的促凋亡信号分子,内质网应激将诱导CHOP表达上调,刺激Cleved Caspase-12表达,进而诱导细胞凋亡[16]。Bcl-2和Bax同属于Bcl-2蛋白家族,Bax能够诱导线粒体膜通透性异常升高,导致细胞色素C(Cyt C)释放而启动线粒体凋亡途径[17];Bcl-2则对线粒体膜通透性具有保护作用,并且Bcl-2能够与Bax形成二聚体而抑制其活性,所以Bax/Bcl-2表达比值能够反映二者对细胞线粒体凋亡途径的调控作用[18]。NF-κB能够刺激炎症因子(TNF-α、IL-1β)释放,抑制NF-κB表达则能够抑制炎症反应[19]。本研究发现,经藏红花素干预能够明显下调EP大鼠大脑海马组织GRP78、CHOP、Cleved Caspase-12、Bax、NF-κB蛋白表达并上调Bcl-2表达,提高Bcl-2/Bax比值,并且藏红花素高剂量组对GRP78、CHOP、Cleved Caspase-12、Bcl-2、NF-κB表达及Bcl-2/Bax比值的调控作用优于丙戊酸钠组,提示藏红花素对Li-Pc所致EP大鼠脑组织内质网应激具有抑制作用,这可能是藏红花素抑制氧化应激损伤和炎症反应的重要分子机制。
综上所述,藏红花素对Li-Pc所致EP大鼠脑组织具有保护作用,其作用机制可能与藏红花素抑制内质网应激通路介导的氧化应激和炎症反应有关。
